Benutzer:Orci/Namensreaktionen/F
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Faworski-Umlagerung | |||||
| Alexei Jewgrafowitsch Faworski | 1895 | α-Halogenketone, Base | Umlagerung | Carbonsäuren/-ester/-amide | [1] |

| |||||
| Faworski-Babayan-Reaktion (Faworski-Reaktion) | |||||
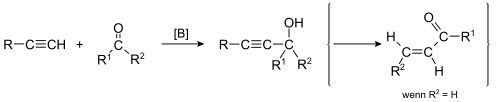
| Alexei Jewgrafowitsch Faworski, A. Babayan | 1905 | Alkine, Carbonylverbindungen, Base | Deprotonierung des Alkins, Nukleophiler Angriff | α-Carbonylalkene (bei Aldehyden), α-Hydroxyalkine (bei Ketonen) | [2] |
| |||||
| Feist-Bénary-Reaktion | |||||
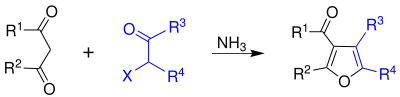
| Franz Feist, Erich Bénary | 1902, 1911 | α-Halogenketone, β-Ketoester, Base | basenkatsalysierte Kondensation mit Ringschluss | Furane | [3] |
| |||||
| Feldman-Vinylcyclopentan-Synthese | |||||
| Ken S. Feldman | 1988 | Cyclopropane, Alkene/Alkine, Radikalbildner | radikalische Addition | Vinylcyclopentane | [4] |
| Felkin-En-Cyclisierung | |||||
| Hugh Felkin | 1972 | Butadien, Grignard-Allyl-Reagenzien, Nickel-Triphenylphosphin-Komplexe | Cyclisierung | Vinylcyclopentane | [5] |
| Fenton-Reaktion | |||||
| Henry John Horstman Fenton | 1894 | organische Verbindungen, Wasserstoffperoxid, Eisensalze | Oxidation | Zerstörung der organischen Verbindungen | [6] |
| Ferrario-Ackermann-Reaktion (Ferrario-Reaktion) | |||||
| M. E. Ferrario, Fritz Ackermann | 1911 | Diarylether, Schwefel, Aluminium(III)-chlorid | Cyclisierung | Phenoxathiine | [7] |

| |||||
| Feringa–Pfaltz-asymmetrische Michael-Addition | |||||
| Ben Feringa, Andreas Pfaltz | 1997 | α,β-ungesättigte Ketone, Dialkylzinkverbindungen, BINOL, Cu(II)-Katalysator | Michael-Addition | stereoselektive Alkylierung in β-Position | [8][9] |
| Ferrier-Reaktion (Ferrier-I-Umlagerung) | |||||
| Robert J. Ferrier | 1962 | 2,3-ungesättigte Monosaccaride, Lewis-Säure | Umlagerung | 3,4-ungesättigte Glycoside | [10] |
| Ferrier-Carbocyclisierung (Ferrier-II-Umlagerung) | |||||
| Robert J. Ferrier | 1979 | Enolether, Quecksilber(II)-salz | Umlagerung | Ketone | [11] |

| |||||
| Fétizon-Oxidation | |||||
| Marcel Fétizon | 1968 | Alkohole, an Kieselgur adsorbiertes Silber(I)-carbonat | Oxidation | Carbonylverbindungen | [12] |

| |||||
| Fiesselmann-Thiophensynthese | |||||
| Hans Fiesselmann | 1954 | α,β-Alkinester, Thioglycolsäurederivate, Base | Thiophene | [13] | |
| Finegan-Tetrazolsynthese | |||||
| William Finnegan | 1958 | Azide, Nitrile | dipolare Cycloaddition | Tetrazole | [14] |
| Finkelstein-Reaktion | |||||
| Hans Finkelstein | 1910 | Halogenalkane, Natriumiodid | Halogenaustausch durch nucleophile Substitution | Iodalkane | [15] |
| Fischer-Oxazolsynthese | |||||
| Emil Fischer | 1896 | Cyanhydrine, Aldehyde, Salzsäure | Kondensation | Oxazole | [16] |

| |||||
| Fischersche Indolsynthese | |||||
| Emil Fischer | 1883 | Arylhydrazine, Ketone | Bindung eines Arylhydrazons, [3+3]-sigmatrope Umlagerung, Addition, Eliminerung | Indole | [17] |

| |||||
| Fischer-Phenylhydrazin-Synthese | |||||
| Emil Fischer | 1875 | aromatische Diazoverbindungen, Natriumsulfit, Säure | Bildung einer Hydrazinsulfonsäure, Hydrolyse | Phenylhydrazine | [18] |

| |||||
| Fischer-Phenylhydrazon- und Osazonsynthese | |||||
| Emil Fischer | 1887 | Aldehyde/Ketone, Phenylhydrazin | Kondensation | Phenylhydrazone und Osazone | [19] |
| Fischer-Helferich-Glycosylierung | |||||
| Emil Fischer, Burckhardt Helferich | 1893 | Monosaccharide, Alkohole/Thiole, Säure | Glykosylierung | O- oder S-Glycoside | [20] |

| |||||
| Fischer-Hepp-Umlagerung | |||||
| Otto Fischer, Eduard Hepp | 1886 | aromatisches Nitrosamin, Salzsäure | Umlagerung | aromatische Nitrosoverbindung | [21] |

| |||||
| Fischer-Speier-Veresterung | |||||
| Emild Fischer, Arthur Speier | 1895 | Carbonsäuren, Alkohole, Säure (Katalysator) | Nukleophile Substitution | Carbonsäureester | [22] |
| Fischer-Tropsch-Synthese | |||||
| Franz Fischer, Hans Tropsch | 1925 | Kohle, Wasser, Übergangsmetallkatalysator | Kohlevergasung, katalytische Hydrierung von CO | Kohlenwasserstoffe | [23] |
| Fischer-Veresterung | |||||
| Emil Fischer | 1895 | Carbonsäuren, Alkohole, Säure | katalytische Veresterung von Carbonsäuren | Carbonsäureester | [24] |

| |||||
| Fleming-Mah-Anthracensynthese | |||||
| Ian Fleming, Talat Mah | 1975 | Brombenzole, Ketenacetale, Natriumamid, Natriumborhydrid, Lithiumtetramethylpiperidid, Chlorbenzole | [2+2]-Cycloaddition und Hydrierung zum Benzocyclobutanol, Cyclisierung und Aromatisierung | Anthracene | [25] |
| Fleming-Tamao-Oxidation | |||||
| Ian Fleming, Kohei Tamao | 1983 | organische Siliciumverbindungen, Wasserstoffperoxid, Kaliumfluorid | Oxidation | primäre und sekundäre Alkohole | [26][27] |

| |||||
| Flood-Reaktion | |||||
| E.A. Flood | 1933 | Hexaalkyldisiloxane, Schwefelsäure, Ammoniumchlorid/-fluorid | Trialkylsilylhalogenide | [28] | |

| |||||
| Fokin-Triazolsynthese | |||||
| Valery Fokin | 2002 | Alkine, Azide, Kupfersulfat, Natriumascorbat | kupferkatalysierte Cycloaddition | Triazole | [29] |
| Forster-Diazoketonsynthese (Forster-Reaktion) | |||||
| Martin Onslow Forster | 1915 | α-Ketooxime, Chloramin | nukleophile Substitution am Chloramin, Wasserabspaltung, Abspaltung eines Protons | Diazoketone | [30] |

| |||||
| Forster-Decker-Reaktion | |||||
| Martin Onslow Forster, Hermann Decker | 1899,1913 | Primäre Amine, Benzaldehyd, Halogenalkan | Bildung eines Imins, Alkylierung, Hydrolyse unter Abspaltung von Benzaldehyd | sekundäre Amine | [31][32] |
| Franchimont-Reaktion | |||||
| Antoine Paul Nicolas Franchimont | 1872 | α-Bromcarbonsäure, Natriumcyanid | Kondensation | 1,2-Dicarbonsäuren | [33] |

| |||||
| Frankland-Duppa-Reaktion | |||||
| Edward Frankland, B.F. Duppa | 1863 | Oxalsäuredialkylester, Halogenalkane, Zink, Säure | Reduktion | 2-Hydroxycarbonsäurealkylester | [34][35] |

| |||||
| Frankland-Synthese | |||||
| Edward Frankland | 1849 | Alkylhalogenide, Zink | Alkylzinkverbindungen | [36] | |
| Fráter-Seebach-Alkylierung | |||||
| Georg Fráter, Dieter Seebach | 1980 | β-Hydroxyester, Base, Halogenalkane | diastereoselektive Alkylierung | Bildung einer C-C-Bindung in α-Stellung | [37][38] |

| |||||
| Freund-Reaktion | |||||
| August Freund | 1882 | 1,3-Dibrompropan, Natrium | Cyclisierung mittels einer intramolekularen Wurtzschen Synthese | Cyclopropan | [39] |

| |||||
| Friedel-Crafts-Acylierung | |||||
| Charles Friedel, James Crafts | 1877 | Aromaten, Carbonsäurechloride, Aluminiumtrichlorid | elektrophile aromatische Substitution | Acylaromaten | [40] |

| |||||
| Friedel-Crafts-Alkylierung | |||||
| Charles Friedel, James Crafts | 1877 | Aromaten, Cloralkane, Aluminiumtrichlorid | elektrophile aromatische Substitution | Alkylaromaten | [40] |

| |||||
| Friedländer-Chinolinsynthese | |||||
| Paul Friedländer | 1882 | α-Aminoaldehyde/-ketone, Aldehyde/Ketone | Aldolkondensation, interamolekulare Addition, Eliminierung | Chinoline | [41] |

| |||||
| Fries-Umlagerung | |||||
| Karl Theophil Fries | 1908 | Phenolester, Lewis-Säure | Umlagerung | 2- oder 4-Ketophenole | [42] |

| |||||
| Fritsch-Buttenberg-Wiechell-Umlagerung | |||||
| Paul Fritsch, Wilhelm Buttenberg, Heinrich Wiechell | 1894 | 1,1-Diaryl-2-brom-alkene, Base | Umlagerung | 1,2-Diarylalkine | [43] |

| |||||
| Fürstner-Indolsynthese | |||||
| Alois Fürstner | 1995 | Oxoamide, Titan(III)-chlorid, Kaliumgraphit | Bildung eines Titan-Graphit-Reagenzes, McMurry-Reaktion | Indole | [44] |

| |||||
| Fujimoto-Belleau-Reaktion | |||||
| George I. Fujimoto, B. Belleau | 1951 | Enollactone, Grignard-Reagenzien | α-substituierte-α,β-ungesättigte Ketone | [45][46] | |
| Fukuyama-Aminsynthese | |||||
| Tohru Fukuyama | 1995 | primäre Amine, Alkohole, 2,4-Dinitrobenzolsulfonylchlorid, DEAD, Triphenylphosphin, 2-Thioessigsäure | Bildung eines Sulfonamides, Mitsunobu-Reaktion | sekundäre Amine | [47] |

| |||||
| Fukuyama-Indolsynthese | |||||
| Tohru Fukuyama | 1994 | ο-Isocyanostyrole, Tributylzinnhydrid, AIBN | radikalische Cyclisierung | Indole | [48] |

| |||||
| Fukuyama-Reduktion | |||||
| Tohru Fukuyama | 1990 | Thioester, Triethylsilan, Palladium | Reduktion, Palladium-katalysierte Kreuzkupplung | Aldehyde | [49] |

| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Al. Faworsky: Ueber Isomerisationserscheinungen in den Reihen der Carbonylverbindungen gechlorter Alkohole und haloidsubstituirter Oxyde der Aethylenkohlen-wasserstoffe. In: Journal für Praktische Chemie. 51, 1894, S. 533–563, doi:10.1002/prac.18950510149.
- ↑ A.E. Favorsky: Action of potassium hydroxide on mixtures of ketones and phenylacetylene. In: Zhurnal Russkago Fiziko-Khimicheskago Obshchestva. 1905, 37, S. 643–645.
- ↑ Franz Feist: Studien in der Furan- und Pyrrol-Gruppe. In: Berichte der deutschen chemischen Gesellschaft. 35, 1902, S. 1537–1544, doi:10.1002/cber.19020350263; Erich Benary: Synthese von Pyridin-Derivaten aus Dichlor-aether und β-Amino-crotonsaeureester. In: Berichte der deutschen chemischen Gesellschaft. 44, 1911, S. 489–493, doi:10.1002/cber.19110440175.
- ↑ Ken S. Feldman, Anthony L. Romanelli, Robert E. Ruckle, Raymond F. Miller: Cyclopentane synthesis via free radical mediated addition of functionalized alkenes to substituted vinyl cyclopropanes. In: Journal of the American Chemical Society. 110, 1988, S. 3300, doi:10.1021/ja00218a050.
- ↑ Hugh Felkin, Gérard Swierczewski: Stereochemical evidence in favour of Π-allylnickel intermediates in the formation of olefins from allylic alcohols and grignard reagents, catalysed by nickel complexes. In: Tetrahedron Letters. 13, 1972, S. 1433, doi:10.1016/S0040-4039(01)84647-5.
- ↑ H. J. H. Fenton: Oxidation of tartaric acid in presence of iron. In: J. Chem. Soc., Trans.. 65, 1894, S. 899, doi:10.1039/ct8946500899.
- ↑ M. E. Ferrario: Sur la phénoxthine. In: Bull. Soc. Chim. France, 1911, Ser. 4 Nr. 9, S. 536 (Digitalisat auf Gallica); Fritz Ackermann: Verfahren zur Darstellung von Phenoxthin und dessen Derivaten, Deutsches Patent 234743, 19. Mai 1910.
- ↑ Ben L. Feringa, Mauro Pineschi, Leggy A. Arnold, Rosalinde Imbos, André H. M. De Vries: Hochenantioselektive katalytische 1,4-Addition und kombinierte 1,4-Addition/Aldolreaktion von Organozinkreagentien an Enone. In: Angewandte Chemie. 109, 1997, S. 2733, doi:10.1002/ange.19971092316.
- ↑ Andreas Knöbel, Iris Escher, Andreas Pfaltz: Enantioselective Copper-Catalyzed 1,4-Addition of Organozinc Reagents to Enones Using Chiral Oxazoline-Phosphite Ligands. In: Synlett. 12, 2000, S. 1429, doi:10.1055/s-1997-1048.
- ↑ R. J. Ferrier, W. G. Overend, A. E. Ryan: 712. The reaction between 3,4,6-tri-O-acetyl-D-glucal and p-nitrophenol. In: Journal of the Chemical Society. 1962, S. 3667, doi:10.1039/JR9620003667.
- ↑ Robert J. Ferrier: Unsaturated carbohydrates. Part 21. A carbocyclic ring closure of a hex-5-enopyranoside derivative. In: Journal of the Chemical Society, Perkin Transactions 1. 1979, S. 1455, doi:10.1039/P19790001455.
- ↑ Marcel Fétizon, Michel Golfier: Oxydation sélective des alcools par le carbonate d'argent. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. Série C. 1968, 267, S. 900 (Digitalisat auf Gallica).
- ↑ Hans Fiesselmann, Peter Schipprak: Ueber Oxythiophencarbonsaeureester, I. Mitteil.: Ueber die Anlagerung von Thioglykolsaeureester an Fumarsaeure-, Maleinsaeure- und Acetylendicarbonsaeureester). In: Chemische Berichte. 87, 1954, S. 835–841, doi:10.1002/cber.19540870608.
- ↑ William G. Finnegan, Ronald A. Henry, Robert Lofquist: An Improved Synthesis of 5-Substituted Tetrazoles. In: Journal of the American Chemical Society. 80, 1958, S. 3908, doi:10.1021/ja01548a028.
- ↑ Hans Finkelstein: Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 1528, doi:10.1002/cber.19100430257.
- ↑ Emil Fischer: Neue Bildungsweise der Oxazole. In: Berichte der deutschen chemischen Gesellschaft. 29, 1896, S. 205–214, doi:10.1002/cber.18960290143.
- ↑ Emil Fischer, Friedrich Jourdan: Ueber die Hydrazine der Brenztraubensaeure. In: Berichte der deutschen chemischen Gesellschaft. 16, 1883, S. 2241–2245, doi:10.1002/cber.188301602141.
- ↑ Emil Fischer: Ueber aromatische Hydrazinverbindungen. In: Berichte der deutschen chemischen Gesellschaft. 8, 1875, S. 589, doi:10.1002/cber.187500801178.
- ↑ Emil Fischer: Verbindungen des Phenylhydrazins mit den Zuckerarten II. In: Berichte der deutschen chemischen Gesellschaft. 20, 1887, S. 821, doi:10.1002/cber.188702001187.
- ↑ Emil Fischer: Ueber die Glucoside der Alkohole. In: Berichte der deutschen chemischen Gesellschaft. 26, 1893, S. 2400, doi:10.1002/cber.18930260327; B. Helferich, W. Schäfer.: α-METHYL d-GLUCOSIDE. In: Organic Syntheses. 6, 1926, S. 64, doi:10.15227/orgsyn.006.0064.
- ↑ Otto Fischer, Eduard Hepp: Zur Kenntniss der Nitrosamine. In: Berichte der deutschen chemischen Gesellschaft. 19, 1886, S. 2991, doi:10.1002/cber.188601902297.
- ↑ Emil Fischer, Arthur Speier: Darstellung der Ester. In: Berichte der deutschen chemischen Gesellschaft. 28, 1895, S. 3252, doi:10.1002/cber.189502803176.
- ↑ Franz Fischer, Hans Tropsch: Über die direkte Synthese von Erdöl-Kohlenwasserstoffen bei gewöhnlichem Druck. (Erste Mitteilung). In: Berichte der deutschen chemischen Gesellschaft. 59, 1926, S. 830, doi:10.1002/cber.19260590442.
- ↑ Emil Fischer, Arthur Speier: Darstellung der Ester. In: Berichte der deutschen chemischen Gesellschaft. 28, 1895, S. 3252, doi:10.1002/cber.189502803176.
- ↑ Ian Fleming, Talat Mah: A simple synthesis of anthracenes. In: Journal of the Chemical Society, Perkin Transactions 1. 1975, S. 964, doi:10.1039/P19750000964.
- ↑ Kohei Tamao, Neyoshi Ishida, Makoto Kumada: (Diisopropoxymethylsilyl)methyl Grignard reagent: a new, practically useful nucleophilic hydroxymethylating agent. In: The Journal of Organic Chemistry. 48, 1983, S. 2120, doi:10.1021/jo00160a046.
- ↑ Ian Fleming, Rolf Henning, Howard Plaut: The phenyldimethylsilyl group as a masked form of the hydroxy group. In: Journal of the Chemical Society, Chemical Communications. 1984, S. 29, doi:10.1039/C39840000029.
- ↑ E. A. Flood: Preparation of Triethylsilicon Halides. In: Journal of the American Chemical Society. 55, 1933, S. 1735–1736, doi:10.1021/ja01331a504.
- ↑ Vsevolod V. Rostovtsev, Luke G. Green, Valery V. Fokin, K. Barry Sharpless: A Stepwise Huisgen Cycloaddition Process: Copper(I)‐Catalyzed Regioselective “Ligation” of Azides and Terminal Alkynes. In: Angewandte Chemie. 114, S. 2708, doi:10.1002/1521-3757(20020715)114:14<2708::AID-ANGE2708>3.0.CO;2-0.
- ↑ Martin Onslow Forster: XXIX-Azotisation by chloroamine. In: Journal of the Chemical Society, Transactions. 107, 1915, S. 260, doi:10.1039/CT9150700260.
- ↑ Martin Onslow Forster: XCI-Influence of substitution on specific rotation in the bornylamine series. In: Journal of the Chemical Society, Transactions. 75, 1899, S. 934, doi:10.1039/CT8997500934.
- ↑ Herman Decker, Paul Becker: VI. Über die quaternären Salze der Alkylidenamine und eine allgemeine Methode der Alkylierung primärer Amine zu sekundären. In: Justus Liebig's Annalen der Chemie. 395, 1913, S. 362–377, doi:10.1002/jlac.19133950308.
- ↑ A. P. N. Franchimont: Ueber die Dibenzyldicarbonsäure. In: Berichte der deutschen chemischen Gesellschaft. 5, 1872, S. 1048–1050, doi:10.1002/cber.187200502138.
- ↑ E. Frankland: Vorläufige Notiz über die Synthese der Leucinsäure. In: Annalen der Chemie und Pharmacie. 126, 1863, S. 109, doi:10.1002/jlac.18631260115.
- ↑ E. Frankland, B. F. Duppa: Notizen aus Untersuchungen über die Säuren der Milchsäure-Reihe. II. Ueber die Einwirkung des Zinks auf eine Mischung von Jodäthyl und oxalsaurem Methyl.. In: Annalen der Chemie und Pharmacie. 135, 1865, S. 25, doi:10.1002/jlac.18651350103.
- ↑ E. von Frankland: Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten. In: Annalen der Chemie und Pharmacie. 71, 1849, S. 213, doi:10.1002/jlac.18490710206.
- ↑ Dieter Seebach, Daniel Wasmuth: Herstellung von -2-Hydroxybernsteinsäure-Derivaten aus Äpfelsäureester. Vorläufige Mitteilung . In: Helvetica Chimica Acta. 63, 1980, S. 197, doi:10.1002/hlca.19800630118.
- ↑ G. Fráter, U. Müller, W. Günther: The stereoselective α-alkylation of chiral β-hydroxy esters and some applications thereof. In: Tetrahedron. 40, 1984, S. 1269, doi:10.1016/S0040-4020(01)82413-3.
- ↑ August Freund: Ueber Trimethylen. In: Journal für Praktische Chemie. 26, 1882, S. 367, doi:10.1002/prac.18820260125.
- ↑ a b Charles Friedel, James Crafts: Sur une nouvelle méthode générale de synthèse d'hydrocarbures, d'acètones etc. In: Compt. Rend. 1877, 84, S. 1392-1395 (Volltext bei gallica).
- ↑ Paul Friedlaender: Ueber o-Amidobenzaldehyd. In: Berichte der deutschen chemischen Gesellschaft. 15, 1882, S. 2572–2575, doi:10.1002/cber.188201502219.
- ↑ K. Fries, G. Finck: Ueber Homologe des Cumaranons und ihre Abkoemmlinge. In: Berichte der deutschen chemischen Gesellschaft. 41, 1908, S. 4271–4284, doi:10.1002/cber.190804103146.
- ↑ Paul Fritsch: IV. Ueber die Darstellung von Diphenylacetaldehyd und eine neue Synthese von Tolanderivaten. In: Justus Liebig's Annalen der Chemie. 279, 1894, S. 319, doi:10.1002/jlac.18942790310; W. P. Buttenberg: Condensation des Dichloracetals mit Phenol und Toluol. In: Justus Liebig's Annalen der Chemie. 279, 1894, S. 324, doi:10.1002/jlac.18942790311; H. Wiechell: Condensation des Dichloracetals mit Anisol und Phenetol. In: Justus Liebig's Annalen der Chemie. 279, 1894, S. 337, doi:10.1002/jlac.18942790312.
- ↑ Alois Fuerstner, Achim Hupperts: Carbonyl Coupling Reactions Catalytic in Titanium and the Use of Commercial Titanium Powder for Organic Synthesis. In: Journal of the American Chemical Society. 117, 1995, S. 4468, doi:10.1021/ja00121a004.
- ↑ George I. Fujimoto: Labeling of Steroids in the 4-Position. In: Journal of the American Chemical Society. 73, 1951, S. 1856, doi:10.1021/ja01148a518.
- ↑ B. Belleau: The Reaction of Methylmagnesium Iodide with β-(1-Hydroxy-3,4-dihydro-2-naphthyl)-butyric Acid Lactone. In: Journal of the American Chemical Society. 73, 1951, S. 5441, doi:10.1021/ja01155a504.
- ↑ T. Fukuyama, Chung-Kuang Jow and Mui Cheung: 2- and 4-Nitrobenzenesulfonamides: Exceptionally versatile means for preparation of secondary amines and protection of amines. In: Tetrahedron Letters. 36, 1995, S. 6373–6374, doi:10.1016/0040-4039(95)01316-A.
- ↑ Tohru Fukuyama, Xiaoqi Chen, Ge Peng: A Novel Tin-Mediated Indole Synthesis. In: Journal of the American Chemical Society. 116, 1994, S. 3127, doi:10.1021/ja00086a054.
- ↑ Tohru Fukuyama, Shao Cheng Lin, Leping Li: Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether. In: Journal of the American Chemical Society. 112, 1990, S. 7050–7051, doi:10.1021/ja00175a043.