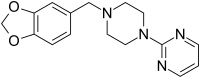
Piribedil
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Piribedil | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H18N4O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 298,34 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Piribedil (Handelsname in Deutschland: Clarium; Hersteller: Desitin) ist ein Arzneistoff aus der Gruppe der Dopaminagonisten, der in der Behandlung der Parkinsonschen Erkrankung eingesetzt wird. Piribedil ist ein Piperazin-Derivat und gehört damit zu den Non-Ergot-Dopaminagonisten. Neben der stimulierenden Wirkung auf die Dopamin-Rezeptoren D2/3 hemmt es die α2-Adrenorezeptor-Subtypen α2A und α2C.
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
Die Verbindung kann in einer vierstufigen Synthesesequenz hergestellt werden. Im ersten Schritt wird aus Brenzcatechin und Methylenchlorid das Benzodioxol[S 1] erhalten. Dieses wird dann in einer Blanc-Reaktion mit Formaldehyd in Gegenwart von Salzsäure und Zinkchlorid zum 5-Chlormethylbenzo[1,3]dioxol umgesetzt.[5] Die anschließende Reaktion mit Piperazin ergibt das 1-Benzo[1,3]dioxol-5-ylmethyl-piperazin,[6] welches im letzten Schritt mit 2-Chlorpyrimidin[S 2] zur Zielverbindung umgesetzt wird.[7]
Klinische Angaben[Bearbeiten | Quelltext bearbeiten]
Anwendungsgebiete (Indikationen)[Bearbeiten | Quelltext bearbeiten]
Piribedil ist zur Behandlung der frühen und fortgeschrittenen Parkinson-Krankheit sowohl in Mono- als auch in Kombinationstherapie mit L-Dopa zugelassen.
Gegenanzeigen (Kontraindikationen)[Bearbeiten | Quelltext bearbeiten]
Piribedil darf nicht angewendet werden
- bei Überempfindlichkeit gegenüber Piribedil
- bei kardiovaskulärem Schock
- in der akuten Phase eines Herzinfarktes
- in Kombination mit Neuroleptika (ausgenommen Clozapin)
Wechselwirkungen mit anderen Medikamenten[Bearbeiten | Quelltext bearbeiten]
Die gleichzeitige Anwendung von Neuroleptika und Piribedil kann zu psychotischen Störungen führen oder sie verstärken.
Anwendung während Schwangerschaft und Stillzeit[Bearbeiten | Quelltext bearbeiten]
Die Wirkungen von Piribedil bei Anwendung während Schwangerschaft und Stillzeit sind nicht ausreichend bekannt. Daher sollte Piribedil während Schwangerschaft und Stillzeit nicht angewendet werden.
Unerwünschte Wirkungen (Nebenwirkungen)[Bearbeiten | Quelltext bearbeiten]
Piribedils Nebenwirkungen sind dosisabhängig und treten meist nur bei Behandlungsbeginn auf und verschwinden nach Abbruch der Behandlung.
- Magen-Darm-Trakt: leichte Magen-Darm-Beschwerden (Übelkeit, Erbrechen, Blähungen) treten häufig auf. Sie verschwinden of wieder nach individueller Dosisanpassung.
- Nervensystem: Zerstreutheit, Halluzinationen, Erregung oder Schwindelgefühl wurden häufig beobachtet. Es kann zu Schläfrigkeit kommen; in sehr seltenen Fällen wurden übermäßige Tages-Schläfrigkeit sowie plötzliche Schlafanfälle beobachtet. Patienten, die mit Piribedil behandelt werden und die unter Schläfrigkeit bzw. plötzlichen Schlafanfällen leiden, müssen darüber informiert werden, dass sie kein Fahrzeug lenken oder anderen Aktivitäten nachgehen dürfen, bei denen sie oder andere durch eine Beeinträchtigung der Aufmerksamkeit Gefahr laufen, verletzt oder gar getötet zu werden (z. B. beim Bedienen von Maschinen).[8]
- Herz-Kreislauf-System: sehr selten wurden niedriger oder instabiler Blutdruck mit Synkopen oder Übelkeit beobachtet.
- Psychiatrische Erkrankungen: Zeichen von Spielsucht/pathologischem Spielen, Libidosteigerung und Hypersexualität wurden berichtet.
- Allergie: der Hilfsstoff Ponceau 4R, der in allen in Deutschland vermarkteten Piribedil-Präparaten enthalten ist (Stand Dezember 2017), kann allergische Reaktionen hervorrufen.
- Überdosierung: hohe Dosierungen von Piribedil führen zu Brechreiz. Daher kommen Überdosierungen sehr selten vor. Anzeichen einer Überdosis sind instabiler Blutdruck oder Übelkeit und Erbrechen.
Sonstige Informationen[Bearbeiten | Quelltext bearbeiten]
Geschichtliches[Bearbeiten | Quelltext bearbeiten]
Die Substanz wurde in den 1960er Jahren bei dem französischen Unternehmen Servier synthetisiert und seit Anfang der 1970er Jahre klinisch eingesetzt, zunächst in der Augenheilkunde[9] und bald danach auch bei der Parkinson-Erkrankung.[10] Piribedil wurde jedoch lange nur selten genutzt, da man annahm, dass sich seine Wirksamkeit auf die Reduzierung des Tremors bei der Parkinson-Erkrankung beschränken würde.[11]
Seit Mitte der 1970er Jahre wurde Piribedil häufig zur Behandlung von Gefäßkrankheiten[12] und leichten kognitiven Beeinträchtigungen[13] genutzt. Für diese Anwendungsgebiete war Piribedil auch in Deutschland seit 1975 als Trivastal im Handel.
Mittlerweile wurde Piribedil systematisch bei der Parkinson-Erkrankung nachuntersucht. Die Ergebnisse der CONTROL-[14] sowie der REGAIN-Studie[15] führten zu einer Neubewertung der Substanz und 2007 auch zu der o. a. Zulassung in Deutschland.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1292.
- ↑ a b M. Kuhnert-Brandstätter, L. Bösch: Polymorphe Arzneistoffe: Amisometradin, Bolandioldipripionat, Clominorex, Etaphedrinhydrochlorid und Piribedil. In: Sci. Pharm. 46, 1978, S. 62–67.
- ↑ a b Datenblatt Piribedil maleate salt bei Sigma-Aldrich, abgerufen am 21. April 2011 (PDF).
- ↑ M. Laubie, H. Schmitt, J. C. Le Douarec: Cardiovascular effects of the 1-(2" pyrimidyl)-5 piperonyl piperazine (ET495). In: Eur J Pharmacol. 6, 1969, S. 75–82. PMID 4389616.
- ↑ Schorygin u. a.: Chem. Zentralbl. 110 (1939) 2178.
- ↑ Wilson Cunico, Claudia R.B. Gomes, Marcele Moreth, Diogo P. Manhanini, Isabela H. Figueiredo, Carmen Penido, Maria G.M.O. Henriques, Fernando P. Varotti, Antoniana U. Krettli: Synthesis and antimalarial activity of hydroxyethylpiperazine derivatives In: Eur J Med Chem. 44, 2009, S. 1363–1368, doi:10.1016/j.ejmech.2008.04.009.
- ↑ A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2001, ISBN 1-58890-031-2.
- ↑ Fachinformation zum Präparat Clarium 50 mg, Firma Desitin, Stand Oktober 2017.
- ↑ J. Feuillerat, F. Jaubert, J. Vedy, M. Chovet: Le EU 4200 (Piribedil) en pratique ophtalmologique courante. Premiers resultats. In: Med Trop (Mars). 30, 1970, S. 215–235. PMID 5426024.
- ↑ R. D. Sweet, C. Wasterlain, F. H. McDowell: Piribedil–an oral dopamine agonist for treatment of Parkinson's disease. In: Trans Am Neurol Assoc. 99, 1974, S. 258–260. PMID 4463553.
- ↑ L. Smith, M. De Salvia, P. Jenner, C. D. Marsden: An appraisal of the antiparkinsonian activity of piribedil in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-treated common marmosets. In: Mov Disord. 11, 1996, S. 125–135. PMID 8684381.
- ↑ A. Piccinelli, G. Neri, A. Agnoli: Trattamento medico a lungo termine dei postumi delle cerebrovasculopatie acute (confronto papaverina-piribedil). In: Minerva Med. 65, 1974, S. 4199–4213. PMID 4610451.
- ↑ D. Nagaraja, S. Jayashree: Randomized study of the dopamine receptor agonist piribedil in the treatment of mild cognitive impairment. In: Am J Psychiatry. 158, 2001, S. 1517–1519. PMID 11532743.
- ↑ A. Castro-Caldas, P. Delwaide, W. Jost u. a.: The Parkinson-Control study: a 1-year randomized, double-blind trial comparing piribedil (150 mg/day) with bromocriptine (25 mg/day) in early combination with levodopa in Parkinson's disease. In: Mov Disord. 21, 2006, S. 500–509. PMID 16267842.
- ↑ O. Rascol, B. Dubois, A. C. Caldas u. a.: Early piribedil monotherapy of Parkinson's disease: A planned seven-month report of the REGAIN study. In: Mov Disord. 21, 2006, S. 2110–2115. PMID 17013922.
Anmerkungen[Bearbeiten | Quelltext bearbeiten]
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Benzodioxol: CAS-Nummer: 274-09-9, EG-Nummer: 205-992-0, ECHA-InfoCard: 100.005.448, PubChem: 9229, ChemSpider: 13881169, Wikidata: Q3544944.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Chlorpyrimidin: CAS-Nummer: 1722-12-9, EG-Nummer: 217-020-2, ECHA-InfoCard: 100.015.473, PubChem: 74404, Wikidata: Q72458863.
