Silbernitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
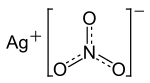
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silbernitrat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | AgNO3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, durchsichtige, nicht hygroskopische, rhomboedrische Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 169,87 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
440 °C (thermische Zersetzung)[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,01 mg·m−3[3] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−124,4 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Silbernitrat (trivial: Höllenstein, lateinisch Lapis infernalis ‚höllischer Stein‘) ist ein Salz der Salpetersäure. Es ist zusammengesetzt aus dem Kation Ag+ und dem Nitratanion NO3−.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Herstellung erfolgt durch Reaktion von Silber mit Salpetersäure unter Bildung nitroser Gase:[2]
oder durch die Reaktion von Salpetersäure mit Silberoxid ohne Bildung nitroser Gase:
Eigenschaften[Bearbeiten | Quelltext bearbeiten]


Silbernitrat, AgNO3, bildet farblose, tafelförmige Kristalle. Es ist sehr leicht in Wasser und schwer in Ethanol löslich. Silbernitrat hat einen Schmelzpunkt von 212 °C, bei Erhitzen auf etwa 440 °C erfolgt Zersetzung unter Abscheidung von metallischem Silber und Abgabe nitroser Gase. Es muss gut verschlossen und vor Licht geschützt (beispielsweise in braunen Glasflaschen) gelagert werden, da bereits geringe Staubmengen ausreichen, um Silbernitrat unter Lichteinwirkung zu feinverteiltem Silber zu reduzieren. Sehr reines Silbernitrat ist dagegen nicht lichtempfindlich. Silbernitrat bildet mit Chlorid-, Bromid-, Iodid- und Sulfidionen schwerlösliche Niederschläge.
- Gibt man Silbernitratlösung zu einer wässrigen Halogenidlösung, fällt festes weißes oder gelbes Silberhalogenid aus, Nitrat bleibt in Lösung.
Mit Basen (z. B. Natriumhydroxid) bildet sich Silber(I)-oxid:[7]
Silbernitrat denaturiert Eiweiß durch Bildung von Silbersalzen der Eiweiße (z. B. Silberalbuminat), in Lösungen flocken diese aus. Bei Hautkontakt bilden sich rasch schwarze Flecken, da die Silberionen zum Metall reduziert werden. Die Flecken können mit Kaliumiodidlösung und anschließendem Auswaschen mit einer Lösung aus Natriumthiosulfat (Fixiersalz) entfernt werden.
Verwendung[Bearbeiten | Quelltext bearbeiten]
- Silbernitrat ist ein Nachweisreagenz für Halogenide (Cl−-, Br−-, I−-Ionen) und Pseudohalogenide und wird zu deren quantitativen Bestimmung in der Titration nach Mohr oder nach Fajans verwendet. Fluoridionen (F−) lassen sich durch Niederschlag nicht nachweisen, da Silber(I)-fluorid als einziges Silberhalogenid gut wasserlöslich ist.
- Silbernitrat dient zum Nachweis von Aldehydgruppen und Proteinen. Nachweisbar sind z. B. die Aldehydgruppen von reduzierenden Zuckern wie Glucose und Lactose, siehe Tollensprobe. In der Proteinbiochemie wird Silbernitrat im Zuge einer Silberfärbung zum Anfärben von Proteinen verwendet, die z. B. in einem Polyacrylamid-Gel aufgetrennt wurden. In der Histologie kommt Silbernitrat zur Färbung von Gewebeschnitten, beispielsweise bei der Golgi-Cox-Methode, zum Einsatz. In der Kriminaltechnik (Daktyloskopie) wird eine Silbernitrat-Methanol-Lösung zur Sichtbarmachung von Fingerabdrücken benutzt.
- Silbernitrat ist Ausgangsstoff zur Darstellung anderer Silbersalze, besonders der Silberhalogenide, die in der Analogfotografie verwendet werden. Es dient zur galvanischen Versilberung, zur Herstellung von Silberspiegeln und als Haarfärbemittel.
- In der Medizin wird Silbernitrat als Antiseptikum und Adstringens (0,5%ige Lösungen zur lokalen Behandlung) sowie als Ätzmittel („Höllenstein-Ätzstift“, Österreich: „Lapisstift“) gegen Hautwucherungen, Geschwüre und Warzen benutzt. Bis vor einigen Jahren wurde Neugeborenen eine einprozentige Silbernitratlösung in die Augen getropft, um eine gonorrhoeische Augeninfektion zu verhindern (Credé-Prophylaxe); heute ist sie durch weniger toxische Substanzen ersetzt.[8] In der Tiermedizin wurde 1%ige Silbernitratsalbe (Unguentum Argenti nitrici, Syn. Unguentum nigrans, „schwarze Salbe“) zur Anregung chronischer Entzündungen eingesetzt.[9]
- In der Biotechnologie kann Silbernitrat als Additiv in Kulturmedien verwendet werden, beispielsweise für Kalluskulturen. Ziel ist hierbei, die als Ethylen-Antagonist wirkenden Silberionen[10] im Medium bereitzustellen. Vorteil ist hierbei die gute Wasserlöslichkeit des Silbernitrats, möglich wäre ansonsten auch die Verwendung von Silberchlorid oder einem ähnlichen Salz.
- Bei der komplexen Analytik der Triglyceride wird Silbernitrat zur Trennung der Triglyceride im Rahmen der Argentationschromatographie eingesetzt.[11]
- Silbernitrat wird für die Präparation von Geldscheinen verwendet, um Diebe oder Bankräuber zu identifizieren, da sich die Haut nach Berührung nicht abwaschbar schwarz färbt.[12]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Silbernitrat wirkt auf Haut und Schleimhäute stark reizend und ist in der Lage, lebendes Gewebe zu zerstören (Verätzung). Als Umweltgift bedarf es besonderer Entsorgung.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu SILVER NITRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d Eintrag zu Silbernitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Oktober 2014.
- ↑ a b c d e f g Eintrag zu Silbernitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Dimethyl Sulfoxide (DMSO) Solubility Data. Gaylord Chemical Company, L.L.C.; Bulletin 102, Juni 2014, S. 15. (PDF)
- ↑ Eintrag zu Silver nitrate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- ↑ E. Campaigne, W. M. LeSuer: 3-Thiophenecarboxylic (Thenoic) Acid In: Organic Syntheses. 33, 1953, S. 94, doi:10.15227/orgsyn.033.0094; Coll. Vol. 4, 1963, S. 919 (PDF).
- ↑ Axel Kramer: Klinische Antiseptik. Springer-Verlag, 2013, ISBN 978-3-642-77715-8, S. 253 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wörterbuch der Veterinärmedizin, 2. Aufl., S. 1263.
- ↑ E. M. Beyer: Potent inhibitor of ethylene action in plants. In: Plant Physiology. 1976, 58, 3, S. 268–271.
- ↑ K. Kemper, H.-U. Melchert, K. Rubach, H. Hoffmeister: Charakterisierung der Triglyceridmuster von pflanzlichen und tierischen Fetten sowie Human- und Tierseren mittels HPLC nach Vortrennung an AgNO3-imprägnierten Kieselgel-Minisäulen. In: Fresenius' Journal of Analytical Chemistry. Band 331, Nr. 6, 1988, S. 634–641, doi:10.1007/BF01032542.
- ↑ Carola Gessner: Schwarze Finger durch markiertes Geld. (Memento vom 9. Juli 2009 im Internet Archive) Süddeutsche Zeitung (vom 26. August 2007)







