Zink-Kohle-Zelle
Die Zink-Kohle-Zelle oder Zink-Kohle-Element, allgemeinsprachlich oft auch als Zink-Kohle-Batterie oder Zink-Kohle-Trockenbatterie bezeichnet, ist als galvanisches Element ein chemischer Energiespeicher zur Abgabe von elektrischer Energie. Die Zink-Kohle-Zelle ist eine Variante der Zink-Braunstein-Zellen und stellt eine Weiterentwicklung des historischen Leclanché-Elementes dar. Sie ist heute fast vollständig durch Alkali-Mangan-Batterien ersetzt.

Allgemeines[Bearbeiten | Quelltext bearbeiten]
Die Zink-Kohle-Zelle zählt zu den Primärelementen, da sie, anders als Akkumulatoren, nicht wiederaufladbar ist. Sie war bis in die 1970er Jahre in verschiedenen Baugrößen weit verbreitet, ist aber mittlerweile durch die technisch besseren und auslaufsichereren Alkali-Mangan-Zellen großteils verdrängt worden. Auch Anfang der 2020er Jahre werden aus Kostengründen Zink-Kohle-Zellen angeboten.
Die Zelle liefert eine Spannung von etwa 1,5 Volt. Durch Anordnung mehrerer Zellen in einem gemeinsamen Gehäuse in Reihenschaltung zu einer Batterie kann die verfügbare Klemmenspannung erhöht werden. Gebräuchlich sind noch Typen mit 4,5 V (3R12, „Flachbatterie“), 6 V (4R25, „Laternenbatterie“) oder 9 V (6F22, „9-Volt-Blockbatterie“). Auch in den kleineren und weiter verbreiteten Baugrößen AAA, AA, C und D sind sie wegen ihres im Vergleich zu Alkaline geringeren Preises noch vereinzelt erhältlich.
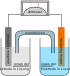
Aufbau[Bearbeiten | Quelltext bearbeiten]

Das Zink-Kohle-Element besteht aus einem Becher aus Zink (negativer Pol, Anode) und Mangandioxidpulver (Braunstein) als positivem Pol (Kathode) sowie einem zentrischen Stab aus Graphit zur Kontaktierung des Mangandioxids mit metallischer Kappe als elektrische Zuleitung. Als Elektrolyt wird eine 20-prozentige Ammoniumchloridlösung eingesetzt. Der elektrische Verbraucher wird zwischen die beiden Elektroden geschaltet.
Der Zinkbecher, der den Elektrolyten und den „Braunstein“ umschließt, stellt die Anode dar, welche durch die Entladung chemisch zersetzt wird. Bei entladenen Batterien ist der Zinkbecher nahezu aufgebraucht und die chemischen Substanzen können „ausrinnen“. Manche Zink-Kohle-Zellen besaßen als äußere Ummantelung lediglich eine Papphülse, welche das austretende Elektrolyt nur teilweise aufnimmt. Eine gewickelte Metall-Ummantelung kann die mechanische Stabilität der Zelle sowie durch eine Kunststoff-Folie unter dem Metall-Mantel die Auslaufsicherheit der Zelle erhöhen, verteuert aber die Zelle. Der Graphitstift in der Mitte der Braunsteinummantelung ist als positiver Außenkontakt der Zelle zur besseren Kontaktierung etwas herausgezogen und mit einer Metallkappe versehen.[1]
Alkali-Mangan-Zellen sind von Zink-Kohle-Zellen durch die Anordnung der Elektroden unterscheidbar: Bei Alkali-Mangan-Zellen in Rundbauform befindet sich der metallische Außenmantel, die Fläche unterhalb der für Herstellerbeschriftungen genutzten Kunststofffolie, auf positiven Potential. Bei Zink-Kohle-Zellen ist der Zylindermantel auf negativen Potential.
Probleme[Bearbeiten | Quelltext bearbeiten]

Zink-Kohle-Zellen sind preiswerter als Alkali-Mangan-Zellen herstellbar, aber in den technischen Daten schlechter. Das Hauptproblem der Zink-Kohle-Zelle ist das Auslaufen am Ende der Nutzungsdauer. Mitgelieferte Batterien im Bereich der Unterhaltungselektronik wie für Fernsteuerungen sind aus Preisgründen manchmal Zink-Kohle-Batterien.
Die wesentlichen Probleme der Zink-Kohle-Zelle sind:
- Zink-Kohle-Zellen sind prinzipiell nicht auslaufsicher (englisch leak proof), die Zink-Elektrode liegt außen und wird bei Entladung bzw. Selbstentladung zerfressen. Auslaufender Elektrolyt zerstört häufig Batteriekontakte und Leiterplatten. Aus diesem Grund soll man Zellen dieses Typs nicht in Geräten verwenden, in denen sie länger verbleiben, da durch die Selbstentladung die Auslaufgefahr weiter erhöht wird.
- Wie bei dem historischen Leclanché-Element besteht das Problem, dass ein Zinkkomplex (Diamminzinkchlorid, [Zn(NH3)2]Cl2) ausfällt. Dieser schwerlösliche Komplex setzt sich an den Elektroden des Elementes ab, wodurch sich der elektrische Widerstand erhöht, sodass in der Folge die lieferbare Maximal-Leistung schnell absinkt.
- Durch die bei der Nutzung schnell absinkende Anfangsspannung und die geringe Strombelastbarkeit ist die Zelle für viele Anwendungen mit höherer Belastung ungeeignet.
- Die Selbstentladung von Zink-Kohle-Elementen ist um etwa eine Größenordnung höher als die von Alkali-Mangan-Zellen, was diese für sporadisch genutzte Geräte oder zur Vorratshaltung unbrauchbar macht. Viele Geräte mit kurzzeitig hoher Stromaufnahme (z. B. manche Digitalkameras mit AA-Zellen) funktionieren gar nicht mehr mit Zink-Kohle-Zellen.
Reaktion (Entladungen)[Bearbeiten | Quelltext bearbeiten]
Minuspol (Anode):
Pluspol (Kathode):
Nachlieferung der nötigen Oxonium-Ionen aus dem Ammoniumchlorid-Elektrolyten:
Die entstandenen Ammoniakmoleküle werden von dem Zinkionen-Komplex gebunden:
Die Reaktion dieses Komplexes mit den Chloridionen aus dem Ammoniumchlorid:
Gesamtgleichung:
Entsorgung[Bearbeiten | Quelltext bearbeiten]
Batterien und Akkumulatoren gehören nicht in den Hausmüll oder in die Umwelt, da sie umweltrelevante und wiedergewinnbare Stoffe enthalten. Zink-Kohle-Batterien müssen in Deutschland, Österreich, Italien und der Schweiz, wie auch andere Batterien, fachgerecht entsorgt werden. Batterien verkaufende Einzelhandelsgeschäfte, viele Recyclinghöfe und Supermärkte haben zu diesem Zweck Sammelbehälter aufgestellt.[2]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Springer, 1998, ISBN 3-540-62997-1.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Batterietypen: So entsteht der Strom für unterwegs. In: test.de 02/2006. Stiftung Warentest – mehrfarbiges Schnittbild zum Vergleich von „Zink-Kohle-Batterie“=Zink-Braunstein-Zelle und Alkali-Mangan-Batterie, abgerufen am 7. August 2012.
- ↑ Bundesamt für Umwelt BAFU: Batterien, abgerufen am 28. Oktober 2020.



![{\displaystyle \mathrm {Zn^{2+}+2NH_{3}\rightarrow [Zn(NH_{3})_{2}]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f51d3ccfb704dec141ea010a773e103805d6d784)
![{\displaystyle \mathrm {[Zn(NH_{3})_{2}]^{2+}+2Cl^{-}\rightarrow [Zn(NH_{3})_{2}]Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/78f58f830ccfd9a84e7f562a36e80b4235f7c3d1)
![{\displaystyle \mathrm {Zn+2MnO_{2}+2NH_{4}Cl\rightarrow 2MnO(OH)+[Zn(NH_{3})_{2}]Cl_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b8f327b61da0a1d6825dddf0629ce6452034ede)