Acetylnitrat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Acetylnitrat | ||||||||||||
| Summenformel | C2H3NO4 | ||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 105,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
1,24 g·cm−3[1] | ||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
löslich in Acetonitril, Methylenchlorid[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Acetylnitrat ist eine chemische Verbindung aus der Gruppe der gemischten Säureanhydride. In der organischen Synthese wird es als Reagenz für Nitrierungs- und Oxidationsreaktionen verwendet.[1]
Geschichte
Eine erste Synthese aus Distickstoffpentoxid und Acetanhydrid wurde im Jahr 1907 von Amé Pictet und E. Khotinsky beschrieben.[2]
Gewinnung und Darstellung
Die Synthese der Verbindung erfolgt durch die Umsetzung von konzentrierter Salpetersäure mit Acetanhydrid.[4] Andere Synthesevarianten sind die Umsetzung von Salpetersäure mit Keten[5] oder die Reaktion von Acetylchlorid mit Silbernitrat in Acetonitril.[6] Eine Isolierung der Reinsubstanz erfolgt eher nicht, da die frisch hergestellten Lösungen meist als Reagenz eingesetzt werden.[1]
Eigenschaften
Die Verbindung ist thermisch instabil und neigt bei Erwärmung zum explosiven Zerfall.[2][7][8] Eine Explosion kann spontan beim schnellen Erhitzen ab 60 °C erfolgen. Die explosive Zersetzung kann auch an rauen Glasoberflächen initiiert werden. Der Kontakt mit Metalloxiden, wie Quecksilberoxid führt zur Explosion.[9] Eine Isolierung oder gar Destillation der Verbindung wird nicht empfohlen.[1][8] Die kontrollierte Thermolyse bei 60 °C führt unter anderem zu Stickoxiden und Tetranitromethan.[2] In den für Nitrierungen angewendeten Mischungen aus Salpetersäure und Acetanhydrid mit einem molaren Überschuss an Acetanhydrid liegt die Verbindung im Gleichgewicht mit den Ausgangsverbindungen und Essigsäure vor.[1][10]
In Mischungen mit einem molaren Überschuss an Salpetersäure wird zusätzlich Distickstoffpentoxid gebildet.[1][10]
Mischungen aus Salpetersäure und Acetanhydrid verschiedener Zusammensetzung neigen wegen des enthaltenen Acetylnitrats zu einer stark exothermen, explosionsartig verlaufenden Zersetzung. Die Zersetzungskinetik wurde mittels adiabatischer Kalorimetrie untersucht. Diese Zersetzung ist schon oberhalb von 35 °C relevant, so dass von einer Lagerung solcher Gemische abgeraten werden muss.[11]
Verwendung
Acetylnitrat kann für die elektrophile Nitrierung aromatischer Verbindungen eingesetzt werden. Mit Toluol wird bei Raumtemperatur ein Gemisch aus o-, m- und p-Nitrotoluol im Verhältnis von 60:3:37 erhalten.[12] Biphenyl ergibt die o- bzw. p-Substitutionsprodukte im Verhältnis von 58:42.[13] Die Nitrierung von Naphthalin und Pyren führt zu den 1-Nitroderivaten, während mit 3-Fluoranthracen oder Phenanthren eher die Nitrierung in der 9-Position bevorzugt ist.[14] CH-acide Verbindungen wie Acetoacetatester können analog nitriert werden.[15]

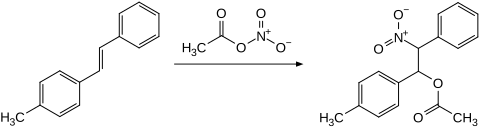
Alkene reagieren mit Acetylnitrat in einer Additionsreaktion unter Bildung von β-Nitroacetaten. Mit Cyclohexen wird das Additionsprodukt 2-Nitrocyclohexylacetat und nach Essigsäureeliminierung 3-Nitrocyclohexen gebildet.[16] 4-Methylstilben gibt das entsprechende Additionsprodukt.[17][18]
Bei Temperaturen unter 0 °C gelingt die gezielte Oxidation von Thioethern zu den entsprechenden Sulfoxiden.[19] Bei der Umsetzung mit Alkoholen können die entsprechenden aliphatischen Nitrate erhalten werden.[20]
Einzelnachweise
- ↑ a b c d e f g h i j Acetyl Nitrate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons, 1999–2013, abgerufen am 8. August 2013.
- ↑ a b c d A. Pictet, E. Khotinsky: Über Acetylnitrat. in Chem. Ber. 40, 1907, S. 1163–1166, doi:10.1002/cber.190704001172.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. E. Folsum, J. Castrillon: The Controlled Oxidation of Organic Sulfides to Sulfoxides with the Help of O-Iodosylbenzoic Acid. In: Synth. Commun. 22, 1992, S. 1799–1806, doi:10.1080/00397919208020500.
- ↑ Patent DE849405: Verfahren zur Herstellung von Acetylnitrat. Angemeldet am 3. Januar 1952, veröffentlicht am 17. Juli 1952, Anmelder: Farbwerke Hoechst, vormals Meister Lucius & Brüning, Erfinder: Martin Reuter.
- ↑ G. A. Olah, H. C. Lin, J. A. Olah, S. C. Narang: Electrophilic and free radical nitration of benzene and toluene with various nitrating agents. In: Proc. Natl. Acad. Sci. USA. 75, 1978, S. 1045.
- ↑ W. König: Acetylnitrat-Explosion. In: Angew. Chem. 67, 1955, S. 157, doi:10.1002/ange.19550670508.
- ↑ a b P. G. Urben: Bretherick's Handbook of Reactive Chemical Hazards. 6. Auflage. Vol. 1, Butterworth/Heinemann 1999, S. 283–284.
- ↑ L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Acetylnitrat, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.
- ↑ a b V. Gold, E. D. Hughes, C. K. Ingold: Kinetics and mechanism of aromatic nitration. Part V. Nitration by acyl nitrates, particularly by benzoyl nitrate. In: J. Chem. Soc. (Resumed) 1950, S. 2467–2473, doi:10.1039/JR9500002467.
- ↑ R. Andreozzi, R. Marotta, R. Sanchirico: Thermal decomposition of acetic anhydride-nitric acid mixtures. In: J. Hazard. Mat. A90, 2002, S. 111–121, doi:10.1016/S0304-3894(01)00356-9.
- ↑ H. Burton, P. F. G. Praill: The structure of acyl nitrates. In: J. Chem. Soc. 1955, S. 729–731, doi:10.1039/JR9550000729.
- ↑ E. Hayashi, K. Inana, T Ishikawa: In: Yakugaku Zasshi. 79, 1959, S. 972.
- ↑ L. I. Velichko, O. I. Kachurin, E. Y. Balabanov: In: Ukr. Khim. Zh. (Russ. Ed.) 49, 1983, S. 1293.
- ↑ S. Sifniades: Nitration of acetoacetate esters by acetyl nitrate. High yield synthesis of nitroacetoacetate and nitroacetate esters. In: J. Org. Chem. 40, 1975, S. 3562–3566, doi:10.1021/jo00912a020.
- ↑ F. G. Bordwell, E. Garbisch: Nitrations with Acetyl Nitrate. I. The Nature of the Nitrating Agent and the Mechanism of Reaction with Simple Alkenes. In: J. Am. Chem. Soc. 82, 1960, S. 3588–3598, doi:10.1021/ja01499a029.
- ↑ G. Drefahl, H. Crahmer: Untersuchungen über Stilbene, XV. Die Addition von Acetylnitrat an Stilbene. In: Chem. Ber. 91, 1958, S. 745–750, doi:10.1002/cber.19580910406.
- ↑ G. Drefahl, H. Crahmer: Untersuchungen über Stilbene, XVI. Addition von Acetylnitrat an substituierte Stilbene. In: Chem. Ber. 91, 1958, S. 750–754, doi:10.1002/cber.19580910407.
- ↑ R. Louw, H. P. W. Vermeeren, J. J. A. van Asten, W. J. Ultee: Reaction of sulphides with acyl nitrates; a simple and rapid method for preparing sulphoxides. In: J. Chem. Soc., Chem. Commun. 1976, S. 496–497, doi:10.1039/C39760000496.
- ↑ T. G. Bonner: Nitration of alcohols at oxygen centres. Part III. The reaction of nitric acid and 2,4-dinitrobenzyl alcohol in acetic anhydride–acetic acid solvent-. In: J. Chem. Soc. 1959, S. 3908–3913, doi:10.1039/JR9590003908.

