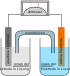
Lithium-Thionylchlorid-Batterie

Die Lithium-Thionylchlorid-Batterie ist eine nicht wiederaufladbare Lithiumbatterie mit Lithium als Anode und einer Graphitelektrode als Kathode, wobei das Thionylchlorid kathodisch reduziert wird und gleichzeitig als Lösungsmittel und Elektrolyt dient.
Eigenschaften

Die Leerlaufspannung der Zelle beträgt 3,7 V und die typische Lastspannung 3,4 V. Aufgrund der geringen Selbstentladung hat sich dieser Batterietyp gegenüber anderen Oxyhalogeniden wie Phosphoroxychlorid (POCl3) oder Sulfurylchlorid (SO2Cl2) durchgesetzt. Die Energiedichte beträgt für Knopfzellen ca. 700 mWh/cm³ und die Selbstentladung 0,08 bis 0,16 %/Monat, bzw. 1–2 %/Jahr bei einer Lagerfähigkeit von 10 Jahren.
Elektrochemie
Beim Entladevorgang wird Lithium anodisch unter Elektronenabgabe zu Lithiumionen (Li+) oxidiert, die zu Lithiumchlorid reagieren. Thionylchlorid wird über mehrere Reaktionsschritte kathodisch zu elementarem Schwefel reduziert, wobei gleichzeitig Schwefeldioxid entsteht. Die Gesamtgleichung kann folgendermaßen formuliert werden:
Die kathodisch entstandenen Reaktionsprodukte lagern sich in den Poren der hochporösen Kohlenstoffelektrode ab. Schwefeldioxid löst sich teilweise im Elektrolyten. Das anodisch entstandene Lithiumchlorid lagert sich kristallin auf dem Lithium ab und bildet einen Schutzfilm, der das Lithium vor einem Angriff des Lösungsmittels schützt und damit die Selbstentladung verringert. Wird eine Lithium-Thionylchlorid-Batterie über längere Zeit nicht oder mit nur geringen Strömen entladen, kann es zu einer Passivierung der Anode kommen. Hierbei setzt sich das bei der Redoxreaktion entstandene Lithiumchlorid an der Anode ab und bildet, je nach Elektrolytzusammensetzung kubische oder oktaedrische polykristalline Strukturen. Dies kann zu Spannungseinbrüchen im Einschaltmoment auf bis zu 2,5 V führen. Mit Stromdichten von ca. 2 µA/cm², je nach Zelldesign und Hersteller, kann diese Passivierungsschicht nachhaltig von der Anode gelöst werden. Die Lithiumchlorid-Partikel bilden eine Dispersion in der flüssigen Kathode.
Der Elektrolyt Thionylchlorid enthält außerdem noch ein Leitsalz, vor allem Lithiumtetrachloroaluminat (LiAlCl4). Dies beeinflusst die Selbstentladungs- und Passivationseigenschaften, da es sich auf die Kristallisation des Lithiumchlorids auswirkt.
Trivia
Dieser Zelltyp wurde auch im Marsrover Sojourner während der Mars-Pathfinder-Mission eingesetzt.
Literatur
- Günter Eichinger, Günter Semrau: Lithiumbatterien II – Entladereaktionen und komplette Zellen. In: Chemie in unserer Zeit 24, Nr. 2, 1990, S. 90–96, doi:10.1002/ciuz.19900240209.
- Sijie Cheng, Bimei Li, Zhongzhi Yuan, Fuyi Zhang, Jincheng Liu: Development of a lifetime prediction model for lithium thionyl chloride batteries based on an accelerated degradation test. In: Microelectronics Reliability. Band 65, 1. Oktober 2016, S. 274–279, doi:10.1016/j.microrel.2016.07.152.
Weblinks
- Long life lithium batteries by Tadiran, proven 40-year operation life! Tadiran Batteries, abgerufen am 14. Januar 2021.