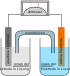
Vanadium-Redox-Akkumulator



Der Vanadium-Redox-Akkumulator (Vanadium-Redox-Flow-Batterie, kurz VRFB) ist ein Akkumulator in der Art einer Redox-Flow-Batterie. In beiden Elektrolyten werden Vanadiumverbindungen in wässrigen Lösungen benutzt. Dadurch wird das Problem einer gegenseitigen Verunreinigung infolge der Diffusion von Ionen durch die Membran verhindert.
Historisches[Bearbeiten | Quelltext bearbeiten]
Die Idee, Vanadiumverbindungen in einem Akkumulator zu nutzen, gab es bereits 1933.[1] 1976 ließ sich Lawrence H. Thaller, damals ein NASA-Mitarbeiter, die Verwendung eines Vanadiumsalzes in Redoxflusszellen patentieren. Er schlug damals Vanadiumchlorid vor.[2] Die Paarung Vanadium-Vanadium ließ sich 1978 Alberto Pellegri patentieren.[3][4] Eine erfolgreiche Demonstration und Weiterentwicklung fand erst in den 1980er Jahren an der University of New South Wales durch Maria Skyllas-Kazacos und ihre Mitarbeiter statt.[5][6] Skyllas-Kazacos und die University of New South Wales ließen sich die Form mit Schwefelsäure-Elektrolyten 1986 patentieren.[7] 1998 verkaufte die Universität die Patente an eine australische Firma (Pinnacle VRB). Nach einigen Umstrukturierungen und Übernahmen wurden die Patente schließlich von der Firma Prudent Energy übernommen. Die ursprünglichen Patente liefen 2006 aus, was einen freien Markt ermöglichte und zu kommerziellen Entwicklungen führte.[8]
Allgemeines[Bearbeiten | Quelltext bearbeiten]
Der Vanadium-Redox-Akkumulator nutzt die Fähigkeit von Vanadium aus, in Lösung vier verschiedene Oxidationsstufen annehmen zu können, sodass statt zwei nur ein elektroaktives Element für den Akkumulator benötigt wird. Die Quellenspannung (Spannung ohne Belastung) pro Zelle liegt zwischen 1,15 V und 1,55 V. Bei 25 °C beträgt sie 1,41 V.
Die Elektroden bestehen aus Kohlenstoff, deren Struktur hat wesentlichen Einfluss auf die Eigenschaften.[9] Die Elektroden und die beiden Elektrolyt-Vorräte sind durch eine Membran getrennt, die idealerweise nur Wasserstoffionen passieren lässt.
Wie bei allen Redox-Flow-Batterien ist ein Hauptvorteil des Vanadium-Redox-Akkumulators, dass Leistung und Kapazität im Gegensatz zu gewöhnlichen Sekundärzellen voneinander unabhängig sind. Die Leistung ist v. a. durch die Elektrodenfläche, die Speicherkapazität durch die Elektrolytmenge regulierbar. Auch ist eine Tiefentladung schadlos. Jedoch besitzt er eine vergleichsweise geringe Energiedichte von ca. 15 bis 25[10] bzw. 25 bis 35[11] Wattstunden pro Liter Elektrolytflüssigkeit. Die massebezogene Energiedichte beträgt dementsprechend 20 bis 32 Wh/kg Elektrolyt.[11]
Der Hauptnachteil der Vanadium-Redox-Akkumulator-Technologie sind neben dem schlechten Volumen-Energie-Speicherverhältnis der im Vergleich zu herkömmlichen Akkumulatoren kompliziertere Gesamtaufbau, der auch Pumpen und Vorratstanks umfasst.
Durch die stets gegebene geringe Durchlässigkeit der Membran auch für Vanadium-Ionen kommt es zur Selbstentladung und zum Kapazitätsverlust.[11]
Die Gesamt-Energie-Effizienz (round trip efficiency) wird auch durch die Pumpen verringert und beträgt ca. 62 bis 85 %.[12]
Zu den Vorteilen gehört die Zyklenfestigkeit und das „Laden“ per Elektrolytaustausch. Nach einer Studie aus dem Jahr 2016[13] hat eine solche Batterie innerhalb eines dreijährigen Tests über 200.000 Lade-/Entladezyklen durchlaufen.
Reaktionsgleichungen[Bearbeiten | Quelltext bearbeiten]

Der Vanadium-Redox-Akkumulator nutzt in beiden Halbzellen Redoxpaare des Vanadiums.
Die Lösung auf der Anoden-Seite enthält Vanadylsulfat (Vanadin(IV)-oxidsulfat, VOSO4, blau), das zum gelben fünfwertigen Ion oxidiert werden kann: [14]
Positive Elektrode (Anode) V(4+) und V(5+):
- VO2+ + H2O ⇌ VO2+ + 2 H+ + e− (E0 = 0,995 V vs. SHE)
Die Lösung der Kathoden-Seite enthält Vanadium(III)-sulfat (grün), das zum zweiwertigen, violetten Vanadiumsalz reduziert werden kann:
Negative Elektrode (Kathode):
- V3+ + e− ⇌ V2+ (E0 = −0,255 V vs. SHE).
Nebenreaktionen[Bearbeiten | Quelltext bearbeiten]
Während des Ladens können – vor allem bei großen Stromdichten – an den Elektroden unerwünschte Nebenprodukte entstehen: Auf der Anode entsteht Sauerstoff (O2) oder durch Reaktion mit dem Kohlenstoff der Elektrode Kohlenstoffdioxid. An der Kathode entsteht Wasserstoff (H2).
Anode: 6 H2O ⇌ O2 + 4 H3O+ + 4 e−
Anode: 6 H2O + C ⇌ CO2 + 4 H3O+ + 4 e−
Kathode: 2 H3O+ + 2 e− ⇌ H2 + 2 H2O
Diese Reaktionen verringern die Effizienz der Energiespeicherung. Auch muss die Ansammlung des brennbaren Wasserstoffgases vermieden werden.
Durch Reaktion des entstehenden Sauerstoffs mit der Graphitelektrode wird diese durch Verbinden des Sauerstoffs mit dem Kohlenstoff verschlissen, man überwacht daher beim Laden die Zellspannung, um zu hohes, zum Gasen führendes Anodenpotential zu vermeiden. Dadurch kann Anodenverschleiß fast gänzlich vermieden werden und es werden sehr hohe Zyklenzahlen erreicht.[9]
Betriebssicherheit[Bearbeiten | Quelltext bearbeiten]
Vanadium-Redoxflusszellen haben insbesondere gegenüber den Lithium-Ionen-Akkumulatoren eine höhere Betriebssicherheit, da der Elektrolyt aufgrund seines hohen Wasseranteils weder brennbar noch explosiv ist. In einem Test überstand eine VRFB einen absichtlich herbeigeführten Kurzschluss unbeschadet.[15] Aufgrund der Trennung zwischen den leistungsbestimmenden elektrochemischen Zellen und dem Vorratstanks, die die Kapazität bestimmen, ist immer nur ein geringer Teil des Elektrolyten in der Wandlereinheit, dem sogenannten Stack, wirksam. Unter anderem für Lithium-Ionen-Zellen typische Alterungs- und Versagensmechanismen, wie die mögliche Bildung von Dendriten, Elektrolytmangel und thermisches Durchgehen, sind für wässrige Redoxflusszellen nicht relevant. Das Auslaufen von Elektrolyt wird mit doppelwandigen Tanks vermieden.[16] Üblich ist eine Überwachung der Zellspannung, um das Gasen zu vermeiden, und eine Überwachung des Elektrolyten. Beim Laden mit großen Stromdichten kann durch Wasserelektrolyse Wasserstoffgas als Nebenprodukt entstehen, was durch Strombegrenzung und Belüftung vermieden wird.
Anwendungen[Bearbeiten | Quelltext bearbeiten]

Die momentan erhältlichen kommerziellen Batterien werden ausschließlich stationär verwendet, z. B. im Bereich der Erneuerbaren Energien für die Abdeckung von Spitzenlast und als Lastausgleich, außerdem bei Unterbrechungsfreien Stromversorgungen (USV).[17] Mit Stand Mai 2017 sind weltweit über 40 große Vanadium-Redox-Flow-Akkumulatoren im Betrieb.[18] Davon haben 10 eine Leistung von 1 MW und mehr; 10 befinden sich in China, 5 in den USA und 5 in Japan.[18] Die meisten großen Vanadiumakkus wurden in der Nähe von Windparks oder großen Photovoltaik-Freiflächenanlagen errichtet. Die größte derartige Batterie steht in Japan und leistet bis zu 15 MW. Auch in Deutschland sind einige Vanadium-Redox-Flow-Systeme im Einsatz, darunter drei mit Leistungen von 200 kW bis 325 kW, sowie mehrere Systeme von 10 kW (z. B. im Alten Land) oder 20 kW (z. B. in Freiberg am Neckar).[18] Weltweit werden auch viele kleinere Systeme betrieben.
Die größten Vanadium-Redox-Flow-Akkumulatoren[Bearbeiten | Quelltext bearbeiten]
Der größte Vanadium-Redox-Flow-Akkumulator Deutschlands mit 660 m3 Tankinhalt und 2 MW Leistung und 20 MWh Energiespeicherkapazität wurde im September 2019 fertiggestellt.[19][20][21]
Die größte Batterie der Welt ist ebenfalls ein Vanadium-Redox-Flow-Akkumulator. Sie hat eine Spitzenleistung von 100 MW und kann 400 MWh Energie speichern. Sie wurde im Nordosten Chinas auf der Halbinsel bei Dalian installiert und ging im Oktober 2022 ans Netz. Sie besteht aus zehn Einheiten mit je 20 MW und 80 MWh. Geliefert wird sie von den Industriepartnern Rongke Power und UniEnergy Technologies (UET); die Kosten liegen bei 266 Millionen Dollar. In einer zweiten Ausbauphase ist die Verdoppelung der Kapazität geplant.[22]
| Batteriespeicherwerk | Standort | Leistung | Energie | Zeit | Inbetriebnahme
Datum |
Betreiber | Hersteller | Primärenergie | Belege |
|---|---|---|---|---|---|---|---|---|---|
| Dalian Rongke Power | 100 (200) | 400 (800) | 4 | 29.09.2021 | Dalian Rongke Power | Rongke Power | Solar und Wind | [23] | |
| Minami Hayakita | 15 | 60 | 4 | 06.01.2016 | Hokkaido Electric Power (HEPCO) | Sumitomo Electric Industries | Solar (111 MW[24]) | [25][26] | |
| GuoDian LongYuan | 5 | 10 | 2 | 15.03.2013 | Longyuan Power | Rongke Power | Wind (Windpark Woniushi) | [27][28][29] | |
| Tomamae | 4 | 6 | 1,5 | 01.01.2005 | Hokkaido Electric Power (HEPCO) | Sumitomo Electric Industries | Wind 30,6 MW | [30] | |
| Sumitomo Densetsu | 3 | 0,8 | 0,27 | 01.02.2000 | Sumitomo Electric Industries | [31] | |||
| Zhangbei National V | 2 | 8 | 4 | 01.12.2011 | State Grid Corporation of China (SGCC) | Prudent Energy | Wind (100 MW) und Solar (40 MW)[32] | [33][34] | |
| Everett | 2 | 8 | 4 | 28.03.2017 | Snohomish County PUD | UniEnergy Technologies | [35] | ||
| San Diego | 2 | 8 | 4 | 16.03.2017 | San Diego Gas and Electric (SDG&E) | Sumitomo Electric (SEI) | [36][37] | ||
| Tottori Sanyo Electric | 1,5 | 1,5 | 1 | 01.04.2001 | Sumitomo Electric Industries | [38][39][40] | |||
| Yokohama | 1 | 5 | 5 | 24.07.2012 | Sumitomo Electric Industries | Solar 0,2 MW | [41] | ||
| Avista Pullman | 1 | 3,2 | 3,2 | 17.06.2015 | Avista | UniEnergy Technologies | [42] | ||
| Braderup | 0,325 | 1 | 3 | 15.09.2014 | Energiespeicher Nord | Vanadis Power (Rongke Power) | Wind (19,8 MW, Bürgerwindpark) | [43][44] | |
| Bielefeld | 0,26 | 0,65 | 2,5 | 15.09.2011 | Gildemeister Energy Solutions | Wind (1 MW) | [45] | ||
| Pellworm | 0,2 | 1,6 | 8 | 09.09.2013 | Gildemeister Energy Solutions | Wind 0,3 MW und Solar 0,77 MW (Hybridkraftwerk Pellworm) | [46] | ||
| RedoxWind Pfinztal | 2 | 20 | 10 | ??.09.2019 | Fraunhofer-Institut für Chemische Technologie | Fraunhofer-Institut für Chemische Technologie | Wind (2 MW) | [19][20][21] |
Eignung zum Einsatz in Fahrzeugen[Bearbeiten | Quelltext bearbeiten]
Die Energiedichte pro Masse der Vanadium-Redox-Flow-Batterie ist für Batterien mit 90 kW und mehr höher als die einer Bleibatterie.[47] Man kann sie jedoch durch Austausch der Elektrolyte schnell wieder aufladen, beispielsweise an speziellen Tankstellen.[47] Daher wurde die VRFB eine Zeit lang als Energiespeicher für Elektroautos diskutiert. 1994 wurde ein Golfmobil in Sydney mit einer VRFB ausgestattet.[48] Für leistungsstarke Elektroautos ist die VRFB jedoch keine Option. Auch die volumetrische Energiedichte der VRFB ist zu klein, d. h. sie bräuchte in einem Fahrzeug viel Platz.[47] Außerdem wird die VRFB von Lithiumionenakkumulatoren hinsichtlich volumen- und massebezogener Energiedichte weit übertroffen.[47], auch der Wirkungsgrad ist niedriger als derjenige von Lithiumionenakkus.
Forschung und Entwicklung[Bearbeiten | Quelltext bearbeiten]
Erforscht werden kostengünstige Membranen[49] als Alternative zu Nafion und hochkonzentrierte, über weite Temperaturbereiche stabile Elektrolyte.[50] Auch werden Katalysatoren zur Erhöhung der Austauschstromdichte und damit zur Effizienzsteigerung entwickelt.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Seite der University of New South Wales zum Vanadium-Redox-Akkumulator (engl.)
- Forschung am Fraunhofer-Institut für Chemische Technologie ICT
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ P. A. Pissoort, im französischen Patent Nummer 754065 vom 30.10.1933
- ↑ Patent US3996064: Electrically rechargeable REDOX flow cell. Angemeldet am 22. August 1975, veröffentlicht am 7. Dezember 1976, Anmelder: National Aeronautics And Space Administration NASA, Erfinder: Lawrence H. Thaller.
- ↑ Patent GB2030349: Process and Accumulator, for Storing and Releasing Electrical Energy. Angemeldet am 10. Juli 1978, veröffentlicht am 2. April 1980, Anmelder: Oronzio de Nora Impianti Elettrochimici S.p.A., Erfinder: Alberto Pellegri, Placido M. Spaziante.
- ↑ Patent DE2927868: Verfahren zur Speicherung und Freisetzung von elektrischer Energie und dafür geeigneter Akkumulator. Veröffentlicht am 31. Januar 1980, Anmelder: Oronzio de Nora Impianti Elettrochimici S.p.A., Erfinder: Alberto Pellegri, Placido M. Spaziante.
- ↑ M. Rychcik, M. Skyllas-Kazacos: Evaluation of electrode materials for vanadium redox cell. In: Journal of Power Sources. Band 19, Nr. 1, Januar 1987, S. 45–54, doi:10.1016/0378-7753(87)80006-x (elsevier.com).
- ↑ M. Rychcik, M. Skyllas-Kazacos: Characteristics of a new all-vanadium redox flow battery. In: Journal of Power Sources. Band 22, Nr. 1, Januar 1988, S. 59–67, doi:10.1016/0378-7753(88)80005-3 (elsevier.com).
- ↑ M. Skyllas-Kazacos, M. Rychcik und R. Robins, im australischen Patent Nummer 575247 (1986), der Unisearch Ltd.
- ↑ Spelters, Oliver (2010): Betrachtung zur Dynamik von Redox-Flow-Zellen, München: Grin
- ↑ a b Ki Jae Kim, Min-Sik Park, Young-Jun Kim, Jung Ho Kim, Shi Xue Douband, M. Skyllas-Kazacos: A technology review of electrodes and reaction mechanisms in vanadium redox flow batteries, in Journal of Materials Chemistry A, Juni 2015, DOI: 10.1039/c5ta02613j, abgerufen am 20. Sep. 2020
- ↑ Redox-Flow-Batterien. Archiviert vom (nicht mehr online verfügbar) am 9. August 2014; abgerufen am 27. Juli 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b c Sangwon Kim: Vanadium Redox Flow Batteries: Electrochemical Engineering, in: IntechOpen, 3. April 2019, DOI: 10.5772/intechopen.85166, abgerufen am 20. Sep. 2020
- ↑ Qian Xu, Yannan Ji, Liyu Qin, P.K. Leung, Fen Qiao, Yashuai Li, Huaneng Su: Evaluation of redox flow batteries goes beyond round-trip efficiency: A technical review, in The Journal of Energy Storage 16(1), Januar 2018, Seiten 108–115, DOI: 10.1016/j.est.2018.01.005, abgerufen am 20. Sep. 2020
- ↑ Yitao Yan, Yifeng Li, Maria Skyllas-Kazacos, Jie Bao: Modelling and simulation of thermal behaviour of vanadium redox flow battery. In: Journal of Power Sources. Band 322. Elsevier B.V., 1. August 2016, S. 116–128, doi:10.1016/j.jpowsour.2016.05.011 (sciencedirect.com).
- ↑ Jens Tübke, Peter Fischer, Jens Noack: Redox-Flow-Batterien als stationäre Energiespeicher – Stand und Perspektiven. Abgerufen am 26. Mai 2017.
- ↑ A. H. Whitehead, T. J. Rabbow, M. Trampert, P. Pokorny: Critical safety features of the vanadium redox flow battery. In: Journal of Power Sources. Band 351. Elsevier B.V., 31. Mai 2017, S. 1–7, doi:10.1016/j.jpowsour.2017.03.075 (sciencedirect.com).
- ↑ Beispiel ( vom 23. April 2016 im Internet Archive) (PDF) für ein containerbasiertes System mit doppelwandigem Tank.
- ↑ M. Skyllas-Kazacos, M. H. Chakrabarti, S. A. Hajimolana, F. S. Mjalli, M. Saleem: Progress in Flow Battery Research and Development. In: Journal of The Electrochemical Society. Band 158, Nr. 8, 1. August 2011, ISSN 0013-4651, S. R55–R79, doi:10.1149/1.3599565 (ecsdl.org [abgerufen am 28. Mai 2017]).
- ↑ a b c DOE Global Energy Storage Database. In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 26. Mai 2016, abgerufen am 26. Mai 2017 (englisch, Diese Datenbank des DOE erfasst die meisten größeren Energiespeicher.).
- ↑ a b Energie im Tank. Abgerufen am 24. September 2019.
- ↑ a b Der Rotor steht noch still. Archiviert vom (nicht mehr online verfügbar) am 17. Februar 2020; abgerufen am 26. Mai 2017. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b Großprojekt »RedoxWind«. Fraunhofer-Institut für Chemische Technologie, abgerufen am 26. Mai 2017.
- ↑ China connects world’s largest redox flow battery system to grid – pv magazine International (pv-magazine.com)
- ↑ China connects world’s largest redox flow battery system to grid. 29. September 2022, abgerufen am 22. Januar 2024 (amerikanisches Englisch).
- ↑ Junko Movellan: Hokkaido Is the New Solar Capital of Japan. In: Featured News. RenewableEnergyWorld.com, 1. Mai 2014, abgerufen am 12. September 2021 (englisch).
- ↑ Minami Hayakita Substation Hokkaido Electric Power- Sumitomo. In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 20. September 2016, archiviert vom am 9. November 2017; abgerufen am 26. Mai 2017 (englisch).
- ↑ Kenji Kaneko: 60MWh Redox Flow Battery Starts Operations to Deal With Renewable Energy - News - Solar Power Plant Business. In: Solar Power Plant Business, News. Nikkei Business Publications, 5. Januar 2016, abgerufen am 26. Mai 2017 (englisch).
- ↑ Projekt für Windpark-Energiespeicherung Guodian Longyuan Woniushi. In: Markt und Anwendung, Integration erneuerbarer Energie. Rongke Power, abgerufen am 26. Mai 2017.
- ↑ Zonghao Liu, Huamin Zhang, Sujun Gao, Xiangkun Ma, Yufeng Liu: The world's largest all-vanadium redox flow battery energy storage system for a wind farm. Energy Storage Science and Technology, 2014, abgerufen am 26. Mai 2017 (englisch).
- ↑ GuoDian LongYuan Wind Farm VFB. In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 26. Mai 2016, abgerufen am 26. Mai 2017 (englisch).
- ↑ Tomamae Wind Farm. In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 6. August 2014, abgerufen am 26. Mai 2017 (englisch).
- ↑ Sumitomo Densetsu Office. In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 23. Juni 2013, abgerufen am 26. Mai 2017 (englisch).
- ↑ Clean Energy Ministerial - Energy Storage System: Challenges and Opportunities ( vom 3. August 2016 im Internet Archive), 12. Mai 2014 (PDF)
- ↑ Zhangbei National Wind and Solar Energy Storage and Transmission Demonstration Project (V). In: DOE Global Energy Storage Database. Sandia Corporation, U.S. Department of Energy, Strategen Consulting LLC, 26. Mai 2016, abgerufen am 26. Mai 2017 (englisch).
- ↑ A. Lee Barker: Sparton Resources Inc.: Special Shareholder Meeting Results November 3, 2016. In: News Room. Marketwired/Sparton Resources Inc., 7. November 2016, abgerufen am 26. Mai 2017 (englisch).
- ↑ Megan Geuss: Washington state’s new 8 megawatt-hour flow battery is the largest of its kind. In: Biz&IT. Ars Technica, WIRED Media Group, 6. April 2017, abgerufen am 26. Mai 2017 (englisch).
- ↑ Tom Kenning: SDG&E and Sumitomo unveil largest vanadium redox flow battery in the US. In: Energy Storage News. Solar Media Limited, 17. März 2017, abgerufen am 17. Juni 2017 (englisch).
- ↑ Sumitomo Electric Starts Demonstration of Storage Battery System for Power Grid in California. In: Company Information > Press Release. Sumitomo Electric Industries, Ltd., 17. März 2017, abgerufen am 17. Juni 2017 (englisch).
- ↑ History of Vanadium Redox Battery. In: Vanadium Redox Battery. University of New South Wales, archiviert vom am März 2017; abgerufen am 4. Juni 2017 (englisch).
- ↑ Vanadium Redox Flow Batteries. In: The Energy Blog. 21. Januar 2006, abgerufen am 4. Juni 2017 (englisch).
- ↑ 4.1 Vanadium Redox Battery, Sumitomo Electric Industries Ltd. In: Review of Electrical Energy Storage Technologies and Systems and of their Potential for the UK. DTI Technology Programme, Future Energy Solutions, EA Technolog, 21. Januar 2006, abgerufen am 4. Juni 2017 (englisch).
- ↑ Demonstrating Megawatt-Class Power Generation/Storage System at Yokohama Works. In: Press Release > 2012. Sumitomo Electric Industries, Ltd., 17. April 2012, abgerufen am 26. Mai 2017 (englisch).
- ↑ Eric Wesoff, Jeff St. John: Largest Capacity Flow Battery in North America and EU Is On-Line and Commissioned. In: Biz&IT. Greentech Media, 19. Juni 2015, abgerufen am 26. Mai 2017 (englisch).
- ↑ Vanadis Power liefert Batteriespeicher für Hybridsystem. 3. April 2017 (energieregion.de [abgerufen am 26. Mai 2017]).
- ↑ IWR: Bürgerwindpark setzt Europas größte Megawatt-Hybridbatterie ein. In: IWR. (iwr.de [abgerufen am 26. Mai 2017]).
- ↑ DOE Global Energy Storage Database. Abgerufen am 26. Mai 2017.
- ↑ The use of efficient storage systems on the Island of Pellworm. Archiviert vom am 15. Mai 2017; abgerufen am 26. Mai 2017 (englisch).
- ↑ a b c d Álvaro Cunha, Jorge Martins, Nuno Rodrigues, F. P. Brito: Vanadium redox flow batteries: a technology review. Review. In: International Journal of Energy Research. Band 39, Nr. 7. John Wiley & Sons, 10. Juni 2015, ISSN 1099-114X, S. 889–918, doi:10.1002/er.3260 (englisch).
- ↑ Battery Pioneers: Maria Skyllas-Kazacos. Batteries International, 22. September 2016, abgerufen am 29. Mai 2017.
- ↑ Hongzhang Zhang, Huamin Zhang, Fengxiang Zhang, Xianfeng Li, Yun Li: Advanced charged membranes with highly symmetric spongy structures for vanadium flow battery application. In: The Royal Society of Chemistry (Hrsg.): Energy & Environmental Science. Band 6, Nr. 3, 20. Februar 2013, ISSN 1754-5706, S. 776–781, doi:10.1039/c3ee24174b (rsc.org).
- ↑ Liyu Li, Soowhan Kim, Wei Wang, M. Vijayakumar, Zimin Nie, B. Chen, J. Zhang, G. Xia, J. Hu, G. Graff, J. Liu, Zhenguo Yang: A Stable Vanadium Redox-Flow Battery with High Energy Density for Large-Scale Energy Storage. In: Advanced Energy Materials. Band 1, Nr. 3. Wiley-VCH, 1. Mai 2011, ISSN 1614-6840, S. 394–400, doi:10.1002/aenm.201100008.