Lithium-Schwefel-Akkumulator
Der Lithium-Schwefel-Akkumulator ist ein Akkumulatortyp, an dem noch geforscht und entwickelt wird.
Dieser Akku kombiniert die zwei Elemente mit der jeweils höchsten bekannten Energiedichte. Eine schwefelreiche Kathode erreicht dabei 1675 mAh/g, und eine Lithium-Metall-Anode erreicht 3861 mAh/g.[1] Die theoretisch maximal mögliche Energiedichte dieses auf den Elementen Lithium und Schwefel basierenden Akkus liegt dann bei 2654 Wh/kg (2,8 kWh/l)[1][2], wobei bei der Berechnung dieser Werte nur die Massen von Schwefel und Lithium eingehen und von vollständigen Umsätzen ausgegangen wird. Diese theoretischen Werte gehören zwar zu den höchsten aller Akkumulatoren, praktisch wurde allerdings nur eine Energiedichte bis zu 350 Wh/kg erreicht, was knapp 15 % des rein theoretischen Wertes entspricht.[3][4][5] Höhere Energiedichten sind bisher nur auf Kosten der Lebensdauer der Akkus möglich. Typische Akkumulatoren mit einer Energiedichte von 350 Wh/kg können die entsprechende Energiemenge bisher über etwa einhundert Lade- und Entladezyklen speichern und wieder abgeben.[5] Die Spannung einer Zelle liegt bei etwa 2,2 Volt.[4]
Das erste Patent für eine Batterie, für die neben anderen Materialkombinationen auch das Paar Lithium und Schwefel vorgeschlagen wurde, wurde 1958 eingereicht und 1962 erteilt.[6]
Elektrochemie[Bearbeiten | Quelltext bearbeiten]
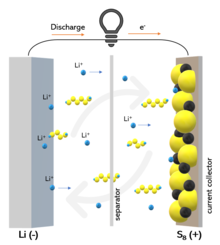
Während der Entladung wird an der Anode Lithium aufgelöst. An der Kathode verbindet es sich mit Schwefel, es entstehen Lithiumsulfide, bei vollständiger Entladung das Lithiumsulfid Li2S:
Während des Ladevorgangs wird die entstandene Verbindung wieder aufgelöst und Schwefel zurückgebildet. Am Minuspol wird dabei wieder Lithiummetall abgelagert oder eine Lithiumlegierung gebildet:
Als Zwischenprodukte entstehen beim Entladen und beim Laden Gemische verschiedener Lithiumsulfide. Beim Entladen nimmt dabei der Schwefelanteil am Gemisch immer weiter ab, weil der Lithiumgehalt immer weiter zunimmt. Dies kann schematisch mit der Reihe:
dargestellt werden, wobei die Sulfide Li2S8, Li2S6, Li2S5, Li2S4 und Li2S2 aber in sehr unterschiedlichen Konzentrationen im Gemisch nebeneinander vorliegen können. Die Abfolge der Reaktionen führt in der Auftragung der Spannung gegen die Entladezeit bei konstantem Strom zu zwei Plateaus bei knapp 2,4 und etwa 2,1 Volt; beim Laden liegt die Spannung oberhalb 2,2 Volt.[4][7] Da es keine einfache Beziehung zwischen der Spannung und dem Ladezustand gibt, ist dessen Ermittlung etwas aufwendiger.
Die Reaktion entspricht der von Natrium-Schwefel-Akkumulatoren, wobei Lithium die Funktion des Natriums übernimmt.[8]
Beim Lithium-Schwefel-Akkumulator findet der Ladungstransport innerhalb des Elektrolyten durch Lithiumionen statt. Es findet beim Lithium-Schwefel-Akkumulator eine chemische Reaktion statt, bei der Substanzen vollständig umgewandelt werden, wobei u. U. auch Kristalle von Schwefel oder Lithiumsulfid neu gebildet oder aufgelöst werden, während bei Lithium-Ionen-Batterien eine Interkalationsreaktion stattfindet.
Da Schwefel als Isolator nur eine äußerst schlechte elektrische Leitfähigkeit hat, muss er in einem leitfähigen Gemisch vorliegen, dass die Entladung in Gang kommen kann. Dazu wird der Schwefel mit Kohlenstoff versetzt. Ist die Kohlenstoffmenge zu gering, wird der Schwefel mangels elektrischem Kontakt nur unvollständig genutzt, und die spezifische Kapazität wird zu klein. Ist die Kohlenstoffmenge zu groß, so führt die damit verbundene Zusatzmasse an elektrochemisch inaktivem Material ebenfalls zu geringen spezifischen Kapazitäten. Ein wesentlicher Anteil der Forschungsaktivitäten versucht daher, durch die Verwendung spezieller Kohlenstoffsorten diese Eigenschaft zu optimieren: Es werden nicht nur Graphit und verschiedene Rußsorten getestet, sondern auch Graphen, Kohlenstoffnanoröhren, poröse Kohlenstoffe.
Aber auch durch unterschiedliche Elektrolyte und verschiedene Gemische an der Anode gibt es Varianten: Neben der Verwendung von metallischen Lithium wurde insbesondere Silicium und Zinn, wie im Zinn-Schwefel-Lithium-Akkumulator, als Anodenmaterialien vorgeschlagen, die die Zyklisierbarkeit verbessern sollen.
Für die Lithium-Schwefel-Zelle sind die neben Lithium wichtigsten Bestandteile Schwefel und Kohlenstoff, preiswert, weit verbreitet und leicht verfügbar. Schwefel und Kohlenstoff sind ungiftig, allerdings sind die bei der Entladung entstehenden Lithiumsulfide giftig, sie reagieren mit Säuren zu giftigem Schwefelwasserstoffgas. Deswegen müssen die Zellen gasdicht geschlossen werden.
Stand der Forschung[Bearbeiten | Quelltext bearbeiten]
Mehr als vier Jahrzehnte lang litten die in der Forschung hergestellten Zellen unter einer mangelhaften Wiederaufladbarkeit, da die Lade- und Entladezyklen zu einem schnellen Kapazitätsverlust führten. Erst seit etwa 2013 gibt es Berichte von Forschungsgruppen, die Lithium-Schwefel-Akkus über tausend Zyklen und mehr betrieben haben.
Eine im Dezember 2014 veröffentlichte Übersichtsarbeit listet z. B. Veröffentlichungen von elf Gruppen auf, die diese Zyklenzahl erreicht haben.[9] Dazu gehören auch Wissenschaftler des Dresdner Fraunhofer IWS, die 2013 eine neue Batteriekonstruktion mit einer Silicium-Kohlenstoff-Anode vorstellten, die die Anzahl der Ladezyklen bei Knopfzellen von 200 auf 1400 versiebenfachte.[10] Anfang 2014 hat die Forschergruppe 2000 Zyklen erreicht.[4] Ebenfalls 2013 berichteten Forscher des Lawrence Berkeley National Laboratory, ihre optimierte Schwefelelektrode habe nach 1500 Lade-Entlade-Zyklen eine höhere Kapazität gehabt als die Kathode in Lithium-Ionen-Zellen.[11] Sie verwendeten dabei einen speziellen Elektrolyten, der auf einer ionischen Flüssigkeit basiert.[11] Inzwischen wurden 3000[12] oder über 4000[13] Zyklen demonstriert.
2016 berichten Forscher der Cambridge University von weiteren Fortschritten bezüglich Elektrodenhaltbarkeit.[14] Damit ist zwar gezeigt, dass hohe Zyklenzahlen prinzipiell möglich sind, allerdings sind noch weitere Verbesserungen nötig, bis die Li-S-Zellen eine echte Alternative zu den herkömmlichen Lithiumionenbatterien sind, die ebenfalls stetig verbessert werden.[15]
Australische Forscher gaben im Januar 2020 an, den bislang leistungsfähigsten Lithium-Schwefel-Akku entwickelt zu haben, bei dem sie eine besonders robuste Schwefel-Elektrode einsetzen, in welcher der Schwefel in eine besondere Schicht aus einem Bindemittel und Kohlenstoff eingebettet ist, was Leistungs- und Kapazitätsverlust verringere.[16][17]
Nachdem die britische Firma OXIS Energy bereits im Oktober 2018 berichtete, eine Zelle mit 425 Wh/kg entwickelt zu haben,[18] wurde im August 2020 ein neuer Artikel veröffentlicht, in dem von einer Keramikschicht um die Kathode berichtet wird; außerdem wurden inzwischen 470 Wh/kg erreicht und es ist davon auszugehen, dass innerhalb eines Jahres 500 Wh/kg erreicht werden können.[19]
Im Oktober 2020 wurde publiziert, dass die Kapazität, Zyklenfestigkeit und das Selbstentladungsverhalten von Lithium-Schwefel-Akkus mit Hilfe von Cobaltoxalat deutlich verbessert werden kann.[20]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Kevin Bullis: Schweflige Hoffnung. In: Technology Review. Heise Zeitschriften Verlag, 22. Mai 2009, abgerufen am 19. August 2009.
- Electrochemical Characteristics of Lithium/Sulfur Battery (PDF-Datei; 10 kB)
- Fundamental Chemistry of Sion Power Li/S Battery. IBA-HBC 2006 (PDF-Datei; 1,86 MB)
- Was man über Lithium-Schwefel-Akkus wissen muss. In: www.elektroniknet.de. WEKA Fachmedien, 6. Februar 2014, abgerufen am 12. Februar 2014.
- Lithium-Schwefel-Hochenergie Akkumulatoren mit reversiblen Matrix-interkalierten Schwefelkathoden (PDF Englisch)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Xiao-Zhong Fan et al: An odyssey of lithium metal anode in liquid lithium–sulfur batteries. Chinese Chemical Letters, 2022, 33(10): 4421-4427, Oktober 2022 (englisch, 10.1016/j.cclet.2021.12.064).
- ↑ Khalil Amine, Ryoji Kanno, Yonhua Tzeng: Rechargeable lithium batteries and beyond: Progress, challenges, and future directions. In: Cambridge University Press (Hrsg.): MRS Bulletin. Band 39, Nr. 05, 2014, S. 395–401, doi:10.1557/mrs.2014.62 (englisch).
- ↑ Bill Moore: Sion Introduces a Lithium Sulfur Rechargeable Battery. EVWorld.com, Inc., archiviert vom (nicht mehr online verfügbar) am 18. Juni 2009; abgerufen am 8. Juni 2014 (englisch).
- ↑ a b c d Mathias Bloch: Was man über Lithium-Schwefel-Akkus wissen muss. WEKA FACHMEDIEN GmbH, 6. Februar 2014, abgerufen am 8. Juni 2014.
- ↑ a b Hong-Jie Peng, Jia-Qi Huang, Xin-Bing Cheng, Qiang Zhang: Review on High-Loading and High-Energy Lithium–Sulfur Batteries. In: Advanced Energy Materials. Wiley, 2017, ISSN 1614-6840, 1700260, doi:10.1002/aenm.201700260 (wiley.com).
- ↑ Patent US3043896: Electric Dry Cells and Storage Batteries. Angemeldet am 24. November 1958, veröffentlicht am 10. Juli 1962, Anmelder: Electric Techniques Corporation N.V., Willemstad, Curaçao, Erfinder: Danuta Herbert, Juliusz Ulam (Anmeldung in Frankreich: 26. Nov. 1957).
- ↑ Yan Diao, Kai Xie, Shizhao Xiong, Xiaobin Hong: Insights into Li-S Battery Cathode Capacity Fading Mechanisms: Irreversible Oxidation of Active Mass during Cycling. In: Journal of The Electrochemical Society. Band 159, Nr. 11, 2012, ISSN 0013-4651, S. A1816–A1821, doi:10.1149/2.020211jes (iop.org [abgerufen am 13. September 2020]).
- ↑ Tudron, F.B., Akridge, J.R., and Puglisi, V.J. (2004): Lithium-Sulfur Rechargeable Batteries: Characteristics, State of Development, and Applicability to Powering Portable Electronics ( vom 14. Juli 2011 im Internet Archive) (PDF; 330 kB) (Tucson, AZ: Sion Power).
- ↑ Xin Fang, Huisheng Peng: A Revolution in Electrodes: Recent Progress in Rechargeable Lithium–Sulfur Batteries. The game of Li-S Batteries. In: small. Band 11, Nr. 13. WILEY-VCH, 1. April 2015, ISSN 1613-6829, S. 1488–1511, doi:10.1002/smll.201402354 (edu.cn [PDF; abgerufen am 8. Mai 2016]). A Revolution in Electrodes: Recent Progress in Rechargeable Lithium–Sulfur Batteries ( vom 8. Mai 2016 im Internet Archive)
- ↑ Längeres Leben für Lithium-Schwefel-Batterien, Presseinformation Nr. V des Fraunhofer IWS Dresden vom 1. April 2013, abgerufen am 11. April 2013.
- ↑ a b Min-Kyu Song, Yuegang Zhang, Elton J. Cairns: A Long-Life, High-Rate Lithium/Sulfur Cell: A Multifaceted Approach to Enhancing Cell Performance. In: Nano Letters. 2013, doi:10.1021/nl402793z.
- ↑ Feng Wu, Yusheng Ye, Renjie Chen, Ji Qian, Teng Zhao, Li Li, Wenhui Li: Systematic Effect for an Ultralong Cycle Lithium–Sulfur Battery. In: Nano Letters. Band 15, Nr. 11. American Chemical Society ACS, 26. Oktober 2015, ISSN 1530-6992, S. 7431–7439, doi:10.1021/acs.nanolett.5b02864.
- ↑ Yunhua Xu, Yang Wen, Yujie Zhu, Karen Gaskell, Katie A. Cychosz, Bryan Eichhorn, Kang Xu, Chunsheng Wang: Confined Sulfur in Microporous Carbon Renders Superior Cycling Stability in Li/S Batteries. In: Advanced Functional Materials. Band 25, Nr. 27. Wiley-VCH, 1. Juni 2015, S. 4312–4320, doi:10.1002/adfm.201500983.
- ↑ Next-generation smartphone battery inspired by the gut. cam.ac.uk, 26. Oktober 2016, abgerufen am 8. Mai 2023.
- ↑ Ariel Rosenman, Elena Markevich, Gregory Salitra, Doron Aurbach, Arnd Garsuch, Frederick Francois Chesneau: Review on Li-Sulfur Battery Systems: an Integral Perspective. In: Advanced Energy Materials. Special Issue: Understanding the Lithium–Sulfur Battery System at Relevant Scales. Band 5, Nr. 16. Wiley-VCH, 19. August 2015, ISSN 1614-6840, doi:10.1002/aenm.201500212.
- ↑ Neue Super-Batterie verwertet Abfallprodukt. In: n-tv.de. 8. Januar 2020, abgerufen am 11. Januar 2020.
- ↑ Mahdokht Shaibani et al.: Expansion-tolerant architectures for stable cycling of ultrahigh-loading sulfur cathodes in lithium-sulfur batteries. In: Science Advances. Band 6, Nr. 1, 2020, doi:10.1126/sciadv.aay2757.
- ↑ OXIS ENERGY Progresses its Lithium Sulfur (Li-S) cell technology to 450WH/kg. - Oxis Energy. In: oxisenergy.com. 3. Oktober 2018, abgerufen am 4. Oktober 2018.
- ↑ With Ultralight Lithium-Sulfur Batteries, Electric Airplanes Could Finally Take Off. In: spectrum.ieee.org. 19. August 2020, abgerufen am 19. August 2020.
- ↑ Jin Won Kim, Gyuwon Seo, Sungyool Bong, Jaeyoung Lee: Improved Redox Reaction of Lithium Polysulfides on the Interfacial Boundary of Polar CoC 2 O 4 as a Polysulfide Catenator for a High‐Capacity Lithium‐Sulfur Battery. In: ChemSusChem. Band 14, Nr. 3, 5. Februar 2021, ISSN 1864-5631, S. 876–883, doi:10.1002/cssc.202002140 (wiley.com [abgerufen am 26. Februar 2021]).