Diphenylpyrrolidinmethanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
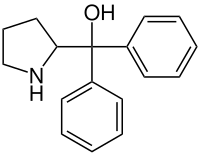
| |||||||||||||||||||
| Ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diphenylpyrrolidinmethanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C17H19NO | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 253,34 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Diphenylpyrrolidinmethanol (auch Diphenylprolinol) ist ein von Prolin abgeleitetes Aminosäurederivat und wird als chirales Reagenz in der organischen Synthese eingesetzt aber auch als Rauschmittel konsumiert.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Das (S)-Enantiomer kann aus natürlichem Prolin hergestellt werden, indem dieses mit Phosgen und Triethylamin zunächst zu einem cyclischen Anhydrid umgesetzt wird. Dieses wird anschließend mit Phenyllithium umgesetzt und sauer aufgearbeitet um das Produkt zu erhalten. Das andere Enantiomer kann analog aus (R)-Prolin hergestellt werden.[2] Eine alternative Herstellungsmethode für die racemische Verbindung geht von Pyrrolidin aus, das zunächst zu Pyrrolin-N-oxid[3] oxidiert wird. Dieses kann durch Umsetzung mit Benzophenon und Samarium(II)-iodid in Diphenylprolinol überführt werden.[4]
Pharmakologie und Toxikologie[Bearbeiten | Quelltext bearbeiten]
Diphenylpyrrolidinmethanol wirkt ähnlich wie Kokain als Dopamin-Wiederaufnahmehemmer. Mögliche Vergiftungssymptome sind Bluthochdruck, Tachykardie und Brustschmerz. Es kann zu Unruhe, Angstzuständen und Schlaflosigkeit führen, die mehrere Tage andauern können.[5]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Diphenylprolinol wird seit 1987 als asymmetrischer Katalysator eingesetzt und ist ein wichtiges Reagenz in der metallfreien Katalyse in der organischen Synthese.[6] Inzwischen sind verschiedene Derivate bekannt, die bessere Ergebnisse bei Ausbeute und Stereoselektivität in verschiedenen Reaktionen bieten, beispielsweise der Methyl- und der Trimethylsilylether und ein Derivat, das statt Phenylgruppen 3,5-Dimethylphenylgruppen trägt.[7][8]
Diphenylprolinol eignet sich beispielsweise als Katalysator für die enantioselektive Epoxidierung mit tert-Butylhydroperoxid[6][9] und für die enantioselektive Synthese chiraler Allene.[10] Eine konkrete Anwendung, die beschrieben wurde, ist die Totalsynthese von Traumatinlacton.[11] Diphenylprolinol ist auch Edukt für die Herstellung von CBS-Katalysatoren, die bei der enantioselektiven Reduktion von Ketonen (Corey-Bakshi-Shibata-Reduktion) verwendet werden.[12][13]
Diphenylpyrrolidinmethanol wird als Rauschmittel konsumiert.[5][14]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ David J. Mathre, Todd K. Jones, Lyndon C. Xavier, Thomas J. Blacklock, Robert A. Reamer, Julie J. Mohan, E. Tracy Turner Jones, Karst Hoogsteen, Mary W. Baum, E. J. J. Grabowski: A practical enantioselective synthesis of .alpha.,.alpha.-diaryl-2-pyrrolidinemethanol. Preparation and chemistry of the corresponding oxazaborolidines. In: The Journal of Organic Chemistry. Band 56, Nr. 2, Januar 1991, S. 751–762, doi:10.1021/jo00002a049.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Pyrrolin-N-oxid: CAS-Nummer: 24423-88-9, PubChem: 300148, ChemSpider: 265192, Wikidata: Q82053089.
- ↑ Olga N. Burchak, Christian Philouze, Pierre Yves Chavant, Sandrine Py: A Direct and Versatile Access to α,α-Disubstituted 2-Pyrrolidinylmethanols by SmI 2 -Mediated Reductive Coupling. In: Organic Letters. Band 10, Nr. 14, 17. Juli 2008, S. 3021–3023, doi:10.1021/ol800982n.
- ↑ a b David M. Wood, Paul I. Dargan: Use and acute toxicity associated with the novel psychoactive substances diphenylprolinol (D2PM) and desoxypipradrol (2-DPMP). In: Clinical Toxicology. Band 50, Nr. 8, September 2012, S. 727–732, doi:10.3109/15563650.2012.716158.
- ↑ a b Eugenia Marques-Lopez, Raquel P. Herrera: Diarylprolinol Derivatives in Organocatalysis From Another Point of View: Structural Aspects. In: Current Organic Chemistry. Band 15, Nr. 13, S. 2311–2327, doi:10.2174/138527211796150705 (eurekaselect.com [abgerufen am 3. Oktober 2023]).
- ↑ Claudio Palomo, Antonia Mielgo: Diarylprolinol Ethers: Expanding the Potential of Enamine/Iminium-Ion Catalysis. In: Angewandte Chemie International Edition. Band 45, Nr. 47, 4. Dezember 2006, S. 7876–7880, doi:10.1002/anie.200602943.
- ↑ Alessandra Lattanzi: Bis(3,5-dimethylphenyl)-(S)-pyrrolidin-2-ylmethanol: an Improved Organocatalyst for the Asymmetric Epoxidation of α,β-Enones. In: Advanced Synthesis & Catalysis. Band 348, Nr. 3, Februar 2006, S. 339–346, doi:10.1002/adsc.200505370.
- ↑ Alessandra Lattanzi, Alessio Russo: Diaryl-2-pyrrolidinemethanols catalyzed enantioselective epoxidation of α,β-enones: new insight into the effect of structural modification of the catalyst on reaction efficiency. In: Tetrahedron. Band 62, Nr. 52, Dezember 2006, S. 12264–12269, doi:10.1016/j.tet.2006.10.005.
- ↑ Xinjun Tang, Xin Huang, Tao Cao, Yulin Han, Xingguo Jiang, Weilong Lin, Yang Tang, Jiasheng Zhang, Qiong Yu, Chunling Fu, Shengming Ma: CuBr 2 -catalyzed enantioselective routes to highly functionalized and naturally occurring allenes. In: Organic Chemistry Frontiers. Band 2, Nr. 6, 2015, S. 688–691, doi:10.1039/C5QO00084J.
- ↑ Jing Zhou, Shihua Song, Feng Jiang, Chunling Fu, Shengming Ma: Efficient Syntheses of Traumatic Lactone and Rhizobialide. In: Chemistry – A European Journal. Band 25, Nr. 42, 25. Juli 2019, S. 9948–9958, doi:10.1002/chem.201901210.
- ↑ E. J. Corey, Raman K. Bakshi, Saizo Shibata, Chung Pin Chen, Vinod K. Singh: A stable and easily prepared catalyst for the enantioselective reduction of ketones. Applications to multistep syntheses. In: Journal of the American Chemical Society. Band 109, Nr. 25, Dezember 1987, S. 7925–7926, doi:10.1021/ja00259a075.
- ↑ Shaik Anwar, Mariappan Periasamy: A convenient method for the preparation of oxazaborolidine catalyst in situ using (S)-α,α-diphenylpyrrolidinemethanol, tetrabutylammonium borohydride, and methyl iodide for the asymmetric reduction of prochiral ketones. In: Tetrahedron: Asymmetry. Band 17, Nr. 23, Dezember 2006, S. 3244–3247, doi:10.1016/j.tetasy.2006.11.032.
- ↑ Mathieu P. Elie, Leonie E. Elie, Mark G. Baron: Keeping pace with NPS releases: fast GC-MS screening of legal high products: Fast-GCMS analysis of NPS. In: Drug Testing and Analysis. Band 5, Nr. 5, Mai 2013, S. 281–290, doi:10.1002/dta.1434.