Disopyramid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
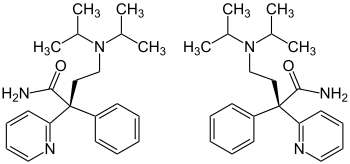
| ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Enantiomer (links) und (S)-Enantiomer (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Disopyramid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C21H29N3O | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Natriumkanalblocker | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 339,47 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
8,34[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
| Absorption | 80–90 % |
| Halbwertszeit | 8–9 Stunden |
| Bioverfügbarkeit | > 80 % |
| Plasmaeiweißbindung | ~ 30–40 % |
| Plazentagängig | ja |
| übliche Dosierung | 4 × 100 bis 200 mg / Tag |
| Dosisbereich | 400 bis 1200 mg / Tag |
| Elimination | renal |
Disopyramid ist ein Arzneistoff aus der Gruppe der Antiarrhythmika IA nach Vaughan-Williams zur Behandlung ventrikulärer Herzrhythmusstörungen und weist ähnliche pharmakologische Eigenschaften auf wie Chinidin und Procainamid.[4][5] Es wird klinisch nur in oraler Form angewandt und ist auch in retardierter Darreichungsform erhältlich. Verwendet wird das Phosphat (Salz mit Phosphorsäure im Molverhältnis 1:1).[1] Disopyramid wird überwiegend über die Nieren ausgeschieden. Disopyramid wurde 1962 als Antiarrhythmikum von Searle patentiert.[1]
Stereochemie[Bearbeiten | Quelltext bearbeiten]
Disopyramid wird in der Praxis als Racemat [1:1-Gemisch der enantiomeren (S)- bzw. (R)-Formen] eingesetzt, obwohl der Bedeutung der Enantiomerenreinheit der synthetisch hergestellten Wirkstoffe zunehmend Beachtung eingeräumt wird, denn die beiden Enantiomeren eines chiralen Arzneistoffes zeigen fast immer eine unterschiedliche Pharmakologie und Pharmakokinetik. Das wurde früher aus Unkenntnis über stereochemische Zusammenhänge oft ignoriert.[6] Die Plasmakonzentrationen von der Enantiomeren (S)- bzw. (R)-Formen von Disopyramid unterscheiden sich signifikant nach Gabe des 1:1-Gemisches.[7]
Elektrophysiologische Wirkungen[Bearbeiten | Quelltext bearbeiten]
Disopyramid hemmt vornehmlich die Natriumkanäle an der Zellmembran rhythmusgenerierender Zellen im Herzmuskel und verlängert so das Aktionspotential. Es hat starke anti-parasympathische, also Atropin-artige anticholinerge-vagolytische Effekte, und wirkt nicht auf die Alpha- oder Beta-Adrenozeptoren des sympathischen Nervensystems. Die Refraktärzeiten von Vorhöfen und Herzkammern werden durch das Medikament verkürzt.
Hämodynamische Wirkungen[Bearbeiten | Quelltext bearbeiten]
Disopyramid vermindert spürbar die Kontraktionskraft der linken Herzkammer und vermindert das Herzzeitvolumen.[8] Es wirkt auf die arteriellen Blutgefäße erweiternd. Hierdurch kann der Blutdruck absinken. Von Patienten mit verminderter Pumpfunktion des Herzens wird es schlecht vertragen und sollte abgesetzt werden.
Indikationen[Bearbeiten | Quelltext bearbeiten]
Bei einem Teil der Patienten vermag Disopyramid ventrikuläre Extrasystolen (VES) und ventrikuläre Tachykardien (VT) zu verhindern. Eine Kombination mit anderen Antiarrhythmika wie Mexiletin kann wirksam sein, wenn ein Medikament alleine nicht ausreicht.
Disopyramid kann das Wiederauftreten von Vorhofflimmern nach Kardioversion verhindern und Vorhofflattern beenden. Es ist wichtig, vor seinem Einsatz die Kammerfrequenz zu kontrollieren, um eine 1:1-Überleitung zu verhindern.
Das Medikament wurde eingesetzt, um neurogene Synkopen zu verhindern, und aufgrund seiner negativ inotropen Eigenschaften auch bei der hypertrophen Kardiomyopathie mit dynamischer Obstruktion.
Unerwünschte Wirkungen[Bearbeiten | Quelltext bearbeiten]
Drei Gruppen von Nebenwirkungen fallen auf:
- parasympatholytisch
- Harnverhalt
- Obstipation
- Akkommodationsstörungen
- Engwinkelglaukom
- Mundtrockenheit
- Verminderung der Auswurfleistung der linken Herzkammer, besonders bei vorbestehender Herzinsuffizienz.
- QT-Zeit-Verlängerung und Kammertachykardien vom Torsade-de-pointes-Typ
Gegenanzeigen und Wechselwirkungen[Bearbeiten | Quelltext bearbeiten]
Nicht eingesetzt werden sollte die Substanz bei dekompensierter Herzinsuffizienz, Bradykardie und Intoxikation mit Herzglykosiden. Wie bei den Klasse-IC-Antiarrhythmika könnte nach der CAST-Studie[9] bei dem gleichzeitigen Vorliegen einer koronaren Herzkrankheit eine Übersterblichkeit bestehen, so dass bei entsprechendem Verdacht vor dem Einsatz von Disopyramid eine Herzkatheteruntersuchung erforderlich sein könnte. Erythromycin verlängert die Halbwertszeit und erhöht somit die Wirkung der Substanz, ebenso trizyklische Antidepressiva und Neuroleptika.
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Als Monopräparat wurde Disopyramid unter den Namen Rytmodul, Diso-Duriles und Rythmodan angeboten. Es wird auf dem deutschen Markt derzeit nicht vertrieben.[10]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Eintrag zu Disopyramid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Juni 2019.
- ↑ a b Datenblatt Disopyramide bei Sigma-Aldrich, abgerufen am 28. März 2011 (PDF).
- ↑ I. Hirotsu, T. Kihara, S. Nakamura, Y. Hattori, M. Hatta, Y. Kitakaze, K. Takahama, Y. Hashimoto, T. Miyata, T. Ishihara: General pharmacological studies on N-(2,6-dimethylphenyl)-8-pyrrolizidineacetamide hydrochloride hemihydrate. 1st communication: effect on the central nervous system. In: Arzneimittel-Forschung. 38. Jahrgang, Nr. 10, 1988, S. 1398–1409, PMID 3196380.
- ↑ J. M. Miller, D. P. Zipes: Therapy for Cardiac Arrhythmias. In: D. P. Zipes, P. Libby, R. O. Bonow, E. Braunwald (Hrsg.): Braunwald’s Heart Disease, A Textbook of Cardiovascular Medicine. Elsevier Saunders, Philadelphia 2005, ISBN 0-8089-2305-6, S. 722.
- ↑ E. Mutschler, M. Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 7. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1996, ISBN 3-8047-1377-7, S. 461–462.
- ↑ E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26, 1984, S. 663–668, doi:10.1007/BF00541922.
- ↑ J. J. Lima, G. L. Jungbluth, T. Devine, L. W. Robertson: Stereoselective binding of dispyramide to human plasma protein. In: Life Science. 35, 1984, S. 835.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 73.
- ↑ D. S. Echt u. a. for the CAST-Investigators: Mortality and morbidity in patients receiving encainide, flecainide, or placebo. In: N Engl J Med. 324, 1991, S. 781–788.
- ↑ Gelbe Liste