Merkelzellkarzinom
| Klassifikation nach ICD-10 | |
|---|---|
| C44 | Sonstige bösartige Neubildungen der Haut |
| ICD-10 online (WHO-Version 2019) | |

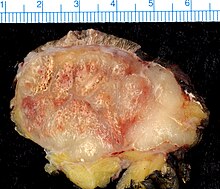
Das Merkelzellkarzinom oder kutane neuroendokrine Karzinom der Haut ist ein sehr seltener bösartiger Hauttumor. Die Namensgebung beruht auf ultrastrukturellen Ähnlichkeiten mit den Merkel-Zellen der Epidermis, wobei heute nicht mehr davon ausgegangen wird, dass die Merkel-Zellen die Ausgangszellen der neoplastischen Transformation darstellen.[1][2]
Die Inzidenz beträgt 0,1 bis 0,3 Neuerkrankungen pro 100.000 Einwohner und Jahr. Die typischerweise im hohen Lebensalter auftretenden und rötlich-kugelig aussehenden Tumoren wachsen bevorzugt – aber nicht nur – an chronisch lichtexponierten Hautstellen des Gesichtes und der Extremitäten. Ulzerationen des Tumors sind selten. Es wird ein Zusammenhang von Tumorentstehung und UV-Exposition vermutet.[3] In Regionen mit größerem Abstand vom Äquator sind die Mehrzahl der Erkrankungen mit dem 2008 entdeckten Merkelzell-Polyomavirus assoziiert.[4]
Diagnose
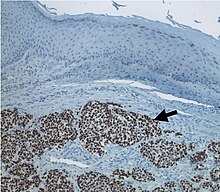
[Bearbeiten | Quelltext bearbeiten]Die Diagnose wird durch Probeentnahme und feingewebliche Untersuchung gestellt. Zusätzlich ist immer eine immunhistochemische Untersuchung erforderlich, um die Abgrenzung von anderen ähnlich aussehenden Geschwülsten zu ermöglichen. Da Merkelzellkarzinome häufig über die Lymphwege metastasieren, wird außer der Schnittbildgebung (CT, MR) eine Sentinellymphknotenbiopsie empfohlen.[5]
Entsprechend der AJCC-Klassifizierung von 2017 wird die Erkrankung in Abhängigkeit von ihren klinischen Charakteristika in verschiedene Stadien unterteilt:[6]
- Stadium I (Patienten mit Primärtumorgröße ≤2 cm)
- Stadium II (Patienten mit Primärtumorgröße >2 cm)
- Stadium III (Patienten mit positivem Lymphknotenbefall)
- Stadium IV (Patienten mit Fernmetastasen)
In den Stadien I und II wird unterschieden, ob der lokoregionäre Lymphknoten nur klinisch oder mittels Sentinellymphknotenbiopsie als frei von Metastasen befundet wurde. Im ersten Fall ist die Prognose schlechter, da in fast einem Drittel der Fälle Mikrometastasen unerkannt bleiben.
Die Mehrzahl der Erkrankungen (35–52 %) wird im Stadium I diagnostiziert, gefolgt von Stadium III (23–35 %), Stadium II (15–26 %) und schließlich Stadium IV (5–12 %).[7][8][9][10][11][12] Ein Lokalrezidiv oder das Auftreten von Metastasen wird in der Regel innerhalb der ersten drei Jahre nach Diagnosestellung beobachtet und geht mit einer schlechten Prognose einher.[13] Am häufigsten von der Metastasierung betroffen sind die ableitenden und andere Lymphknoten, Haut, Lunge, und Leber; Knochen und das zentrale Nervensystem sind nur selten Ort einer Metastasierung.[14][15]
Die Rezidivrate beim Merkelzellkarzinom ist hoch, jedoch fehlen aufgrund der Seltenheit des Tumors und die Besonderheiten der betroffenen Patienten exakte Zahlen. Obwohl z. B. berichtet wurde, dass fast die Hälfte der Patienten mit positivem Sentinellymphknoten innerhalb von drei Jahren ein Rezidiv erleidet, muss hier doch von einem gewissen Bias ausgegangen werden.[16] Retrospektive Studien werden oft von größeren Zentren verfasst, an die insbesondere Patienten mit schlechterem Verlauf, z. B. eine eingetretene Metastasierung, verwiesen werden; Patienten mit günstigem Verlauf werden dort weniger häufig gesehen.
Therapie
[Bearbeiten | Quelltext bearbeiten]Die Tumoren werden mit Sicherheitsabstand chirurgisch entfernt, und es wird eine Biopsie des Wächterlymphknotens (Sentinellymphknotenbiopsie) empfohlen. Zusätzlich zur Operation sollte eine Bestrahlung des Tumorbettes und der lokoregionären Lymphabflussstation erfolgen.
Systemtherapien werden in der Regel nur bei Patienten mit metastasiertem Merkelzellkarzinom (Stadium IV) eingesetzt. Als Therapie der ersten Wahl gilt gemäß deutschen und internationalen Leitlinien eine Immunmodulation mit Immuncheckpoint-blockierenden Antikörpern, die sich gegen PD-L1 oder PD-1 richten.[17] Im September 2017 wurde der anti-PD-L1 Antikörper Avelumab zur Behandlung des Merkelzellkarzinoms in der EU zugelassen.[18]
In Fällen des fehlenden Ansprechens auf eine Immuntherapie besteht weiterhin die Indikation zu einer Chemotherapie, insbesondere bei Symptomen durch die Tumormetastasen. Grundsätzlich gilt das metastasierte Merkelzellkarzinom als chemo-sensitiver Tumor mit hoher Ansprechrate, allerdings ist das Therapieansprechen oft nur von kurzer Dauer.[19] Auch in der zweiten Chemotherapielinie können Patienten noch profitieren, aber die Ansprechraten sind geringer.[20] Neben Monotherapien mit Anthrazyklinen oder Taxanen werden auch Kombinationstherapien mit Platinderivaten und Etoposid eingesetzt. Vergleichende Studien bezüglich Wirksamkeit der verschiedenen Chemotherapieregime fehlen.[21][22]
Daher gibt es einen hohen Bedarf an klinischen Studien, die neue Substanzen untersuchen, die zu andauerndem Therapieansprechen beim metastasierten Merkelzellkarzinom führen.
Die Prognose hängt sehr vom Stadium der Erkrankung ab und ist bei Tumoren in der Hals-Kopf-Region oder am Rumpf schlechter. Auch Männer und Patienten mit Immunsuppression haben schlechtere Perspektiven.[23]
Risikofaktoren
[Bearbeiten | Quelltext bearbeiten]Das Merkelzellkarzinom ist häufiger bei Patienten mit einer Immunsuppression, z. B. durch hämatologischen Erkrankungen, Organtransplantationen oder AIDS, und zeigt bei diesen Patienten einen aggressiveren Verlauf.
Weitere Risikofaktoren sind Alter, helle Haut, vorhergehende bösartige Tumorerkrankungen und chronische UV-Exposition.[24]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Quellen und Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ADO-Leitlinie: Merkelzellkarzinom (MZK, MCC, neuroendokrines Karzinom der Haut) – Update 2018, AWMF-Registernr.: 032-023, Qualitätsstufe S2k
- ↑ C. M. Sauer, A. M. Haugg, E. Chteinberg, D. Rennspiess, V. Winnepenninckx: Reviewing the current evidence supporting early B-cells as the cellular origin of Merkel cell carcinoma. In: Critical Reviews in Oncology/Hematology. Band 116, August 2017, ISSN 1879-0461, S. 99–105, doi:10.1016/j.critrevonc.2017.05.009.
- ↑ J. C. Becker: Merkel cell carcinoma. In: Annals of Oncology. Band 21, suppl_7, 1. Oktober 2010, ISSN 0923-7534, S. vii81–vii85, doi:10.1093/annonc/mdq366 (oup.com [abgerufen am 19. September 2017]).
- ↑ on behalf of the International Workshop on Merkel Cell Carcinoma Research (IWMCC) Working Group, Paul W. Harms, Kelly L. Harms, Patrick S. Moore, James A. DeCaprio: The biology and treatment of Merkel cell carcinoma: current understanding and research priorities. In: Nature Reviews Clinical Oncology. Band 15, Nr. 12, Dezember 2018, ISSN 1759-4774, S. 763–776, doi:10.1038/s41571-018-0103-2, PMID 30287935, PMC 6319370 (freier Volltext).
- ↑ Andreas Stang, Jürgen C. Becker, Paul Nghiem, Jacques Ferlay: The association between geographic location and incidence of Merkel cell carcinoma in comparison to melanoma: An international assessment. In: European Journal of Cancer. Volume 94, 1. Mai 2018, S. 47–60, doi:10.1016/j.ejca.2018.02.003.
- ↑ Celeste Lebbe, Jürgen C. Becker, Jean-Jacques Grob, Josep Malvehy, Veronique del Marmol: Diagnosis and treatment of Merkel Cell Carcinoma. European consensus-based interdisciplinary guideline. In: European Journal of Cancer. Band 51, Nr. 16, S. 2396–2403, doi:10.1016/j.ejca.2015.06.131 (elsevier.com [abgerufen am 19. September 2017]).
- ↑ Stephen B. Edge, Carolyn C. Compton: The American Joint Committee on Cancer: the 7th Edition of the AJCC Cancer Staging Manual and the Future of TNM. In: Annals of Surgical Oncology. Band 17, Nr. 6, 1. Juni 2010, ISSN 1068-9265, S. 1471–1474, doi:10.1245/s10434-010-0985-4.
- ↑ Peter J. Allen, Wilbur B. Bowne, David P. Jaques, Murray F. Brennan, Klaus Busam: Merkel Cell Carcinoma: Prognosis and Treatment of Patients From a Single Institution. In: Journal of Clinical Oncology. Band 23, Nr. 10, 1. April 2005, ISSN 0732-183X, S. 2300–2309, doi:10.1200/jco.2005.02.329.
- ↑ Jayme B. Stokes, Katherine S. Graw, Lynn T. Dengel, Brian R. Swenson, Todd W. Bauer: Patients With Merkel Cell Carcinoma Tumors ≤ 1.0 cm in Diameter Are Unlikely to Harbor Regional Lymph Node Metastasis. In: Journal of Clinical Oncology. Band 27, Nr. 23, 10. August 2009, ISSN 0732-183X, S. 3772–3777, doi:10.1200/jco.2008.20.8272.
- ↑ Aleodor A. Andea, Daniel G. Coit, Bijal Amin, Klaus J. Busam: Merkel cell carcinoma. In: Cancer. Band 113, Nr. 9, 1. November 2008, ISSN 1097-0142, S. 2549–2558, doi:10.1002/cncr.23874.
- ↑ Aleodor A. Andea, Raj Patel, Selvarangan Ponnazhagan, Sanjay Kumar, Patricia DeVilliers: Merkel cell carcinoma: correlation of KIT expression with survival and evaluation of KIT gene mutational status. In: Human Pathology. Band 41, Nr. 10, S. 1405–1412, doi:10.1016/j.humpath.2010.02.010 (elsevier.com [abgerufen am 19. September 2017]).
- ↑ Juan A. Santamaria-Barria, Genevieve M. Boland, Beow Y. Yeap, Valentina Nardi, Dora Dias-Santagata: Merkel Cell Carcinoma: 30-Year Experience from a Single Institution. In: Annals of Surgical Oncology. Band 20, Nr. 4, 1. April 2013, ISSN 1068-9265, S. 1365–1373, doi:10.1245/s10434-012-2779-3.
- ↑ Timothy L. Fitzgerald, Samuel Dennis, Swapnil D. Kachare, Nasreen A. Vohra, Jan H. Wong: Dramatic Increase in the Incidence and Mortality from Merkel Cell Carcinoma in the United States. In: The American Surgeon. Band 81, Nr. 8, August 2015, ISSN 1555-9823, S. 802–806, PMID 26215243.
- ↑ Dirk Schadendorf, Céleste Lebbé, Axel zur Hausen, Marie-Françoise Avril, Subramanian Hariharan: Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs. In: European Journal of Cancer. Band 71, S. 53–69, doi:10.1016/j.ejca.2016.10.022 (elsevier.com [abgerufen am 19. September 2017]).
- ↑ H. Medina-Franco, M. M. Urist, J. Fiveash, M. J. Heslin, K. I. Bland: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. In: Annals of Surgical Oncology. Band 8, Nr. 3, April 2001, ISSN 1068-9265, S. 204–208, PMID 11314935.
- ↑ E. Voog, P. Biron, J. P. Martin, J. Y. Blay: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. In: Cancer. Band 85, Nr. 12, 15. Juni 1999, ISSN 0008-543X, S. 2589–2595, PMID 10375107.
- ↑ Sheela G. Gupta, Linda C. Wang, Pablo F. Peñas, Martina Gellenthin, Stephanie J. Lee: Sentinel Lymph Node Biopsy for Evaluation and Treatment of Patients With Merkel Cell Carcinoma: The Dana-Farber Experience and Meta-analysis of the Literature. In: Archives of Dermatology. Band 142, Nr. 6, 1. Juni 2006, ISSN 0003-987X, S. 685–690, doi:10.1001/archderm.142.6.685 (jamanetwork.com [abgerufen am 19. September 2017]).
- ↑ Patrick Terheyden, Jürgen C. Becker: New developments in the biology and the treatment of metastatic Merkel cell carcinoma. In: Current Opinion in Oncology. Band 29, Nr. 3, 1. Mai 2017, ISSN 1040-8746, S. 221–226, doi:10.1097/cco.0000000000000363 (ovid.com [abgerufen am 19. September 2017]).
- ↑ EU-Zulassung für Bavencio. In: apotheke-adhoc.de. 21. September 2017, abgerufen am 27. September 2017.
- ↑ Jann Arends: Tumoren der Haut: Grundlagen, Diagnostik und Therapie in der dermatologischen Onkologie; 167 Tabellen. Georg Thieme Verlag, 2010, ISBN 978-3-13-142171-5, S. 610 (google.com).
- ↑ Jürgen C. Becker, Eva Lorenz, Selma Ugurel, Thomas K. Eigentler, Felix Kiecker: Evaluation of real-world treatment outcomes in patients with distant metastatic Merkel cell carcinoma following second-line chemotherapy in Europe. In: Oncotarget. Band 8, Nr. 45, 3. Oktober 2017, ISSN 1949-2553, S. 79731–79741, doi:10.18632/oncotarget.19218, PMID 29108353, PMC 5668086 (freier Volltext).
- ↑ Systematic literature review of efficacy, safety and tolerability outcomes of chemotherapy regimens in patients with metastatic Merkel cell carcinoma. In: Future Oncology. Band 13, Nr. 14, 28. März 2017, ISSN 1479-6694, S. 1263–1279, doi:10.2217/fon-2017-0072.
- ↑ NCCN: Merkel Cell Carcinoma guidelines Version 1. (PDF) Abgerufen am 19. September 2017.
- ↑ S2k – Kurzleitlinie – Merkelzellkarzinom ( des vom 18. Februar 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Dirk Schadendorf, Céleste Lebbé, Axel zur Hausen, Marie-Françoise Avril, Subramanian Hariharan: Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs. In: European Journal of Cancer. Band 71, S. 53–69, doi:10.1016/j.ejca.2016.10.022 (elsevier.com [abgerufen am 19. September 2017]).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Merkelzell-Karzinom auf der Website „Die Online-Enzyklopädie der Dermatologie, Venerologie, Allergologie und Umweltmedizin“ von Peter Altmeyer, Universitätshautklinik Bochum