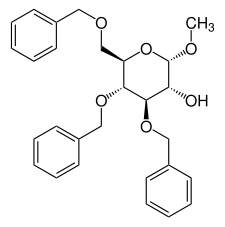
Methyl-3,4,6-tri-O-benzyl-α-D-glucopyranosid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Methyl-3,4,6-tri-O-benzyl-α-D-glucopyranosid | |||||||||
| Summenformel | C28H32O6 | |||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 464,55 g·mol−1 | |||||||||
| Aggregatzustand | ||||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Methyl-3,4,6-tri-O-benzyl-α-D-glucopyranosid ist eine chemische Verbindung, die sich von der Glucose ableitet. Es ist als Zwischenprodukt in der organischen Synthese von Bedeutung.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die erste Synthese von Methyl-3,4,6-tri-O-benzyl-α-D-glucopyranosid wurde 1972 von Ekborg et al. publiziert. Die Autoren benzylierten zuerst das Methyl-2-O-(phenylsulfonyl)-α-D-glucopyranosid[5] durch eine Nukleophile Substitution mit Benzylbromid in Dimethylformamid und Silber(I)-oxid als Base. Weil durch das freiwerdende Bromwasserstoff aber auch die glykosidische Bindung gespalten wird, muss hiernach nochmals mit Methanol gerührt werden (Fischer-Helferich-Glykosylierung). Das Zwischenprodukt wird dann in 2-Position entschützt, indem das Tosylat mit Lithiumaluminiumhydrid gespalten wird. Überschüssiges Reagenz wird neutralisiert, indem erst etwas Ethylacetat hinzugegeben wird; danach Ethanol und zuletzt verdünnte Salzsäure.[1]

Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Nach Eby et al. 1979
[Bearbeiten | Quelltext bearbeiten]3,4,6-Tri-O-acetyl-1,2-O-(1-methoxyethyliden)-α-D-glucopyranose.[6] wird durch Reaktion mit Benzylchlorid und Kaliumhydroxid in Toluol in einem Schritt verseift und benzyliert. Der Orthoester wird im zweiten Schritt hydrolysiert und das tribenzylierte Zwischenprodukt wiederum nach Fischer-Helferich glykosyliert.[3]

Nach Sollogoub et al. 1999
[Bearbeiten | Quelltext bearbeiten]Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid wird von einem Überschuss an Triisobutylaluminium regioselektiv in 2-Position debenzyliert. Die Reaktion muss wegen der Instabilität des metallorganischen Reagenzes gegenüber der Atmosphäre unter Schutzgas durchgeführt werden. Aufgrund der Befunde mit verschiedenen ähnlichen Sacchariden schlugen die Autoren einen Mechanismus vor, nach dem das Aluminiumatom zuerst an das Sauerstoffatom der Methoxygruppe koordiniert und von dieser Position aus noch eine weitere Brücke zum Sauerstoffatom der 2-Position ausbaut. Aus diesem intermediären Komplex wird aus einem sechsgliedrigen Übergangszustand heraus ein Molekül Isobuten eliminiert, wobei gleichzeitig die Benzylgruppe in Form von Toluol eliminiert wird. Der metallorganische Rest verbleibt am nun formal negativ geladenen Sauerstoffatom in der 2-Position. Die Hydrolyse dieses Alkoxids liefert den teilentschützten Zucker.[7]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methyl-3,4,6-tri-O-benzyl-α-D-glucopyranosid kann gut umkristallisiert werden aus Gemischen von Diethylether und Pentan[3] oder auch aus Hexan.[1]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e G. Ekborg, B. Lindberg, J. Lönngren, M. J. Tricker. S. Svensson: Synthesis of β-D-Mannopyranosides. In: Acta Chemica Scandinavica. Band 26, 1972, S. 3287–3292, doi:10.3891/acta.chem.scand.26-3287.
- ↑ a b J. M. Küster, I. Dyong: Partiell benzylierte Kohlenhydrate, 2. Synthese aller Methyl-mono-, Methyl-di-und Methyl-tri-O-benzyl-α-D-glucopyranoside. In: Justus Liebigs Annalen der Chemie. Band 1975, Nr. 12, 1975, S. 2179–2189, doi:10.1002/jlac.197519751203.
- ↑ a b c d R. Eby, S. J. Sondheimer, C. Schuerch: Selective acetolysis of primary benzyl ethers. In: Carbohydrate Research. Band 73, Nr. 1, 1979, S. 273–276, doi:10.1016/S0008-6215(00)85498-1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Methyl-2-O-(phenylsulfonyl)-α-D-glucopyranosid: CAS-Nr.: 137600-16-9, PubChem: 15714967, ChemSpider: 57621360, Wikidata: Q113650789.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3,4,6-Tri-O-acetyl-1,2-O-(1-methoxyethyliden)-α-D-glucopyranose: CAS-Nr.: 3254-16-8, PubChem: 11057545, ChemSpider: 9232704, Wikidata: Q72509540.
- ↑ M. Sollogoub, S. K. Das, J.-M. Mallet, P. Sinaÿ: Regioselective debenzylation of sugars using triisobutylaluminium. In: Comptes Rendus de l'Académie des Sciences-Series IIC-Chemistry. Band 2, Nr. 7-8, 1999, S. 441–448, doi:10.1016/S1387-1609(00)88558-8.