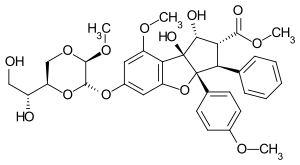
Silvestrol
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Silvestrol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C34H38O13 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| Wirkmechanismus |
eIF4A-Inhibitor | ||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 654,66 g·mol−1 | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Silvestrol ist ein Naturstoff aus der Gruppe der Cyclopenta[b]benzofurane.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Silvestrol und verschiedene Derivate können aus Früchten und Zweigen der tropischen Pflanze Aglaia foveolata und verwandten Arten extrahiert werden.[3] Die Gattung Aglaia gehört zur Familie der Mahagonigewächse („Meliaceae“), die hauptsächlich in Indonesien und in Malaysia endemisch sind.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Silvestrol ist ein spezifischer und potenter Inhibitor der RNA-Helikase eIF4A, ein Enzym, das an der Einleitung der Translation (im Rahmen der Proteinbiosynthese) beteiligt ist und RNA-Sekundärstrukturen in messenger RNAs (mRNAs) mit Cap-Struktur entwindet.[4] Dadurch wird ein Andocken der kleinen ribosomalen Untereinheit an der mRNA ermöglicht.[5] Insbesondere einige mRNAs von Protoonkogenen und virale mRNAs benötigen die Helikase-Aktivität von eIF4A für ihre Proteinbiosynthese.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
In der präklinischen Krebsforschung wird Silvestrol seit einigen Jahren zur Hemmung des Tumorzellwachstums in humanen Zellkulturen und in Tumormausmodellen eingesetzt.[6][7][8][9] Silvestrol zeigt dabei eine geringe Zytotoxizität gegenüber gesunden Zellen.
In einer Studie von 2017 mit Ebola-infizierten menschlichen Zellen wurde gezeigt, dass Silvestrol in primären humanen Makrophagen und in der Zelllinie Huh-7 (isoliert aus humanem Leberkarzinom) wirksam die Viruslast verringern kann und die Produktion viraler Proteine stark reduziert ist.[10] Auch gegen das Chikungunya-Virus,[11] das Zika-Virus[12] und gegen Picorna-[13] sowie Coronaviren[14][15][13] könnte es eine ähnliche Aktivität geben.[16]
Untersuchungen mit humanen Blutzellen zeigten einen immunmodulatorischen Einfluss durch Silvestrol auf isolierte Makrophagen und Dendritische Zellen.[17]
Für die Anwendung am Menschen ist der Naturstoff bisher nicht zugelassen. Außerdem gibt es derzeit (Stand: 2016) noch keine klinischen Studien mit Silvestrol.[18]
Herstellung[Bearbeiten | Quelltext bearbeiten]
2007 gelang erstmals die Totalsynthese von Silvestrol.[3][19][20]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Silvestrol 697235-38-4 bei ChemBlink, abgerufen am 20. Dezember 2016.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b L. Pan, J. L. Woodard, D. M. Lucas, J. R. Fuchs, A. D. Kinghorn: Rocaglamide, silvestrol and structurally related bioactive compounds from Aglaia species. In: Natural product reports. Band 31, Nummer 7, Juli 2014, S. 924–939, doi:10.1039/c4np00006d, PMID 24788392, PMC 4091845 (freier Volltext).
- ↑ C. Lu, L. Makala, D. Wu, Y. Cai: Targeting translation: eIF4E as an emerging anticancer drug target. In: Expert reviews in molecular medicine. Band 18, Januar 2016, S. e2, doi:10.1017/erm.2015.20, PMID 26775675.
- ↑ Jerry Pelletier, Jeremy Graff, Davide Ruggero, Nahum Sonenberg: Targeting the eIF4F Translation Initiation Complex: A Critical Nexus for Cancer Development. In: Cancer Research. Band 75, Nr. 2, 2015, S. 250–263, doi:10.1158/0008-5472.can-14-2789.
- ↑ Takayuki Kogure, A. Douglas Kinghorn, Irene Yan, Brad Bolon, David M. Lucas: Therapeutic Potential of the Translation Inhibitor Silvestrol in Hepatocellular Cancer. In: PLOS ONE. Band 8, Nr. 9, 2013, S. e76136, doi:10.1371/journal.pone.0076136, PMID 24086701, PMC 3784426 (freier Volltext).
- ↑ W. L. Chen, L. Pan, A. D. Kinghorn, S. M. Swanson, J. E. Burdette: Silvestrol induces early autophagy and apoptosis in human melanoma cells. In: BMC Cancer. Band 16, Januar 2016, S. 17, doi:10.1186/s12885-015-1988-0, PMID 26762417, PMC 4712514 (freier Volltext).
- ↑ Kogure T, Kinghorn AD, Yan I, Bolon B, Lucas DM, Grever MR, Patel T: Therapeutic potential of the translation inhibitor silvestrol in hepatocellular cancer. In: PLOS ONE. 8. Jahrgang, Nr. 9, 2013, S. e76136, doi:10.1371/journal.pone.0076136, PMID 24086701, PMC 3784426 (freier Volltext), bibcode:2013PLoSO...876136K.
- ↑ Pelletier J, Graff J, Ruggero D, Sonenberg N: Targeting the eIF4F translation initiation complex: a critical nexus for cancer development. In: Cancer Research. 75. Jahrgang, Nr. 2, Januar 2015, S. 250–63, doi:10.1158/0008-5472.CAN-14-2789, PMID 25593033, PMC 4299928 (freier Volltext).
- ↑ Nadine Biedenkopf, Kerstin Lange-Grünweller, Falk W. Schulte, Aileen Weißer, Christin Müller: The natural compound silvestrol is a potent inhibitor of Ebola virus replication. In: Antiviral Research. Band 137, 2017, S. 76–81, doi:10.1016/j.antiviral.2016.11.011.
- ↑ Henss L, Scholz T, Grünweller A, Schnierle BS: Silvestrol Inhibits Chikungunya-Virus Replication. In: Viruses. 10. Jahrgang, Nr. 11, Oktober 2018, S. 592, doi:10.3390/v10110592, PMID 30380742, PMC 6266838 (freier Volltext).
- ↑ Elgner F, Sabino C, Basic M, Ploen D, Grünweller A, Hildt E: Inhibition of Zika-Virus Replication by Silvestrol. In: Viruses. 10. Jahrgang, Nr. 4, März 2018, S. 149, doi:10.3390/v10040149, PMID 29584632, PMC 5923443 (freier Volltext).
- ↑ a b Müller C, Schulte FW, Lange-Grünweller K, Obermann W, Madhugiri R, Pleschka S, Ziebuhr J, Hartmann RK, Grünweller A: Broad-spectrum antiviral activity of the eIF4A inhibitor silvestrol against corona- and picornaviruses. In: Antiviral Research. 150. Jahrgang, Februar 2018, S. 123–129, doi:10.1016/j.antiviral.2017.12.010, PMID 29258862.
- ↑ Pillaiyar T, Meenakshisundaram S, Manickam M. Recent discovery and development of inhibitors targeting coronaviruses. Drug Discov Today. 2020 Jan 30. pii: S1359-6446(20)30041-6. doi:10.1016/j.drudis.2020.01.015. PMID 32006468
- ↑ Daniela Albat: Neuer Virenhemmer aus dem Meer, auf scinexx.de vom 27. März 2020
- ↑ Göran Schulz, Catherine Victoria, Andreas Kirschning, Eike Steinmann: Rocaglamide and silvestrol: a long story from anti-tumor to anti-coronavirus compounds. In: Natural Product Reports. Band 38, Nr. 1, 4. Februar 2021, S. 18–23, doi:10.1039/D0NP00024H (rsc.org [abgerufen am 16. Oktober 2021]).
- ↑ Leonard Blum, Gerd Geisslinger, Michael J. Parnham, Arnold Grünweller, Susanne Schiffmann: Natural antiviral compound silvestrol modulates human monocyte-derived macrophages and dendritic cells. In: Journal of Cellular and Molecular Medicine. doi:10.1111/jcmm.15360.
- ↑ Silvestrol bei clinicaltrials.gov, abgerufen am 21. Juli 2019.
- ↑ B. Gerard, R. Cencic et al: Enantioselective synthesis of the complex rocaglate (−)-silvestrol. In: Angewandte Chemie. Band 46, Nummer 41, 2007, S. 7831–7834, doi:10.1002/anie.200702707. PMID 17806093.
- ↑ M. El Sous, M. L. Khoo et al: Total synthesis of (−)-episilvestrol and (−)-silvestrol. In: Angewandte Chemie. Band 46, Nummer 41, 2007, S. 7835–7838, doi:10.1002/anie.200702700. PMID 17823902.