tert-Butylcarbazat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tert-Butylcarbazat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H12N2O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 132,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
39–42 °C[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
1 hPa bei 70 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4496 (25 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
tert-Butylcarbazat ist ein mit einer Boc-Schutzgruppe versehenes Hydrazin und eignet sich zum Aufbau substituierter Hydrazine, sowie von anderen vielseitig einsetzbaren tert-butylgeschützten stickstoffhaltigen Zwischenstufen (engl. intermediates), wie z. B. tert-Butylazidoformat (Boc-azid),[5] tert-Butylhydrazodiformat (N,N′-Di-Boc-hydrazin)[6] und dessen Oxidationsprodukt tert-Butylazodiformat (Di-tert-butylazodicarboxylat).[6]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die im Arbeitskreis von Louis A. Carpino ausgearbeiteten Laborsynthesen von tert-Butylcarbazat[3] gehen im als Method I bezeichneten Syntheseweg aus von S-Methylchlorthioformiat, das mit tert-Butanol zum tert-Butyl-S-methylthiolcarbonat reagiert und mit Hydrazinhydrat in 41 bis 55%iger Gesamtausbeute Boc-hydrazin liefert.
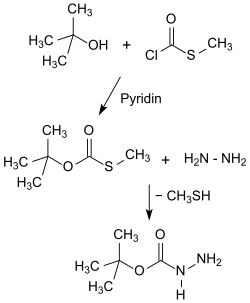
Eine andere Verfahrensvariante (Method II) startet mit Chlorameisensäurephenylester (Phenylchlorformiat), der mit tert-Butanol tert-Butylphenylcarbonat ergibt, das wiederum mit Hydrazinhydrat in 63 bis 74%iger Gesamtausbeute zu Boc-hydrazin reagiert.
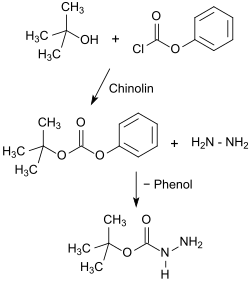
Während Method I sich auch für größere Ansätze eignet und ein kristallines Produkt liefert, wird nach Methode II statt der übelriechenden Thioverbindung das giftige und stechend riechende Phenylchlorformiat verwendet und Boc-hydrazid in deutlich besseren Ausbeuten, allerdings als schwer kristallisierbares Öl erhalten.
Beide Organic-Syntheses-Methoden erscheinen präparativ aufwendig, umständlich und wenig effizient.
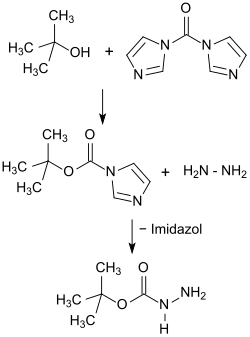
Wesentlich einfacher und sicherer erscheint dagegen die Synthese über Boc-imidazol aus dem leicht zugänglichen und gut handhabbaren Carbonyldiimidazol und tert-BuOH und Umsetzung mit Hydrazin.[7]
Eine etwas neuere Alternativroute ausgehend von tert-Butylethylcarbonat (aus Chlorameisensäureethylester und tert-Butanol) und dessen Umsetzung mit Hydrazinhydrat bietet wegen langer Reaktionszeiten und geringer Gesamtausbeute (28 %) keine erkennbaren Vorteile.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]tert-Butylcarbazat ist in Reinsubstanz ein weißer kristalliner Feststoff, der sich in Alkoholen löst. Wegen seines niedrigen Schmelzpunkts liegt die auch nur leicht verunreinigte Substanz als Öl vor.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]In den 1970er Jahren wurde tert-Butylcarbazat als Ausgangsverbindung für das als „carbo-tert-butoxylation agent of choice“[9] propagierte tert-Butylazidoformiat zur Einführung der Boc-Schutzgruppe in der Peptidsynthese von vielen Arbeitskreisen bearbeitet. Wegen seiner Giftigkeit und Gefährlichkeit (Explosionsgefahr!) ist die Verwendung von tert-Butylazidoformiat (Boc-azid) zur Einführung der Boc-Schutzgruppe angesichts sicherer Alternativen, wie z. B. Di-tert-butyldicarbonat (Boc-anhydrid, Boc2O) heutzutage nicht mehr vertretbar.
Das symmetrisch tert-butoxycarbonylsubstituierte Hydrazin tert-Butylhydrazodiformiat (N,N'-di-Boc-hydrazin) ist durch tert-Butoxycarbonylierung von tert-Butylcarbazat mittels Boc-azid[6] bzw. einfacher und sicherer mittels Boc2O bei Raumtemperatur in 85%iger Ausbeute zugänglich.[10]

Mit N-Bromsuccinimid kann Di-Boc-hydrazin glatt zu tert-Butylazodiformiat oxidiert werden,[6] das als Dienophil mit Dienen, wie z. B. Cyclopentadien in einer Hetero-Diels-Alder-Reaktion zum entsprechenden Diazanorbornen reagiert.[11]

Aus dem Arbeitskreis von Stephen L. Buchwald stammt eine regioselektive Synthese hochsubstituierter Pyrrole mit dem Schlüsselreagenz tert-Butylhydrazodiformiat.[12]
Ausgehend von Boc-hydrazin ist durch Umsetzung mit para-Toluolsulfonsäurechlorid (Tosylchlorid) das beidseitig geschützte Hydrazinderivat 1-Boc-2-tosylhydrazin (71 % Ausbeute) zugänglich,.
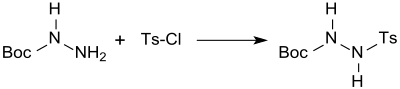
mit dem in McFadyen-Stevens-Reaktionen aus aliphatischen und aromatischen Carbonsäuren unter milden Bedingungen und in meist hohen Ausbeuten die entsprechenden Aldehyde erhalten werden.[13]
Eine wichtige Reaktionsstufe in der Synthese des HIV-Proteaseinhibitors Atazanavir ist die Einführung einer Hydrazingruppe durch Hydrazonbildung mit Boc-hydrazin.[14]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt tert-Butyl carbazate, 98+% bei Alfa Aesar, abgerufen am 8. Mai 2018 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt tert.-Butylcarbazat 98% bei Sigma-Aldrich, abgerufen am 8. Mai 2018 (PDF).
- ↑ a b L.A. Carpino, D. Collins, S. Göwecke, J. Mayo, S.D. Thatte, F. Tibbetts: t-Butyl carbazate In: Organic Syntheses. 44, 1964, S. 20, doi:10.15227/orgsyn.044.0020; Coll. Vol. 5, 1973, S. 166 (PDF).
- ↑ a b Carl. L. Yaws: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals, 2nd Edition. Elsevier, Amsterdam 2015, ISBN 978-0-12-800834-8, S. 84.
- ↑ W.H. Pearson, P.S. Ramamoorthy, H.O. Sintim, J. Wang: tert-Butyl Azidoformate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2008, doi:10.1002/047084289X.rb364.pub2.
- ↑ a b c d L.A. Carpino, P.J. Crowley: t-Butyl azodiformate In: Organic Syntheses. 44, 1964, S. 18, doi:10.15227/orgsyn.044.0018; Coll. Vol. 5, 1973, S. 160 (PDF).
- ↑ W. Klee, M. Brenner: tert-Butyloxycarbonyl-imidazol und tert-Butyloxycarbonyl-hydrazin. In: Helv. Chim. Acta. Band 44, Nr. 7, 1961, S. 2151–2153, doi:10.1002/hlca.19610440742.
- ↑ M. Muraki, T. Mizoguchi: A convenient preparation of tert-Butyl carbazate. In: Chem. Pharm. Bull. Band 18, Nr. 1, 1970, S. 217–218, doi:10.1248/cpb.18.217.
- ↑ K. Sakai, J.-P. Anselme: The direct preparation of tert-Butyl azidoformate. In: J. Org. Chem. Band 36, Nr. 16, 1971, S. 2387–2388, doi:10.1021/jo00815a046.
- ↑ M. Raju, S. Mäeorg, O. Tsubrik, U. Mäeorg: Efficient solventless technique for Boc-protection of hydrazines and amines. In: Arkivoc. Band VI, 2009, S. 291–297, doi:10.3998/ark.5550190.0010.628 (arkat-usa.org).
- ↑ L.A. Carpino, P.H. Terry, P.J. Crowley: Examination of synthetic routes to monosubstituted diimides. II. Synthesis of tert-butyl aryl- and acylazoformates. Acid-induced cleavage of the thionocarbo-tert-butoxy group. In: J. Org. Chem. Band 26, Nr. 11, 1961, S. 4336–4340, doi:10.1021/jo01069a037.
- ↑ M.R. Rivero, S.L. Buchwald: Copper-catalyzed vinylation of hydrazides. A regioselective entry to highly substituted pyrroles. In: Org. Lett. Band 9, Nr. 6, 2007, S. 973–976, doi:10.1021/ol062978s.
- ↑ Y. Iwai, T. Ozaki, R. Takita, M. Uchiyama, J. Shimokawa, T. Fukuyama: Modified McFadyen-Stevens reaction for a versatile synthesis of aliphatic/aromatic aldehydes: Design, optimization, and mechanistic investigations. In: Chem. Sci. Band 4, Nr. 3, 2013, S. 1111–1119, doi:10.1039/C2SC22045H.
- ↑ L. Dalla-Vechia, B. Reichart, T. Glasnov, L.S.M. Miranda, C.O. Knappe, R.O.M.A. de Souza: A three step continuous flow synthesis of the biaryl unit of the HIV protease inhibitor Atazanavir. In: Org. Biomol. Chem. Band 11, 2013, S. 6806–6813, doi:10.1039/C3OB41464G.
