Toxaphen
| Allgemeines | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name | Toxaphen | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | – (komplexes Gemisch) | ||||||||||||
| Kurzbeschreibung |
gelber, wachsartiger Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | – (komplexes Gemisch) | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,65 g·cm−3 [1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
Zersetzung[1] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (~3 mg·l−1 bei 20 °C)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| MAK |
Schweiz: 0,5 mg·m−3 (gemessen als einatembarer Staub)[3] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
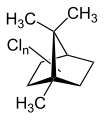
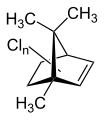
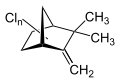
Toxaphen ist ein Pestizid, das aus einer komplexen Mischung unterschiedlich substituierter Chlorkohlenwasserstoffe besteht, die sich vom Grundgerüst des Bornans ableiten.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Es wurde erstmals 1945 von Hercules Inc. als Hercules 3956 in den Verkehr gebracht. Toxaphen war eines der weltweit am meisten verwendeten Insektizide, bis zu seinem Verbot durch die EPA 1982. Zwischen 1946 und 1993 wurde weltweit ungefähr eine Million Tonnen an Toxaphen verbraucht. In der Bundesrepublik Deutschland wurde sein Einsatz in der Landwirtschaft bereits 1971 verboten.
Zusammensetzung[Bearbeiten | Quelltext bearbeiten]
Toxaphen besteht aus einer komplexen Mischung aus hauptsächlich mehrfach chlorierten Bornanen, mehrfach chlorierten Bornenen, Bornadienen, Camphenen und Dihydrocamphenen. Das technische Produkt enthält mindestens 202 verschiedene chemische Verbindungen.[4]
-
Chlorbornane
-
Chlorbornene
-
Chlorbornadiene
-
Chlorcamphene
(Isomerengemisch) -
Chlordihydrocamphene
(Isomerengemisch)
Analytischer Nachweis[Bearbeiten | Quelltext bearbeiten]
Der chemisch-analytische Nachweis in Umweltproben, Lebens- und Futtermitteln erfolgt nach geeigneter Probenvorbereitung zur Abtrennung der Matrix und gaschromatographischer Abtrennung von Nebenkomponenten mittels hochauflösender massenspektrometrischer Techniken wie der Flugzeitmassenspektrometrie (Time-Of-Flight-Massenspektrometrie).[5]
Verbot[Bearbeiten | Quelltext bearbeiten]
Durch das Stockholmer Übereinkommen vom 22. Mai 2001 wurde ein weltweites Verbot zur Herstellung, Verkauf und Anwendung von zwölf persistenten organischen Schadstoffen (POP = persistent organic pollutants) ratifiziert. Zu diesem „dreckigen Dutzend“ gehört auch Toxaphen. Mit der Ratifizierung durch den 50. Beitrittsstaat am 17. Mai 2004 erlangte das Übereinkommen globale Rechtsgültigkeit in den Vertragsparteien.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Toxaphen wurde als Pestizid vor allem beim Anbau von Baumwolle, Getreide, Früchten, Nüssen und Gemüse eingesetzt.
Toxizität und Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Toxaphen gilt als krebserzeugend.[1]
Wegen der hohen Flüchtigkeit wird Toxaphen auch über die Atmosphäre in abgelegene Gebiete transportiert und ist somit überall (ubiquitär) in der Umwelt vorhanden.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Universität Hohenheim: Chemie und Umweltverhalten des Chlorpestizides Toxaphen
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu Toxaphen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Toxaphene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 8001-35-2 bzw. Toxaphen), abgerufen am 2. November 2015.
- ↑ Mahmoud Abbas Saleh: Capillary gas chromatography-electron impact chemical ionization mass spectrometry of toxaphene, J. Agric. Food Chem., 1983, 31 (4), S. 748–751, doi:10.1021/jf00118a017.
- ↑ Eric J. Reiner, Adrienne R. Boden, Tony Chen, Karen A. MacPherson und Alina M. Muscalu: Advances in the Analysis of Persistent Halogenated Organic Compounds. In: LC GC Europe, 23 (2010) 60–70.
- Giftiger Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Hautreizender Stoff
- Atemwegsreizender Stoff
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Chloralkan
- Insektizid
- Pflanzenschutzmittel (Wirkstoff)
- Norbornan
- Stoffgemisch
- Persistenter organischer Schadstoff nach Stockholmer Übereinkommen
- Persistenter organischer Schadstoff nach dem Übereinkommen über weiträumige grenzüberschreitende Luftverunreinigung
- UVCB-Stoff
- Gefährliche Chemikalie nach dem Rotterdamer Übereinkommen