α-Mannosidose
| Klassifikation nach ICD-10 | |
|---|---|
| E77.1 | Defekte beim Glykoproteinabbau Mannosidose |
| ICD-10 online (WHO-Version 2019) | |
Die α-Mannosidose ist eine sehr seltene autosomal-rezessiv vererbte lysosomale Speicherkrankheit.
Prävalenz[Bearbeiten | Quelltext bearbeiten]

Die α-Mannosidose ist mit einer Prävalenz von etwa 1 : 500.000 bei lebendgeborenen Kindern eine ausgesprochen seltene Erkrankung.[1]
Symptome[Bearbeiten | Quelltext bearbeiten]
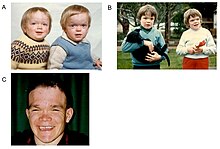
Die α-Mannosidose ist bei den betroffenen Patienten durch Immunschwäche, Anomalien des Gesichts, Veränderungen am Skelett, Schwerhörigkeit und intellektuelle Defizite gekennzeichnet. Die ersten Symptome können schon bei der Geburt sichtbar sein. Mit zunehmendem Alter schreitet die Krankheit aber voran und der Zustand der Betroffenen verschlechtert sich weiter. Neben den bereits erwähnten Symptomen können einige mit Klumpfuß geboren werden oder in den ersten zwölf Monaten einen Hydrocephalus (Wasserkopf) entwickeln.[1]
Die Immunschwäche bedingt vor allem im ersten Lebensjahrzehnt rezidive Infekte. Unter den Skelettanomalien finden sich unter anderem leicht- bis mittelgradiger Dysostosis multiplex, Skoliose (Seitverbiegung der Wirbelsäule) und Deformation des Brustbeins. Die Anomalien des Gesichts sind ein vergrößerter Schädel, eine markante Stirn, abgerundete Augenbrauen, Sattelnase, Makroglossie (vergrößerte Zunge), weit auseinanderstehende Zähne und Progenie (eine Form der Kieferfehlstellung). Leichtes Schielen ist ebenfalls ein häufiges Symptom.[1]
Die Schwerhörigkeit zeichnet sich durch eine mittlere bis schwere Störung der Schallempfindung aus. Die Motorik der Patienten wird auch durch Muskelschwäche, Anomalien der Gelenke und Ataxie beeinträchtigt.[1]
Von Patient zu Patient können sich die Symptome erheblich unterscheiden.[1]
Genetik und Pathogenese[Bearbeiten | Quelltext bearbeiten]

Der α-Mannosidose liegt ein autosomal-rezessiver Erbgang zugrunde. Mutationen im MAN2B1-Gen, das sich auf Chromosom 19 Genlocus p13.2-q12 befindet, sind die Ursache der Erkrankung. Das MAN2B1-Gen codiert für das Enzym α-Mannosidase. Mutationen in diesem Genprodukt können eine verminderte Aktivität der α-Mannosidase bewirken, wodurch sich im Gewebe der betroffenen Patienten mannosereiche Glycokonjugate anreichern.
Diagnose[Bearbeiten | Quelltext bearbeiten]
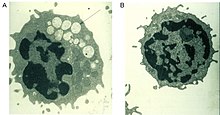
Die Diagnose kann durch die Bestimmung der Aktivität der α-Mannosidase in Leukozyten oder anderen kernhaltigen Zellen gestellt werden. Eine DNA-Analyse (‚Gentest‘) kann zur Bestätigung der Ergebnisse durchgeführt werden. Die Ausscheidung erhöhter Mengen von mannosereichen Oligosacchariden über den Urin ist ein Indiz für die Erkrankung, aber kein spezifischer Nachweis. Eine pränatale Diagnose ist sowohl biochemisch als auch molekulargenetisch möglich.[1]
Therapie[Bearbeiten | Quelltext bearbeiten]
Es gibt bisher keinen etablierte kurative Therapie.
Enzymersatztherapie[Bearbeiten | Quelltext bearbeiten]
Ein vielversprechender Therapieansatz ist die Enzymersatztherapie (EET oder ERT von engl. Enzyme Replacement Therapy).
Forschungsarbeiten[Bearbeiten | Quelltext bearbeiten]
Im Tiermodell Meerschweinchen konnte mit EET die Akkumulation der Oligosaccharide im Gewebe reduziert werden. Eine Ausnahme bildete dabei das Gehirn, da das applizierte Enzym, bedingt durch die Blut-Hirn-Schranke, nicht das Gehirn erreichen kann.[2] Ähnliche Versuche bei Knockout-Mäusen – hier wurde das Man2b1-Gen der Mäuse abgeschaltet – führten überraschenderweise auch zu einer Abnahme der Oligosaccharide im Gehirn der Versuchstiere.[3] Die Etablierung der ERT für Patienten mit α-Mannosidose war ein Ziel des 2006 initiierten europäischen Projektes Hue-Man.[4]
Arzneimittel[Bearbeiten | Quelltext bearbeiten]
Am 23. März 2018 wurde in der Europäischen Union Velmanase alfa (Handelsname Lamzede der Firma Chiesi) als Enzymersatztherapie zur Behandlung nicht neurologischer Manifestationen bei Patienten mit leichter bis mittelschwerer Alpha-Mannosidose als Arzneimittel zugelassen.[5]
Velmanase alfa ist eine rekombinante Form der humanen Alpha-Mannosidase. Es soll die natürliche Alpha-Mannosidase ergänzen oder ersetzen. Das Arzneimittel wird einmal wöchentlich als intravenöse Infusion verabreicht. Eine klinische Studie ergab Hinweise darauf, dass Velmanase alfa die Progression der bestehenden Krankheit verlangsamen kann.[6]
Allogene Stammzelltransplantation[Bearbeiten | Quelltext bearbeiten]
Bei einigen Patienten wurde eine allogene Stammzelltransplantation durchgeführt.[7][8][9][10] Die Ergebnisse waren zum Teil recht vielversprechend. Der therapeutische Nutzen ist aber bei den erheblichen Risiken der allogenen Stammzelltransplantation genau abzuwägen. Die allogene Stammzelltransplantation ist vor allem bei jungen Patienten in der ersten Lebensdekade, mit weniger stark fortgeschrittener Erkrankung, eine Therapieoption.[1]
Zink-Substitution[Bearbeiten | Quelltext bearbeiten]
Die Gabe von Zinksulfat (Zink-Substitution) zeigte in vitro eine signifikante Steigerung der Aktivität der α-Mannosidase, weshalb dies anfänglich ein verbreiteter Therapieansatz war. In Langzeitstudien zeigte sich jedoch bei Patienten mit α-Mannosidose kein signifikanter Effekt.[11]
Sonstige Therapie[Bearbeiten | Quelltext bearbeiten]
Die sonst übliche Therapie erfolgt rein symptomatisch. Dabei wird idealerweise eine proaktive Behandlung, wie beispielsweise Krankengymnastik, die möglichen zukünftigen Komplikationen vorbeugt, angewendet. Die durch die Immunschwäche bedingten Infekte müssen häufig behandelt werden.
Prognose[Bearbeiten | Quelltext bearbeiten]
Der Zustand der Patienten verschlechtert sich mit zunehmendem Alter. Die Funktion der Skelettmuskulatur und die Motorik lassen zunehmend nach, wodurch der Großteil der Betroffenen rollstuhlpflichtig wird. Kein Patient ist vollständig sozial unabhängig. Viele Patienten werden älter als 50 Jahre. Mit zunehmender Progression der Erkrankung werden alle Patienten schwerhörig und benötigen ein Hörgerät.[1]
Erstbeschreibung[Bearbeiten | Quelltext bearbeiten]
Der Arzt Per-Arne Öckerman (* 1933) von der Universität Lund in Schweden beschrieb 1967 als Erster bei einem Jungen eine neue Form einer lysosomalen Speicherkrankheit mit ähnlichen Symptomen wie das Hurler-Syndrom, bei der aber keine Mukopolysaccharide akkumuliert werden.[12]
Veterinärmedizin[Bearbeiten | Quelltext bearbeiten]
Bei Rindern, insbesondere bei der Rasse ‚Aberdeen Angus‘ ist die α-Mannosidose eine relativ häufig verbreitete Krankheit.[13][14]
Literatur[Bearbeiten | Quelltext bearbeiten]
- K. W. Moremen: Golgi alpha-mannosidase II deficiency in vertebrate systems: implications for asparagine-linked oligosaccharide processing in mammals. In: Biochimica et Biophysica Acta. Band 1573, Nummer 3, Dezember 2002, S. 225–235, PMID 12417404.
- T. Beccari et al.: Lysosomal alpha-D-mannosidase. In: Bioscience Reports. Band 19, Nummer 3, Juni 1999, S. 157–162, PMID 10513892.
- J. P. Kistler et al.: Mannosidosis. New clinical presentation, enzyme studied, and carbohydrate analysis. In: Archives of Neurology. Band 34, Nummer 1, Januar 1977, S. 45–51, PMID 12732.
- Y. Gotoda et al.: Missense and nonsense mutations in the lysosomal alpha-mannosidase gene (MANB) in severe and mild forms of alpha-mannosidosis. In: American Journal of Human Genetics. Band 63, Nummer 4, Oktober 1998, S. 1015–1024, doi:10.1086/302048. PMID 9758606. PMC 1377481 (freier Volltext).
- A. Gutschalk et al.: Adult alpha-mannosidosis: clinical progression in the absence of demyelination. In: Neurology. Band 63, Nummer 9, November 2004, S. 1744–1746, PMID 15534274.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Α-Mannosidose. In: Online Mendelian Inheritance in Man. (englisch)
- Α-Mannosidose. In: Orphanet (Datenbank für seltene Krankheiten).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k D. Malm und O. Nilsson: Alpha-mannosidosis. In: Orphanet Journal of Rare Diseases 3, 2008, 21. (Review, Open Access, CC-by-2.0)
- ↑ A. C. Crawley et al.: Enzyme replacement therapy in alpha-mannosidosis guinea-pigs. In: Molecular Genetics and Metabolism. Band 89, Nummer 1–2, 2006 Sep-Oct, S. 48–57, doi:10.1016/j.ymgme.2006.05.005. PMID 16807033.
- ↑ D. P. Roces, et al.: Efficacy of enzyme replacement therapy in alpha-mannosidosis mice: a preclinical animal study. In: Human Molecular Genetics. Band 13, Nummer 18, September 2004, S. 1979–1988, doi:10.1093/hmg/ddh220. PMID 15269179.
- ↑ Towards The Development Of An Effective Enzyme Replacement Therapy For Human Alpha-Mannosidosis. Abgerufen am 7. November 2009
- ↑ European Medicines Agency – Find medicine – Lamzede. Abgerufen am 4. Juli 2018 (englisch).
- ↑ Lamzede – Fachinformation und Gebrauchsinformation. Abgerufen am 4. Juli 2018.
- ↑ S. S. Grewal et al.: Effective treatment of alpha-mannosidosis by allogeneic hematopoietic stem cell transplantation. In: The Journal of Pediatrics. Band 144, Nummer 5, Mai 2004, S. 569–573, doi:10.1016/j.jpeds.2004.01.025. PMID 15126988.
- ↑ D. A. Wall, D. K. Grange, P. Goulding, M. Daines, A. Luisiri, S. Kotagal: Bone marrow transplantation for the treatment of alpha-mannosidosis. In: The Journal of pediatrics. Band 133, Nummer 2, August 1998, S. 282–285, PMID 9709723.
- ↑ A. Will et al.: Bone marrow transplantation in the treatment of alpha-mannosidosis. In: Archives of Disease in Childhood. Band 62, Nummer 10, Oktober 1987, S. 1044–1049, PMID 3314721. PMC 1778651 (freier Volltext).
- ↑ S. U. Walkley et al.: Bone marrow transplantation corrects the enzyme defect in neurons of the central nervous system in a lysosomal storage disease. In: Proceedings of the National Academy of Sciences. Band 91, Nummer 8, April 1994, S. 2970–2974, PMID 8159689. PMC 43496 (freier Volltext).
- ↑ L. T. Wong et al.: Oral zinc therapy in the treatment of alpha-mannosidosis. In: American journal of medical genetics. Band 46, Nummer 4, Juni 1993, S. 410–414, doi:10.1002/ajmg.1320460413. PMID 8357013.
- ↑ P. A. Öckerman: A generalised storage disorder resembling Hurler’s syndrome. In: The Lancet 2, 1967, doi:10.1016/S0140-6736(67)92303-3. S. 239.
- ↑ J. D. Hocking et al.: Deficiency of alpha-mannosidase in Angus cattle. An inherited lysosomal storage disease. In: The Biochemical journal. Band 128, Nummer 1, Juni 1972, S. 69–78, PMID 4673577. PMC 1173571 (freier Volltext).
- ↑ H. W. Leipold et al.: Mannosidosis of Angus calves. In: Journal of the American Veterinary Medical Association. Band 175, Nummer 5, September 1979, S. 457–459, PMID 500478.