„Titan(IV)-oxid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Aka (Diskussion | Beiträge) K Tippfehler entfernt |
JWBE (Diskussion | Beiträge) Formalia |
||
| Zeile 2: | Zeile 2: | ||
| Kristallstruktur = Ja |
| Kristallstruktur = Ja |
||
| Strukturformel = [[Datei:Kristallstruktur Titandioxid.png|200px|Kristallstruktur von Titan(IV)-oxid (Rutil)]] |
| Strukturformel = [[Datei:Kristallstruktur Titandioxid.png|200px|Kristallstruktur von Titan(IV)-oxid (Rutil)]] |
||
| Strukturhinweis = Rutil <span style="color:silver; background:silver;">__</span> [[Titan (Element)|Ti]]<sup>4+</sup> <span style="color:#e00; background:#e00;">__</span> [[Sauerstoff|O]]<sup>2−</sup> |
|||
| Suchfunktion = NM |
| Suchfunktion = NM |
||
| Andere Namen = * Titandioxid |
| Andere Namen = * Titandioxid |
||
| Zeile 14: | Zeile 14: | ||
| Summenformel = TiO<sub>2</sub> |
| Summenformel = TiO<sub>2</sub> |
||
| CAS = TiO<sub>2</sub> 13463-67-7, Anatas 1317-70-0, Brookit 12188-41-9, Rutil 1317-80-2 |
| CAS = TiO<sub>2</sub> 13463-67-7, Anatas 1317-70-0, Brookit 12188-41-9, Rutil 1317-80-2 |
||
| Beschreibung = weißes, kristallines Pulver |
| Beschreibung = weißes, kristallines Pulver<ref name="GESTIS"/> |
||
| Molare Masse = 79,90 g·[[mol]]<sup>−1</sup> |
| Molare Masse = 79,90 g·[[mol]]<sup>−1</sup> |
||
| Aggregat = fest |
| Aggregat = fest |
||
| Dichte = Rutil 4,24 g·cm<sup>−3</sup> |
| Dichte = Rutil 4,24 g·cm<sup>−3</sup><ref name="GESTIS">{{GESTIS|ZVG=1780|Name=Titan(IV)-oxid|Datum=29. November 2007}}.</ref> |
||
| Schmelzpunkt = 1855 |
| Schmelzpunkt = 1855 [[Grad Celsius|°C]]<ref name="GESTIS"/> |
||
| Siedepunkt = 2900 °C |
| Siedepunkt = 2900 °C<ref name="GESTIS"/> |
||
| Brechungsindex = optisch anisotrop, |
| Brechungsindex = optisch anisotrop, doppelbrechend oder zweiachsig |
||
doppelbrechend oder zweiachsig |
|||
| Löslichkeit = * unlöslich in Wasser, organischen Lösemitteln, verdünnten [[Base (Chemie)|Basen]]<ref name=roempp>{{Literatur|Herausgeber=Thieme Chemistry|Titel=RÖMPP Online - Version 3.5|Verlag=Georg Thieme Verlag KG|Ort=Stuttgart|Jahr=2009}}</ref> |
| Löslichkeit = * unlöslich in Wasser, organischen Lösemitteln, verdünnten [[Base (Chemie)|Basen]]<ref name=roempp>{{Literatur|Herausgeber=Thieme Chemistry|Titel=RÖMPP Online - Version 3.5|Verlag=Georg Thieme Verlag KG|Ort=Stuttgart|Jahr=2009}}</ref> |
||
* löslich in heißer konzentrierter [[Schwefelsäure]], [[Flusssäure]] und geschmolzenen Alkalimetallhydroxiden und Alkalimetallcarbonaten,verdünnten Säuren |
* löslich in heißer konzentrierter [[Schwefelsäure]], [[Flusssäure]] und geschmolzenen Alkalimetallhydroxiden und Alkalimetallcarbonaten,verdünnten Säuren<ref name=roempp/> |
||
| Quelle GefStKz = <ref name="GESTIS"/> |
| Quelle GefStKz = <ref name="GESTIS"/> |
||
| Gefahrensymbole = {{Gefahrensymbole|-}} |
| Gefahrensymbole = {{Gefahrensymbole|-}} |
||
| Zeile 30: | Zeile 29: | ||
}} |
}} |
||
'''Titan(IV)-oxid''' ('''Titandioxid''') ist das IV-[[Wertigkeit (Chemie)|wertige]] [[Oxide|Oxid]] des [[Titan (Element)|Titans]]. Neben diesem [[Polymorphie_(Materialwissenschaft)|polymorphen]] Oxid gibt es eine Reihe an nichtstöchiometrischen Suboxiden des Titans, sogenannte Magneli-Phasen sowie das Ti(III)<sub>2</sub>O<sub>3</sub> und Ti(II)O.<ref>[http://ruby.chemie.uni-freiburg.de/Vorlesung/oxide_4.html Univ. Freiburg] Vorlesungsscript Chemie, Oxide Teil 4: Nichtstöchiometrische binäre Oxide</ref> |
'''Titan(IV)-oxid''' ('''Titandioxid''') ist das IV-[[Wertigkeit (Chemie)|wertige]] [[Oxide|Oxid]] des [[Titan (Element)|Titans]]. Neben diesem [[Polymorphie_(Materialwissenschaft)|polymorphen]] Oxid gibt es eine Reihe an nichtstöchiometrischen Suboxiden des Titans, sogenannte Magneli-Phasen sowie das Ti(III)<sub>2</sub>O<sub>3</sub> und Ti(II)O.<ref>[http://ruby.chemie.uni-freiburg.de/Vorlesung/oxide_4.html Univ. Freiburg] Vorlesungsscript Chemie, Oxide Teil 4: Nichtstöchiometrische binäre Oxide.</ref> |
||
Titandioxid hat als Weißpigment ein weites Einsatzgebiet, daher werden weltweit pro Jahr vier bis fünf Millionen Tonnen produziert.<ref>[http://minerals.usgs.gov/minerals/pubs/commodity/titanium/mcs-2012-timin.pdf United States Geological Survey] USGS TITANIUM MINERAL CONCENTRATES (engl. PDF)</ref> Die Haupteinsatzgebiete liegen im Bereich der Beschichtungen wie Lacke und Anstriche, gefolgt von Kunststoffeinfärbungen. Auch farbige Produkte enthalten in der Regel [[Weißpigmente]] um eine hohe [[Deckkraft]] zu erreichen. |
Titandioxid hat als Weißpigment ein weites Einsatzgebiet, daher werden weltweit pro Jahr vier bis fünf Millionen Tonnen produziert.<ref>[http://minerals.usgs.gov/minerals/pubs/commodity/titanium/mcs-2012-timin.pdf United States Geological Survey] USGS TITANIUM MINERAL CONCENTRATES (engl. PDF).</ref> Die Haupteinsatzgebiete liegen im Bereich der Beschichtungen wie Lacke und Anstriche, gefolgt von Kunststoffeinfärbungen. Auch farbige Produkte enthalten in der Regel [[Weißpigmente]] um eine hohe [[Deckkraft]] zu erreichen. |
||
== Geschichte == |
== Geschichte == |
||
Nachdem Titan 1791 von [[William Gregor]] |
Nachdem Titan 1791 von [[William Gregor]] im [[Ilmenit]] entdeckt wurde, erkannte [[Martin Heinrich Klaproth|Heinrich Klaproth]] das Titanoxid im [[Rutil]]. Die industrielle Nutzung begann, als die hervorragende Eignung als weißes, ungiftiges [[Pigment]] 1908 in [[Norwegen]] und den [[USA]] erkannt wurde. Ab 1916 wurde das Pigment bereits unter der Bezeichnung [[Kronos International|Kronos]] Titan White kommerziell hergestellt. Bis 1938 wurde Titanweiß nur in der [[Anatas]]-Modifikation hergestellt, dann aber zunehmend in der [[Rutil]]-Modifikation, da deren [[Photokatalyse|photokatalytische Aktivität]] geringer und die [[Bewitterung|Bewitterungsstabilität]] der daraus hergestellten Produkte entsprechend höher ist. Das Weißpigment auf der Basis der Rutil-Modifikation wird auch als Rutilweiß bezeichnet. |
||
Mehr als die Hälfte der Produktionsmenge wird in Beschichtungsstoffen eingesetzt, gefolgt von Polymeren. 70 % der Weltproduktion werden von fünf Herstellern produziert, wobei neben dem Marktführer [[DuPont]] (USA) noch die Unternehmen [[Cristal Global]] (Saudi-Arabien), [[Huntsman Corporation|Huntsman]] (USA), [[Kronos International|Kronos]] (USA) und [[Tronox]] (USA) zu den weltweit größten Produzenten gezählt werden. Die Regionen, die am meisten Titandioxid verbrauchen, sind [[Nordamerika]], [[Europa]] und [[China]]. Insgesamt wird jeweils ein Drittel in Europa-Afrika-Mittlerer Osten, Amerika und im pazifisch-asiatischen Bereich verbraucht.<ref name="LdL">T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage |
Mehr als die Hälfte der Produktionsmenge wird in Beschichtungsstoffen eingesetzt, gefolgt von Polymeren. 70 % der Weltproduktion werden von fünf Herstellern produziert, wobei neben dem Marktführer [[DuPont]] (USA) noch die Unternehmen [[Cristal Global]] (Saudi-Arabien), [[Huntsman Corporation|Huntsman]] (USA), [[Kronos International|Kronos]] (USA) und [[Tronox]] (USA) zu den weltweit größten Produzenten gezählt werden. Die Regionen, die am meisten Titandioxid verbrauchen, sind [[Nordamerika]], [[Europa]] und [[China]]. Insgesamt wird jeweils ein Drittel in Europa-Afrika-Mittlerer Osten, Amerika und im pazifisch-asiatischen Bereich verbraucht.<ref name="LdL">T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage; Vincentz Network; Hannover; 2000; ISBN 3-87870-569-7; S. 123.</ref> |
||
== Vorkommen == |
== Vorkommen == |
||
Titan(IV)-oxid kommt in der Natur in drei [[Polymorphie (Materialwissenschaft)|Modifikationen]] vor: |
Titan(IV)-oxid kommt in der Natur in drei [[Polymorphie (Materialwissenschaft)|Modifikationen]] vor: |
||
* [[Rutil]] ist ein [[tetragonal]]es [[Mineral]] von meist prismatischem Habitus. Die Kristallstruktur ordnet in der Raumgruppe 136, das entspricht dem [[Hermann-Mauguin-Symbol]] P4<sub>2</sub>/mnm.<ref name="CCMS">Kristallstruktur-Datenbank des [http://cst-www.nrl.navy.mil/lattice/ Center for Computational Materials Science] des [http://www.nrl.navy.mil/ U.S. Naval Research Laboratory]</ref> |
* [[Rutil]] ist ein [[tetragonal]]es [[Mineral]] von meist prismatischem Habitus. Die Kristallstruktur ordnet in der Raumgruppe 136, das entspricht dem [[Hermann-Mauguin-Symbol]] P4<sub>2</sub>/mnm.<ref name="CCMS">Kristallstruktur-Datenbank des [http://cst-www.nrl.navy.mil/lattice/ Center for Computational Materials Science] des [http://www.nrl.navy.mil/ U.S. Naval Research Laboratory].</ref> Das Rutil-TiO<sub>2</sub> hat eine Dichte von 4,26 g/cm<sup>3</sup>. Der Name ''Rutil'' stammt vom lateinischen ''rutilus'' – rötlich, in Anspielung auf die durch [[Eisen]]-Verunreinigungen erzeugte Farbe. |
||
* [[Anatas]] bildet tetragonale holoedrische Kristalle (holoedrisch bedeutet die höchstsymmetrische Gruppe innerhalb eines [[Kristallsystem]]s) im tetragonalen damit [[Hermann-Mauguin-Symbol#Kombinierte Symmetrieoperationen (Drehachsen senkrecht zu Spiegelebenen)|4/m 2/m 2/m]]. Es kristallisiert in der Raumgruppe 141, das heißt I4<sub>1</sub>/amd |
* [[Anatas]] bildet tetragonale holoedrische Kristalle (holoedrisch bedeutet die höchstsymmetrische Gruppe innerhalb eines [[Kristallsystem]]s) im tetragonalen damit [[Hermann-Mauguin-Symbol#Kombinierte Symmetrieoperationen (Drehachsen senkrecht zu Spiegelebenen)|4/m 2/m 2/m]]. Es kristallisiert in der Raumgruppe 141, das heißt I4<sub>1</sub>/amd<ref name="CCMS"/>. Anatas wandelt sich bei 700 °C, abhängig von der Atmosphäre und Fremdionen, irreversibel in Rutil um. Die Dichte von Anatas beträgt 3,88 g/cm<sup>3</sup>. |
||
* [[Brookit]] bildet orthorhombische Minerale und kristallisiert in der Raumgruppe 61, Pbca <ref name="CCMS"/>. Auch Brookit geht unterhalb des [[Schmelzpunkt]]es in Rutil über und hat eine Dichte von 4 |
* [[Brookit]] bildet orthorhombische Minerale und kristallisiert in der Raumgruppe 61, Pbca <ref name="CCMS"/>. Auch Brookit geht unterhalb des [[Schmelzpunkt]]es in Rutil über und hat eine Dichte von 4,12 g/cm<sup>3</sup>. Technisch hat der Brookit keine Bedeutung. |
||
== Gewinnung und Darstellung == |
== Gewinnung und Darstellung == |
||
| Zeile 58: | Zeile 57: | ||
Das so erhaltene Titanoxohydrat, formal TiO(OH)<sub>2</sub> oder TiO<sub>2</sub>xH<sub>2</sub>O, wird durch Temperung in Anatas oder Rutil überführt. Die Verbrennung von TiCl<sub>4</sub> mit Sauerstoff wird im Labormaßstab selten angewendet. |
Das so erhaltene Titanoxohydrat, formal TiO(OH)<sub>2</sub> oder TiO<sub>2</sub>xH<sub>2</sub>O, wird durch Temperung in Anatas oder Rutil überführt. Die Verbrennung von TiCl<sub>4</sub> mit Sauerstoff wird im Labormaßstab selten angewendet. |
||
Da die Hauptmenge des technisch hergestellten TiO<sub>2</sub> als Pigment verwendet wird, stören färbende Ionen wie [[Eisen]]. Als Erze werden für das [[Sulfatverfahren (Titandioxid)|Sulfatverfahren]] in der Regel [[Ilmenit (FeTiO<sub>3</sub>) oder titanhaltige [[Schlacke_(Metallurgie)|Schlacken]] aus der [[Schmelz-Reduktionsofen|Elektroreduktion]] des Ilmenits eingesetzt<ref>[http://www.pyrometallurgy.co.za/InfaconXI/078.pdf Pyrometallurgy South Africa] Eletro Smelting of Ilmenite for Production of TiO<sub>2</sub> Slag</ref> |
Da die Hauptmenge des technisch hergestellten TiO<sub>2</sub> als Pigment verwendet wird, stören färbende Ionen wie [[Eisen]]. Als Erze werden für das [[Sulfatverfahren (Titandioxid)|Sulfatverfahren]] in der Regel [[Ilmenit]] (FeTiO<sub>3</sub>) oder titanhaltige [[Schlacke_(Metallurgie)|Schlacken]] aus der [[Schmelz-Reduktionsofen|Elektroreduktion]] des Ilmenits eingesetzt.<ref>[http://www.pyrometallurgy.co.za/InfaconXI/078.pdf Pyrometallurgy South Africa] Eletro Smelting of Ilmenite for Production of TiO<sub>2</sub> Slag.</ref> Diese Schlacke, genau wie Rutil aus [[alluvial]]en [[Lagerstätte]]n, kann auch im technisch anspruchsvolleren [[Chloridverfahren]] eingesetzt werden. Beide Verfahren erhöhen die Reinheit des Titanoxids deutlich. Die Summe der färbenden Ionen liegt in der Regel unter 200 ppm beim Sulfatverfahren, hauptsächlich Niob, untergeordnet Eisen, und weniger als 50 ppm beim Chloridverfahren, Niob und Eisen. |
||
Bei der industriellen Herstellung von Titanoxid aus [[Ilmenit]] nach dem Sulfatverfahren entsteht [[Dünnsäure]] (verdünnte Schwefelsäure), die meist nach Aufkonzentration für den Ilmenit-[[Aufschluss (Chemie)|Aufschluss]] wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder [[Verklappung|verklappt]]. Die Gewinnung nach dem [[Chloridverfahren]], vorwiegend aus Rutil-Erz oder TiO<sub>2</sub>-Schlacke, lässt dagegen keine Dünnsäure entstehen. Das verwendete [[Chlor]] bleibt weitgehend im Prozesskreislauf. Die in beiden Verfahren entstehenden Eisensalze werden unter anderem zur Chromat-Reduktion in Zementen, Abwasserbehandlung und in Biogas-Anlagen eingesetzt. |
Bei der industriellen Herstellung von Titanoxid aus [[Ilmenit]] nach dem Sulfatverfahren entsteht [[Dünnsäure]] (verdünnte Schwefelsäure), die meist nach Aufkonzentration für den Ilmenit-[[Aufschluss (Chemie)|Aufschluss]] wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder [[Verklappung|verklappt]]. Die Gewinnung nach dem [[Chloridverfahren]], vorwiegend aus Rutil-Erz oder TiO<sub>2</sub>-Schlacke, lässt dagegen keine Dünnsäure entstehen. Das verwendete [[Chlor]] bleibt weitgehend im Prozesskreislauf. Die in beiden Verfahren entstehenden Eisensalze werden unter anderem zur Chromat-Reduktion in Zementen, Abwasserbehandlung und in Biogas-Anlagen eingesetzt. |
||
=== Einkristalle === |
=== Einkristalle === |
||
[[ |
[[Datei:Rutile single Crystal.jpg|thumb|Einkristalline Rutil-Probe aus einen Verneuil-Kristall]] |
||
Rutil-Einkristalle werden in der Regel nach dem [[Verneuil-Verfahren]] hergestellt und in der Optik aufgrund der hohen Brechzahlen als Koppelprismen oder auch Diamantimitationen eingesetzt. |
Rutil-Einkristalle werden in der Regel nach dem [[Verneuil-Verfahren]] hergestellt und in der Optik aufgrund der hohen Brechzahlen als Koppelprismen oder auch Diamantimitationen eingesetzt.<ref>[http://www.djeva.com/documents/brochuredjevade.pdf Firma Djeva] Broschüre über die Züchtung nach dem Verneuil-Verfahren (deutsch, 4,2 MB PDF).</ref> Vereinzelt wird auch das Zonenschmelz-Verfahren eingesetzt, während das Czochralki-Verfahren als ungeeignet beschrieben wird.<ref>Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, „Floating zone growth and characterization of aluminum-doped rutile single crystals“, Journal of Crystal Growth, 163, 1996, S. 279–284; {{DOI|10.1016/0022-0248(95)00972-8}}.</ref><ref>H. Machida und T. Fukuda: „Difficulties encountered during the Czochralski growth of TiO<sub>2</sub> single crystals“, Journal of Crystal Growth, 112, 1991, S. 835–837; {{DOI|10.1016/0022-0248(91)90142-R}}.</ref> |
||
Die Herstellung von Anatas-Einkristallen kann nicht aus der Schmelze erfolgen. Hier werden [[Chemische_Transportreaktion|CTR]]-Verfahren eingesetzt. |
Die Herstellung von Anatas-Einkristallen kann nicht aus der Schmelze erfolgen. Hier werden [[Chemische_Transportreaktion|CTR]]-Verfahren eingesetzt.<ref>T. Sekiya und S. Kurita, „Defects in Anatase Titanium Dioxide“, Nano- and Micromaterials-Advances in Materials Research, 2008, Volume 9, S. 121–141, {{DOI|10.1007/978-3-540-74557-0_4}}.</ref> |
||
== Eigenschaften == |
== Eigenschaften == |
||
[[Datei:Titanium(IV) oxide.jpg|thumb|left|Titan(IV)-oxid]] |
[[Datei:Titanium(IV) oxide.jpg|thumb|left|Titan(IV)-oxid]] |
||
| ⚫ | |||
Der Schmelzpunkt von Titandioxid liegt bei 1855 °C, die Verbindung ist thermisch stabil. Titandioxid ist außerdem chemisch [[inert]]. Es ist lichtbeständig, preiswert, bisherigen Untersuchungen zufolge ungiftig und daher das bedeutendste Weißpigment und auch für Lebensmittel zugelassen (E171). |
Der Schmelzpunkt von Titandioxid liegt bei 1855 °C, die Verbindung ist thermisch stabil. Titandioxid ist außerdem chemisch [[inert]]. Es ist lichtbeständig, preiswert, bisherigen Untersuchungen zufolge ungiftig und daher das bedeutendste Weißpigment und auch für Lebensmittel zugelassen (E171). |
||
| ⚫ | |||
==== Weitere Modifikationen ==== |
==== Weitere Modifikationen ==== |
||
| Zeile 100: | Zeile 98: | ||
| |
| |
||
|- |
|- |
||
| [[Baddeleyit]]-ähnliche Struktur, (7-fach koordiniertes Ti)<ref>{{cite journal|author = Sato H. , Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K|title = Baddeleyite-Type High-Pressure Phase of TiO<sub>2</sub>|year = 1991|journal = Science|volume = 251|issue = 4995|pages = 786–788|doi = 10.1126/science.251.4995.786|pmid = 17775458 |
| [[Baddeleyit]]-ähnliche Struktur, (7-fach koordiniertes Ti)<ref>{{cite journal|author = Sato H. , Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K|title = Baddeleyite-Type High-Pressure Phase of TiO<sub>2</sub>|year = 1991|journal = Science|volume = 251|issue = 4995|pages = 786–788|doi = 10.1126/science.251.4995.786|pmid = 17775458}}</ref> |
||
|[[monoklin]] |
|[[monoklin]] |
||
| |
| |
||
| Zeile 112: | Zeile 110: | ||
| P > 40 GPa, T > 1600 °C |
| P > 40 GPa, T > 1600 °C |
||
|- |
|- |
||
| TiO<sub>2</sub> -OII, [[Cotunnit]]([[bleichlorid|PbCl<sub>2</sub>]])-ähnliche Struktur <ref name=du1>{{cite journal|author = Dubrovinsky L. S., Dubrovinskaia N. A., Swamy V., Muscat J., Harrison N. M., Ahuja R., Holm B., Johansson B.|title = Materials science: The hardest known oxide|year = 2001|journal = Nature|volume = 410|pages = 653–654|doi = 10.1038/35070650|pmid = 11287944|last1 = Dubrovinsky|first1 = LS|last2 = Dubrovinskaia|first2 = NA|last3 = Swamy|first3 = V|last4 = Muscat|first4 = J|last5 = Harrison|first5 = NM|last6 = Ahuja|first6 = R|last7 = Holm|first7 = B|last8 = Johansson|first8 = B|issue = 6829 |
| TiO<sub>2</sub> -OII, [[Cotunnit]]([[bleichlorid|PbCl<sub>2</sub>]])-ähnliche Struktur <ref name=du1>{{cite journal|author = Dubrovinsky L. S., Dubrovinskaia N. A., Swamy V., Muscat J., Harrison N. M., Ahuja R., Holm B., Johansson B.|title = Materials science: The hardest known oxide|year = 2001|journal = Nature|volume = 410|pages = 653–654|doi = 10.1038/35070650|pmid = 11287944|last1 = Dubrovinsky|first1 = LS|last2 = Dubrovinskaia|first2 = NA|last3 = Swamy|first3 = V|last4 = Muscat|first4 = J|last5 = Harrison|first5 = NM|last6 = Ahuja|first6 = R|last7 = Holm|first7 = B|last8 = Johansson|first8 = B|issue = 6829}}</ref> |
||
|[[orthorhombisch]] |
|[[orthorhombisch]] |
||
|P > 40 GPa, T > 700 °C |
| P > 40 GPa, T > 700 °C |
||
|} |
|} |
||
==== Optische Eigenschaften ==== |
==== Optische Eigenschaften ==== |
||
Die [[Brechungsindex|Brechungsindizes]] sind sehr hoch, jedoch abhängig von der Kristallmodifikation des Titandioxids und der [[Brechungsindex#Wellenlängenabhängigkeit|Wellenlänge]] des Lichts ([[Dispersion (Physik)|Optische Dispersion]]). Dabei erzeugt der [[Ordentlicher Strahl#Ordentlicher_und_außerordentlicher Strahl|ordentliche Strahl]] des Rutil die höchste Brechzahl bei einer Doppelbrechung Δn=0.29. [[ |
Die [[Brechungsindex|Brechungsindizes]] sind sehr hoch, jedoch abhängig von der Kristallmodifikation des Titandioxids und der [[Brechungsindex#Wellenlängenabhängigkeit|Wellenlänge]] des Lichts ([[Dispersion (Physik)|Optische Dispersion]]). Dabei erzeugt der [[Ordentlicher Strahl#Ordentlicher_und_außerordentlicher Strahl|ordentliche Strahl]] des Rutil die höchste Brechzahl bei einer Doppelbrechung Δn=0.29. [[Datei:TiO2, Brechzahlen der Modifikationen.svg|thumb|Brechungsindizes der Modifikationen in Abhängigkeit von der Wellenlänge]] |
||
Aus [[Koloristik|koloristischer]] Sicht hat Titandioxid in Folge des hohen Brechungsindexes das höchste [[Deckvermögen]] aller [[Weiß]]pigmente und gleichzeitig ein hervorragendes [[Farbstärke#Aufhellvermögen|Aufhellvermögen]]. Das teilchengrößenabhängige Maximum des Deckvermögens von Rutil liegt bei einer [[Korngröße]] von etwa 200 nm bis 300 nm je nach Anwendung und Bezugsgröße, anzahlbezogene oder massenbezogene Größenverteilung.<ref>[http://www2.dupont.com/Titanium_Technologies/de_US/tech_info/literature/Plastics/PL_B_Polymers_Light_Science.pdf Fa. DuPont] „Polymere, Licht und die Wissenschaft von TiO<sub>2</sub> DuPont“ (1, |
Aus [[Koloristik|koloristischer]] Sicht hat Titandioxid in Folge des hohen Brechungsindexes das höchste [[Deckvermögen]] aller [[Weiß]]pigmente und gleichzeitig ein hervorragendes [[Farbstärke#Aufhellvermögen|Aufhellvermögen]]. Das teilchengrößenabhängige Maximum des Deckvermögens von Rutil liegt bei einer [[Korngröße]] von etwa 200 nm bis 300 nm je nach Anwendung und Bezugsgröße, anzahlbezogene oder massenbezogene Größenverteilung.<ref>[http://www2.dupont.com/Titanium_Technologies/de_US/tech_info/literature/Plastics/PL_B_Polymers_Light_Science.pdf Fa. DuPont] „Polymere, Licht und die Wissenschaft von TiO<sub>2</sub> DuPont“ (1,42 MB PDF).</ref><ref>[http://www.lrsm.upenn.edu/~frenchrh/download/9802erikthielephdthesis.pdf University of Pennsylvania] Dissertation E. Thiele (3,2 MB, engl. PDF).</ref><ref>J. Winkler: ''Titandioxid.'' Vincentz Network, Hannover 2003, ISBN 3-87870-738-X, S. 55.</ref> |
||
Titandioxid ist ein [[Halbleiter]], somit ist das [[Valenzband]] voll gefüllt und das Leitungsband unbesetzt. Die [[Bandlücke]] ist von der Modifikation abhängig. Lichtquanten mit einer Energie größer als die Bandlücke werden absorbiert. Auch UV-Licht kann ab der entsprechenden Wellenlänge absorbiert und so ein UV-Schutz hergestellt werden. Durch kurzwellige Lichteinstrahlung werden Elektronen aus dem Valenzband in das Leitungsband gehoben und hinterlassen ein [[Defektelektron|Loch]]. Die Größe der Bandlücke ist von der Kristallrichtung und zusätzlich im Bereich von [[Nanopartikel|nanopartikulärem]] Material von der Teilchengröße abhängig. |
Titandioxid ist ein [[Halbleiter]], somit ist das [[Valenzband]] voll gefüllt und das Leitungsband unbesetzt. Die [[Bandlücke]] ist von der Modifikation abhängig. Lichtquanten mit einer Energie größer als die Bandlücke werden absorbiert. Auch UV-Licht kann ab der entsprechenden Wellenlänge absorbiert und so ein UV-Schutz hergestellt werden. Durch kurzwellige Lichteinstrahlung werden Elektronen aus dem Valenzband in das Leitungsband gehoben und hinterlassen ein [[Defektelektron|Loch]]. Die Größe der Bandlücke ist von der Kristallrichtung und zusätzlich im Bereich von [[Nanopartikel|nanopartikulärem]] Material von der Teilchengröße abhängig. |
||
| Zeile 126: | Zeile 124: | ||
{| class="wikitable" |
{| class="wikitable" |
||
|- |
|- |
||
! Modifikation !! E<sub>G</sub> (eV) |
! Modifikation !! E<sub>G</sub> (eV)<ref>Michael Grätzel und Franqois P. Rotzinger, „The Influence of the Crystal Lattice Structure on the conduction Band Energy of Oxides of Titanium(IV)“, Chemical Physics Letters, Vol. 118, Nr. 5, 1985, S. 474–477.</ref>!! Wellenlänge (nm) !! interpolierter Brechungsindex, 589 nm<ref>T. Radhakrishnan, „The optical properties of Titanium Dioxide“, Proceedings Mathematical Sciences, Volume 35, Number 3 (1952), S. 117–125, {{DOI|10.1007/BF03172227}}.</ref> |
||
|- |
|- |
||
| Anatas || 3.23 || 385 || n<sub>e</sub>=2.489 n<sub>o</sub>=2.561 |
| Anatas || 3.23 || 385 || n<sub>e</sub>=2.489 n<sub>o</sub>=2.561 |
||
| Zeile 136: | Zeile 134: | ||
==== Dielektrische Eigenschaften ==== |
==== Dielektrische Eigenschaften ==== |
||
Titandioxid hat eine vergleichsweise hohe [[Permittivität|Dielektrizitätskonstante]]. Für Rutil liegt sie bei ε = 111 in der kristallographischen a-Richtung und ε = 257 entlang der c-Achse.<ref> |
Titandioxid hat eine vergleichsweise hohe [[Permittivität|Dielektrizitätskonstante]]. Für Rutil liegt sie bei ε = 111 in der kristallographischen a-Richtung und ε = 257 entlang der c-Achse.<ref>Bora Lee, Choong-ki Lee, Cheol Seong Hwang und Seungwu Han: [http://cmsl.snu.ac.kr/data/publication/TiO2-epsilon.pdf ''Influence of exchange-correlation functionals on dielectric properties of rutile TiO<sub>2</sub>''], in: ''Current Applied Physics'', Band 11 (2011), S293–S296 (engl. PDF).</ref> Andere Quellen nennen kleinere Werte<ref>Rebecca A. Parker [http://prola.aps.org/abstract/PR/v124/i6/p1719_1 „Static Dielectric Constant of Rutile (TiO<sub>2</sub>), 1.6-1060°K“], Phys. Rev. 124, 1961, S. 1719–1722.</ref>, wobei die Werte von Messparametern wie Frequenz und Temperatur abhängig sind. Anwendungen sind zum Beispiel [[High-k-Dielektrikum|High-k-Dielektrika]]. |
||
=== Chemische Eigenschaften === |
=== Chemische Eigenschaften === |
||
| Zeile 147: | Zeile 145: | ||
Titandioxid mit Partikelgrößen im Bereich von 200nm bis 300nm wird aufgrund des großen Brechzahlunterschieds zu den meisten organischen Stoffen als Pigment verwendet. Der Größenbereich ergibt sich aus der [[Mie-Streuung|Mie-Theorie]]. Die Partikelgröße beeinflusst zum einen die Deckkraft und zum anderen den Farbton, feinteiligere Pigmente erscheinen blaustichiger. Die wichtigsten Anwendungen sind mit rund 60 % Marktanteil Beschichtungsmaterialien und 25 % Polymer-Anwendungen. |
Titandioxid mit Partikelgrößen im Bereich von 200nm bis 300nm wird aufgrund des großen Brechzahlunterschieds zu den meisten organischen Stoffen als Pigment verwendet. Der Größenbereich ergibt sich aus der [[Mie-Streuung|Mie-Theorie]]. Die Partikelgröße beeinflusst zum einen die Deckkraft und zum anderen den Farbton, feinteiligere Pigmente erscheinen blaustichiger. Die wichtigsten Anwendungen sind mit rund 60 % Marktanteil Beschichtungsmaterialien und 25 % Polymer-Anwendungen. |
||
Reines Titandioxid kommt dabei ausser als E171 kaum zum Einsatz, da neben der UV-Schutzwirkung durch das TiO<sub>2</sub> lichtinduzierte chemische Radikal-Reaktionen stattfinden. Durch eine Funktionalisierung der Pigmentkörner wird dieser Effekt vermindert und gleichzeitig eine Verbesserung der Farbeigenschaften, in der Regel durch einfachere Dispergierung, erreicht.<ref>[http://www.kronostio2.com/khome.nsf/kompl.pdf Fa. KRONOS Titan] Einsatzgebiete von TiO<sub>2</sub></ref> |
Reines Titandioxid kommt dabei ausser als E171 kaum zum Einsatz, da neben der UV-Schutzwirkung durch das TiO<sub>2</sub> lichtinduzierte chemische Radikal-Reaktionen stattfinden. Durch eine Funktionalisierung der Pigmentkörner wird dieser Effekt vermindert und gleichzeitig eine Verbesserung der Farbeigenschaften, in der Regel durch einfachere Dispergierung, erreicht.<ref>[http://www.kronostio2.com/khome.nsf/kompl.pdf Fa. KRONOS Titan] Einsatzgebiete von TiO<sub>2</sub>.</ref> |
||
Einige Anwendungen, z.B. für Fasern oder Zementanwendungen, verwenden trotz der höheren photochemischen Aktivität Anatas-Pigmente, während die Mehrzahl der Anwendungen auf Rutil-Pigmente zurückgreift. |
Einige Anwendungen, z. B. für Fasern oder Zementanwendungen, verwenden trotz der höheren photochemischen Aktivität Anatas-Pigmente, während die Mehrzahl der Anwendungen auf Rutil-Pigmente zurückgreift. |
||
=== Photokatalysator === |
=== Photokatalysator === |
||
Viele Hersteller bieten Photokatalysatoren auf TiO<sub>2</sub>-Basis an. Dies sind in der Regel Anatase, Anatas-Rutil-Mischungen oder dotierte Titandioxide mit vielfältigen Anwendungsmöglichkeiten.<ref>[http://www.sachtleben.de/include/3_1_2_0_de.html Fa. Sachtleben], Hombikat UV 100</ref><ref>[https://www.aerosil.com/product/aerosil/de/effekte/photokatalyse/pages/default.aspx Evonik] Aerosil, Aeroxid P25</ref><ref>[http://www.kronosww.com/khome.nsf/Typen_D.pdf KRONOS Titan] Kronoclean Datenblatt</ref><ref>[http://mobile.nzz.ch/wissenschaft/pflastersteine_gegen_smog_1.13327963.html Neue Zürcher Zeitung] „Pflastersteine gegen Smog“, Übersichtsartikel, 16. November 2011</ref><ref>[http://www.photokatalyse.fraunhofer.de/content/dam/photokatalyse/de/documents/Biological%20efficiency%20measurements%20for%20photocatalysts.pdf Fraunhofer Allianz Photokatalyse] |
Viele Hersteller bieten Photokatalysatoren auf TiO<sub>2</sub>-Basis an. Dies sind in der Regel Anatase, Anatas-Rutil-Mischungen oder dotierte Titandioxide mit vielfältigen Anwendungsmöglichkeiten.<ref>[http://www.sachtleben.de/include/3_1_2_0_de.html Fa. Sachtleben], Hombikat UV 100.</ref><ref>[https://www.aerosil.com/product/aerosil/de/effekte/photokatalyse/pages/default.aspx Evonik] Aerosil, Aeroxid P25.</ref><ref>[http://www.kronosww.com/khome.nsf/Typen_D.pdf KRONOS Titan] Kronoclean Datenblatt.</ref><ref>[http://mobile.nzz.ch/wissenschaft/pflastersteine_gegen_smog_1.13327963.html Neue Zürcher Zeitung] „Pflastersteine gegen Smog“, Übersichtsartikel, 16. November 2011.</ref><ref>[http://www.photokatalyse.fraunhofer.de/content/dam/photokatalyse/de/documents/Biological%20efficiency%20measurements%20for%20photocatalysts.pdf Fraunhofer Allianz Photokatalyse], „Biological efficiency measurements for photocatalyst“ (engl. PDF).</ref> Die Photokatalyse ist eine [[heterogene Katalyse]], bei der unter UV-Beleuchtung gasförmige oder gelöste Stoffe per [[Radikale_(Chemie)|Radikalreaktion]] oder Ladungsträgerübergang an Titandioxid oder anderen Stoffen reagieren. Durch die Beleuchtung mit UV-Licht, dessen Energie größer als die Bandlücke ist, oder durch die weniger effiziente Anregung aus den Störstellen einer Dotierung werden freie Ladungsträger, Elektronen im [[Leitungsband]] und Löcher im [[Valenzband]], erzeugt. In der Regel [[Rekombination_(Physik)|rekombinieren]] diese Ladungsträgerpärchen sehr schnell, allerdings kann durch die Bandverbiegung im Bereich der Oberfläche eine Ladungsträgertrennung erfolgen. Diese reagieren in der Regel mit adsorbiertem Sauerstoff und Wasser zu Hydroxi- und Peroxi-Radiakalen.<ref>Tusnelda E. Doll: „Photochemischer und photokatalytischer Abbau von Carbamazepin, Clofibrinsäure, Iomeprol und Iopromid“, Dissertation, 2004 (PDF), [http://d-nb.info/1002433525/34 Deutsche Nationalbibliothek].</ref> In der Regel, außer bei direkten Ladungsübergängen zu Adsorbaten, reagieren die Radikale mit adsorbierten Organika. Die Reaktionspfade bis zur vollständigen Mineralisierung können sehr komplex sein und viele Photonenanregungen benötigen.<ref>Martin Lindner: „Optimierung der photokatalytischen Wasserreinigung mit Titandioxid: Festkörper- und Oberflächenstruktur des Photokatalysators“, Dissertation, [http://d-nb.info/954460030/34 Deutsche Nationalbibliothek].</ref> |
||
Bei der Außenanwendung, als Beispiel sei die [[Photokatalytische_Selbstreinigung|photokatalytische Selbstreinigung]] genannt, wird in der Regel der UV-Anteil des [[Sonnenspektrum|Sonnenlichts]] [[Air_Mass|ASTM 1.5]] von etwa 3 % ausgenutzt, maximal etwa 35 W/m<sup>2</sup>.<ref>[http://rredc.nrel.gov/solar/spectra/am1.5/ Renewable Resource Data Center] Sonnenlichtspektrum ASTM 1.5</ref> Allerdings liegt die Sonneneinstrahlung unter diesem Maximalwert und im Jahr 2011 in der BRD im Mittel 1134 kWh/m<sup>2</sup>, also 130 W/m<sup>2</sup> und entsprechend 4 W/m<sup>2</sup> UV-Strahlung.<ref>[http://www.dwd.de/bvbw/generator/DWDWWW/Content/Oeffentlichkeit/KU/KU1/KU12/Klimagutachten/Solarenergie/Globalkarten__entgeltfrei/Jahressummen/2011,templateId=raw,property=publicationFile.pdf/2011.pdf Deutscher Wetterdienst] Deutschland, Globalstrahlung 2011 (Karte als PDF)</ref> Innenanwendungen fallen meist ungünstiger aus, zum einen ist der UV-Anteil sehr gering oder bei dotierten Katalysatoren ist Reaktionsrate gering. Die Kenngrößen in der Photokatalayse sind verschieden definierte [[Quantenausbeute]]n, typische Werte können kaum angegeben werden, da sehr viele Paramater in die Katalyse eingehen, meist werden aber Größenordnungen von 1 Reaktion auf 1000 Photonen genannt. <ref>[https://eldorado.tu-dortmund.de/bitstream/2003/2444/1/ebbinghausunt.pdf TU Dortmund] Thorsten Ebbinghaus, „Kombinierter biologisch-photokatalytischerAbbau von umweltrelevanten Stickstoffverbindungen zur Reinigung von landwirtschaftlichen Abwässern mit bewachsenen Pflanzen-filtern und TiO<sub>2</sub>/UV“, Dissertation</ref><ref>[https://eldorado.tu-dortmund.de/bitstream/2003/2427/2/klare_sig.pdf TU Dortmund] Martin Klare |
Bei der Außenanwendung, als Beispiel sei die [[Photokatalytische_Selbstreinigung|photokatalytische Selbstreinigung]] genannt, wird in der Regel der UV-Anteil des [[Sonnenspektrum|Sonnenlichts]] [[Air_Mass|ASTM 1.5]] von etwa 3 % ausgenutzt, maximal etwa 35 W/m<sup>2</sup>.<ref>[http://rredc.nrel.gov/solar/spectra/am1.5/ Renewable Resource Data Center] Sonnenlichtspektrum ASTM 1.5.</ref> Allerdings liegt die Sonneneinstrahlung unter diesem Maximalwert und im Jahr 2011 in der BRD im Mittel 1134 kWh/m<sup>2</sup>, also 130 W/m<sup>2</sup> und entsprechend 4 W/m<sup>2</sup> UV-Strahlung.<ref>[http://www.dwd.de/bvbw/generator/DWDWWW/Content/Oeffentlichkeit/KU/KU1/KU12/Klimagutachten/Solarenergie/Globalkarten__entgeltfrei/Jahressummen/2011,templateId=raw,property=publicationFile.pdf/2011.pdf Deutscher Wetterdienst] Deutschland, Globalstrahlung 2011 (Karte als PDF).</ref> Innenanwendungen fallen meist ungünstiger aus, zum einen ist der UV-Anteil sehr gering oder bei dotierten Katalysatoren ist Reaktionsrate gering. Die Kenngrößen in der Photokatalayse sind verschieden definierte [[Quantenausbeute]]n, typische Werte können kaum angegeben werden, da sehr viele Paramater in die Katalyse eingehen, meist werden aber Größenordnungen von 1 Reaktion auf 1000 Photonen genannt. <ref>[https://eldorado.tu-dortmund.de/bitstream/2003/2444/1/ebbinghausunt.pdf TU Dortmund] Thorsten Ebbinghaus, „Kombinierter biologisch-photokatalytischerAbbau von umweltrelevanten Stickstoffverbindungen zur Reinigung von landwirtschaftlichen Abwässern mit bewachsenen Pflanzen-filtern und TiO<sub>2</sub>/UV“, Dissertation.</ref><ref>[https://eldorado.tu-dortmund.de/bitstream/2003/2427/2/klare_sig.pdf TU Dortmund] Martin Klare: „Möglichkeiten des photokatalytischen Abbaus umweltrelevanter Stickstoffverbindungen unter Einsatz von TiO<sub>2</sub>“, Dissertation (PDF).</ref> Ein weiteres Problem dabei ist, das die photokatalytischen Reaktionen keine Unterscheidung zwischen der organischen Bindermatrix und den Schadstoffen machen, ungeeignete Bindersysteme neigen daher zu einer frühen [[Kreidung]]. |
||
=== Sonstige Anwendungen === |
=== Sonstige Anwendungen === |
||
| Zeile 159: | Zeile 157: | ||
== Biologische Bedeutung == |
== Biologische Bedeutung == |
||
Titandioxid ist ungiftig. Eine biologische Bedeutung, siehe auch unter [[Titan_(Element)#Sicherheitshinweise|Titan]], ist bisher nicht bekannt. Sehr hohe Konzentrationen von [[Nanoteilchen|Nanopartikeln]], also Partikeln mit weniger als 100 nm, in der Lunge führen zu Immunreaktionen. <ref>[http://www.nanopartikel.info/files/content/dana/Dokumente/NanoCare/Publikationen/NanoCare_Broschuere.pdf Nanocare] Broschüre, Seite 11ff (deutsch, PDF)</ref> Die Immunreaktion wird mit der Möglichkeit eines entzündungsbasierten Krebsriskos diskutiert, wobei oftmals nanoparituklärem TiO<sub>2</sub> kleiner 100 nm getestet wird und pigmentärem TiO<sub>2</sub> größer 200 nm als Beispielanwendung und für die Produktionsmenge herangezogen wird. |
Titandioxid ist ungiftig. Eine biologische Bedeutung, siehe auch unter [[Titan_(Element)#Sicherheitshinweise|Titan]], ist bisher nicht bekannt. Sehr hohe Konzentrationen von [[Nanoteilchen|Nanopartikeln]], also Partikeln mit weniger als 100 nm, in der Lunge führen zu Immunreaktionen. <ref>[http://www.nanopartikel.info/files/content/dana/Dokumente/NanoCare/Publikationen/NanoCare_Broschuere.pdf Nanocare] Broschüre, Seite 11ff (deutsch, PDF).</ref> Die Immunreaktion wird mit der Möglichkeit eines entzündungsbasierten Krebsriskos diskutiert, wobei oftmals nanoparituklärem TiO<sub>2</sub> kleiner 100 nm getestet wird und pigmentärem TiO<sub>2</sub> größer 200 nm als Beispielanwendung und für die Produktionsmenge herangezogen wird.<ref>[http://www.pnas.org/content/107/45/19449.full.pdf+html PNAS.gov] Yazdi, A. S.; Guarda, G.; Riteau, N.; Drexler, S. K.; Tardivel, A.; Couillin, I.; Tschopp, J. (2010). „Nanoparticles activate the NLR pyrin domain containing 3 (Nlrp3) inflammasome and cause pulmonary inflammation through release of IL-1 and IL-1“. Proceedings of the National Academy of Sciences 107 (45): S. 19449–19454 {{DOI|10.1073/pnas.1008155107}}, {{PMC|2984140}}.</ref> In einer Gruppe aus 56 Personen, die selektiv aufgrund von Problemen mit Titan-Implantaten ausgewählt wurden, zeigten 21 Personen eine positive Reaktion in [[MELISA]]-Test mit TiO<sub>2</sub>, während alle 54 Personen der Gruppe die mittels [[Allergietest|Patch]]-Test getestet wurden, negativ getestet wurden. <ref>[http://www.biodenth.be/professionnel/Hypersensitivity-titanium.pdf Biodenth.be] K. Müller, E. Valentine-Thon, „Hypersensitivity to titanium: Clinical and laboratory evidence“ Neuroendocrinology Letters, Vol. 27, Suppl. 1, 2006, S. 31–35.</ref> |
||
== Nachweis == |
== Nachweis == |
||
[[ |
[[Datei:Titan-Peroxi-Komplex, 2cm Dicke.jpg|thumb|typische Färbung des Ti(IV)-Peroxi-Komplexes in schwefelsauerer Lösung]] |
||
In der Kälte frisch gefälltes Titandioxid ist [[amphoter]] und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O<sub>2</sub>)·aq]<sup>2+</sup>-Kation. |
In der Kälte frisch gefälltes Titandioxid ist [[amphoter]] und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O<sub>2</sub>)·aq]<sup>2+</sup>-Kation. |
||
Mit Salzsäure und Zink(granalie) bildet sich [[naszierender Wasserstoff]], der Ti(IV) zu rotviolettem [Ti(H<sub>2</sub>O)<sub>6</sub>]<sup>3+</sup> reduziert. |
Mit Salzsäure und Zink(granalie) bildet sich [[naszierender Wasserstoff]], der Ti(IV) zu rotviolettem [Ti(H<sub>2</sub>O)<sub>6</sub>]<sup>3+</sup> reduziert. |
||
<!-- == Siehe auch == --> |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
<references/> |
<references/> |
||
Version vom 15. Juli 2012, 14:27 Uhr
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
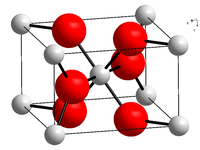
| |||||||
| Rutil __ Ti4+ __ O2− | |||||||
| Allgemeines | |||||||
| Name | Titan(IV)-oxid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | TiO2 | ||||||
| Kurzbeschreibung |
weißes, kristallines Pulver[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 79,90 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
Rutil 4,24 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
2900 °C[1] | ||||||
| Löslichkeit |
| ||||||
| Brechungsindex |
optisch anisotrop, doppelbrechend oder zweiachsig | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||
Titan(IV)-oxid (Titandioxid) ist das IV-wertige Oxid des Titans. Neben diesem polymorphen Oxid gibt es eine Reihe an nichtstöchiometrischen Suboxiden des Titans, sogenannte Magneli-Phasen sowie das Ti(III)2O3 und Ti(II)O.[3]
Titandioxid hat als Weißpigment ein weites Einsatzgebiet, daher werden weltweit pro Jahr vier bis fünf Millionen Tonnen produziert.[4] Die Haupteinsatzgebiete liegen im Bereich der Beschichtungen wie Lacke und Anstriche, gefolgt von Kunststoffeinfärbungen. Auch farbige Produkte enthalten in der Regel Weißpigmente um eine hohe Deckkraft zu erreichen.
Geschichte
Nachdem Titan 1791 von William Gregor im Ilmenit entdeckt wurde, erkannte Heinrich Klaproth das Titanoxid im Rutil. Die industrielle Nutzung begann, als die hervorragende Eignung als weißes, ungiftiges Pigment 1908 in Norwegen und den USA erkannt wurde. Ab 1916 wurde das Pigment bereits unter der Bezeichnung Kronos Titan White kommerziell hergestellt. Bis 1938 wurde Titanweiß nur in der Anatas-Modifikation hergestellt, dann aber zunehmend in der Rutil-Modifikation, da deren photokatalytische Aktivität geringer und die Bewitterungsstabilität der daraus hergestellten Produkte entsprechend höher ist. Das Weißpigment auf der Basis der Rutil-Modifikation wird auch als Rutilweiß bezeichnet.
Mehr als die Hälfte der Produktionsmenge wird in Beschichtungsstoffen eingesetzt, gefolgt von Polymeren. 70 % der Weltproduktion werden von fünf Herstellern produziert, wobei neben dem Marktführer DuPont (USA) noch die Unternehmen Cristal Global (Saudi-Arabien), Huntsman (USA), Kronos (USA) und Tronox (USA) zu den weltweit größten Produzenten gezählt werden. Die Regionen, die am meisten Titandioxid verbrauchen, sind Nordamerika, Europa und China. Insgesamt wird jeweils ein Drittel in Europa-Afrika-Mittlerer Osten, Amerika und im pazifisch-asiatischen Bereich verbraucht.[5]
Vorkommen
Titan(IV)-oxid kommt in der Natur in drei Modifikationen vor:
- Rutil ist ein tetragonales Mineral von meist prismatischem Habitus. Die Kristallstruktur ordnet in der Raumgruppe 136, das entspricht dem Hermann-Mauguin-Symbol P42/mnm.[6] Das Rutil-TiO2 hat eine Dichte von 4,26 g/cm3. Der Name Rutil stammt vom lateinischen rutilus – rötlich, in Anspielung auf die durch Eisen-Verunreinigungen erzeugte Farbe.
- Anatas bildet tetragonale holoedrische Kristalle (holoedrisch bedeutet die höchstsymmetrische Gruppe innerhalb eines Kristallsystems) im tetragonalen damit 4/m 2/m 2/m. Es kristallisiert in der Raumgruppe 141, das heißt I41/amd[6]. Anatas wandelt sich bei 700 °C, abhängig von der Atmosphäre und Fremdionen, irreversibel in Rutil um. Die Dichte von Anatas beträgt 3,88 g/cm3.
- Brookit bildet orthorhombische Minerale und kristallisiert in der Raumgruppe 61, Pbca [6]. Auch Brookit geht unterhalb des Schmelzpunktes in Rutil über und hat eine Dichte von 4,12 g/cm3. Technisch hat der Brookit keine Bedeutung.
Gewinnung und Darstellung
Titandioxid kann im Labor durch Solvolyse (Hydrolyse) von Ti(IV)-Verbindungen hergestellt werden, z.B:
- Reaktion von Titanoxosulfat mit Wasser zu Titanoxohydrat und Schwefelsäure
- Reaktion von Titantetrachlorid mit Wasser im ersten Schritt zu Titanoxychlorid und Salzsäure und dann zu Titanoxohydrat und Salzsäure
oder Metallalkoholaten wie das Titan-tetraisopropylat:
- Titano-tetraisopropylat und Wasser reagieren zu Titandioxid und Isopropanol
Das so erhaltene Titanoxohydrat, formal TiO(OH)2 oder TiO2xH2O, wird durch Temperung in Anatas oder Rutil überführt. Die Verbrennung von TiCl4 mit Sauerstoff wird im Labormaßstab selten angewendet.
Da die Hauptmenge des technisch hergestellten TiO2 als Pigment verwendet wird, stören färbende Ionen wie Eisen. Als Erze werden für das Sulfatverfahren in der Regel Ilmenit (FeTiO3) oder titanhaltige Schlacken aus der Elektroreduktion des Ilmenits eingesetzt.[7] Diese Schlacke, genau wie Rutil aus alluvialen Lagerstätten, kann auch im technisch anspruchsvolleren Chloridverfahren eingesetzt werden. Beide Verfahren erhöhen die Reinheit des Titanoxids deutlich. Die Summe der färbenden Ionen liegt in der Regel unter 200 ppm beim Sulfatverfahren, hauptsächlich Niob, untergeordnet Eisen, und weniger als 50 ppm beim Chloridverfahren, Niob und Eisen.
Bei der industriellen Herstellung von Titanoxid aus Ilmenit nach dem Sulfatverfahren entsteht Dünnsäure (verdünnte Schwefelsäure), die meist nach Aufkonzentration für den Ilmenit-Aufschluss wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder verklappt. Die Gewinnung nach dem Chloridverfahren, vorwiegend aus Rutil-Erz oder TiO2-Schlacke, lässt dagegen keine Dünnsäure entstehen. Das verwendete Chlor bleibt weitgehend im Prozesskreislauf. Die in beiden Verfahren entstehenden Eisensalze werden unter anderem zur Chromat-Reduktion in Zementen, Abwasserbehandlung und in Biogas-Anlagen eingesetzt.
Einkristalle

Rutil-Einkristalle werden in der Regel nach dem Verneuil-Verfahren hergestellt und in der Optik aufgrund der hohen Brechzahlen als Koppelprismen oder auch Diamantimitationen eingesetzt.[8] Vereinzelt wird auch das Zonenschmelz-Verfahren eingesetzt, während das Czochralki-Verfahren als ungeeignet beschrieben wird.[9][10]
Die Herstellung von Anatas-Einkristallen kann nicht aus der Schmelze erfolgen. Hier werden CTR-Verfahren eingesetzt.[11]
Eigenschaften

Physikalische Eigenschaften
Der Schmelzpunkt von Titandioxid liegt bei 1855 °C, die Verbindung ist thermisch stabil. Titandioxid ist außerdem chemisch inert. Es ist lichtbeständig, preiswert, bisherigen Untersuchungen zufolge ungiftig und daher das bedeutendste Weißpigment und auch für Lebensmittel zugelassen (E171).
Weitere Modifikationen
Neben den drei natürlichen Modifikationen sind acht synthetisch hergestellte Modifikationen bekannt, davon sind drei metastabil (monoklin, tetragonal and orthorombhisch) und fünf Hochdruckmodifikationen (α-PbO2-, Baddeleyit-, Cotunnit- sowie orthorhombische und kubische Strukturen). Die Modifikation mit Cotunnit-Struktur wurde von L. Dubrovinsky et. al. als härtestes bekanntes Oxid mit einer Härte nach Vickers von 38 GPa und einem Kompressionsmodul von 431 GPa (zum Vergleich: Diamant hat 442 GPa bis 446 GPa) unter Normaldruck beschrieben.[12] Spätere Studien kamen zu anderen Ergebnissen mit tieferen Werten für die Härte 7–20 GPa, somit weicher als Oxide wie Korund Al2O3 und Rutil.[13] und das Kompressionsmodul (~300 GPa).[14][15]
| Modifikation | Kristallsystem | Herstellung |
|---|---|---|
| TiO2(B)[16] | monoklin | Hydrolyse von K2Ti4O9 mit nachfolgender Temperung |
| TiO2(H), Hollandit-ähnliche Struktur form[17] | tetragonal | Oxidation der Kaliumtitanat-Bronze, K0.25TiO2 |
| TiO2(R), Ramsdellit-ähnliche Struktur [18] | orthorhombisch | Oxidation der Lithiumtitanat-Bronze Li0.5TiO2 |
| TiO2(II)-(α-PbO2-ähnliche Struktur)[19] | orthorhombisch | |
| Baddeleyit-ähnliche Struktur, (7-fach koordiniertes Ti)[20] | monoklin | |
| TiO2 -OI[21] | orthorhombisch | |
| kubische Struktur[22] | kubisch | P > 40 GPa, T > 1600 °C |
| TiO2 -OII, Cotunnit(PbCl2)-ähnliche Struktur [12] | orthorhombisch | P > 40 GPa, T > 700 °C |
Optische Eigenschaften
Die Brechungsindizes sind sehr hoch, jedoch abhängig von der Kristallmodifikation des Titandioxids und der Wellenlänge des Lichts (Optische Dispersion). Dabei erzeugt der ordentliche Strahl des Rutil die höchste Brechzahl bei einer Doppelbrechung Δn=0.29.

Aus koloristischer Sicht hat Titandioxid in Folge des hohen Brechungsindexes das höchste Deckvermögen aller Weißpigmente und gleichzeitig ein hervorragendes Aufhellvermögen. Das teilchengrößenabhängige Maximum des Deckvermögens von Rutil liegt bei einer Korngröße von etwa 200 nm bis 300 nm je nach Anwendung und Bezugsgröße, anzahlbezogene oder massenbezogene Größenverteilung.[23][24][25]
Titandioxid ist ein Halbleiter, somit ist das Valenzband voll gefüllt und das Leitungsband unbesetzt. Die Bandlücke ist von der Modifikation abhängig. Lichtquanten mit einer Energie größer als die Bandlücke werden absorbiert. Auch UV-Licht kann ab der entsprechenden Wellenlänge absorbiert und so ein UV-Schutz hergestellt werden. Durch kurzwellige Lichteinstrahlung werden Elektronen aus dem Valenzband in das Leitungsband gehoben und hinterlassen ein Loch. Die Größe der Bandlücke ist von der Kristallrichtung und zusätzlich im Bereich von nanopartikulärem Material von der Teilchengröße abhängig.
| Modifikation | EG (eV)[26] | Wellenlänge (nm) | interpolierter Brechungsindex, 589 nm[27] |
|---|---|---|---|
| Anatas | 3.23 | 385 | ne=2.489 no=2.561 |
| Brookit | 3.14 | 395 | nα=2.585 nβ=2.583 nγ=2.702 |
| Rutil | 3.02 | 410 | ne=2.900 no=2.613 |
Dielektrische Eigenschaften
Titandioxid hat eine vergleichsweise hohe Dielektrizitätskonstante. Für Rutil liegt sie bei ε = 111 in der kristallographischen a-Richtung und ε = 257 entlang der c-Achse.[28] Andere Quellen nennen kleinere Werte[29], wobei die Werte von Messparametern wie Frequenz und Temperatur abhängig sind. Anwendungen sind zum Beispiel High-k-Dielektrika.
Chemische Eigenschaften
Von den Titanoxiden ist das Titan(IV)-dioxid die häufigste Verbindung. Es ist chemisch inert und kann nur in heißer Schwefelsäure, Flussssäure und heißen Laugen gelöst werden. Es ist teilweise Ausgangsmaterial für die Herstellung von Titanaten. Bei Beleuchtung mit UV-Licht können photokatalytische Radikalreaktionen stattfinden.
Verwendung
Titandioxid findet überwiegend als weißes Pigment Verwendung und ist im Colour Index unter C.I. Pigment White 6 bzw. C.I. 77891 aufgeführt. Es ist chemisch stabil, ungiftig und unter der Kennzeichnung E 171 als Lebensmittelzusatzstoff beispielsweise in Zahnpasta, Kaugummis und Hustenbonbons anzutreffen, sowie unter CI 77891 als Pigment in Kosmetika. Auch in der Ölmalerei findet es teilweise Verwendung. Im technischen Bereich findet es Verwendung in Farben und Lacken, Textilien, bei der Papierherstellung zur Erzielung eines hohen Weißgrades sowie als UV-Blocker in Sonnencremes und Aufheller in Arzneimitteln (Tabletten).
Pigment
Titandioxid mit Partikelgrößen im Bereich von 200nm bis 300nm wird aufgrund des großen Brechzahlunterschieds zu den meisten organischen Stoffen als Pigment verwendet. Der Größenbereich ergibt sich aus der Mie-Theorie. Die Partikelgröße beeinflusst zum einen die Deckkraft und zum anderen den Farbton, feinteiligere Pigmente erscheinen blaustichiger. Die wichtigsten Anwendungen sind mit rund 60 % Marktanteil Beschichtungsmaterialien und 25 % Polymer-Anwendungen.
Reines Titandioxid kommt dabei ausser als E171 kaum zum Einsatz, da neben der UV-Schutzwirkung durch das TiO2 lichtinduzierte chemische Radikal-Reaktionen stattfinden. Durch eine Funktionalisierung der Pigmentkörner wird dieser Effekt vermindert und gleichzeitig eine Verbesserung der Farbeigenschaften, in der Regel durch einfachere Dispergierung, erreicht.[30] Einige Anwendungen, z. B. für Fasern oder Zementanwendungen, verwenden trotz der höheren photochemischen Aktivität Anatas-Pigmente, während die Mehrzahl der Anwendungen auf Rutil-Pigmente zurückgreift.
Photokatalysator
Viele Hersteller bieten Photokatalysatoren auf TiO2-Basis an. Dies sind in der Regel Anatase, Anatas-Rutil-Mischungen oder dotierte Titandioxide mit vielfältigen Anwendungsmöglichkeiten.[31][32][33][34][35] Die Photokatalyse ist eine heterogene Katalyse, bei der unter UV-Beleuchtung gasförmige oder gelöste Stoffe per Radikalreaktion oder Ladungsträgerübergang an Titandioxid oder anderen Stoffen reagieren. Durch die Beleuchtung mit UV-Licht, dessen Energie größer als die Bandlücke ist, oder durch die weniger effiziente Anregung aus den Störstellen einer Dotierung werden freie Ladungsträger, Elektronen im Leitungsband und Löcher im Valenzband, erzeugt. In der Regel rekombinieren diese Ladungsträgerpärchen sehr schnell, allerdings kann durch die Bandverbiegung im Bereich der Oberfläche eine Ladungsträgertrennung erfolgen. Diese reagieren in der Regel mit adsorbiertem Sauerstoff und Wasser zu Hydroxi- und Peroxi-Radiakalen.[36] In der Regel, außer bei direkten Ladungsübergängen zu Adsorbaten, reagieren die Radikale mit adsorbierten Organika. Die Reaktionspfade bis zur vollständigen Mineralisierung können sehr komplex sein und viele Photonenanregungen benötigen.[37]
Bei der Außenanwendung, als Beispiel sei die photokatalytische Selbstreinigung genannt, wird in der Regel der UV-Anteil des Sonnenlichts ASTM 1.5 von etwa 3 % ausgenutzt, maximal etwa 35 W/m2.[38] Allerdings liegt die Sonneneinstrahlung unter diesem Maximalwert und im Jahr 2011 in der BRD im Mittel 1134 kWh/m2, also 130 W/m2 und entsprechend 4 W/m2 UV-Strahlung.[39] Innenanwendungen fallen meist ungünstiger aus, zum einen ist der UV-Anteil sehr gering oder bei dotierten Katalysatoren ist Reaktionsrate gering. Die Kenngrößen in der Photokatalayse sind verschieden definierte Quantenausbeuten, typische Werte können kaum angegeben werden, da sehr viele Paramater in die Katalyse eingehen, meist werden aber Größenordnungen von 1 Reaktion auf 1000 Photonen genannt. [40][41] Ein weiteres Problem dabei ist, das die photokatalytischen Reaktionen keine Unterscheidung zwischen der organischen Bindermatrix und den Schadstoffen machen, ungeeignete Bindersysteme neigen daher zu einer frühen Kreidung.
Sonstige Anwendungen
Bei der Herstellung spezieller optischer Gläser wird TiO2 zur Beeinflussung der optischen Dispersion, Abbezahl, eingesetzt. Titandioxid in der Anatas-Modifikation ist Hauptbestandteil der Katalysatoren, die für die industrielle Entstickung von Rauchgasen nach dem SCR-Verfahren eingesetzt werden. Auf den Halbleitereigenschaften des Titandioxids basiert die Farbstoffsolarzelle (Grätzel-Zelle). Mit Hilfe von Titandioxid gelang die Herstellung von Memristoren.[42] Titandioxid wird ebenfalls als Hauptbestandteil des Keramik-Dielektrikums in Klasse-1-Keramikkondensatoren eingesetzt.
Biologische Bedeutung
Titandioxid ist ungiftig. Eine biologische Bedeutung, siehe auch unter Titan, ist bisher nicht bekannt. Sehr hohe Konzentrationen von Nanopartikeln, also Partikeln mit weniger als 100 nm, in der Lunge führen zu Immunreaktionen. [43] Die Immunreaktion wird mit der Möglichkeit eines entzündungsbasierten Krebsriskos diskutiert, wobei oftmals nanoparituklärem TiO2 kleiner 100 nm getestet wird und pigmentärem TiO2 größer 200 nm als Beispielanwendung und für die Produktionsmenge herangezogen wird.[44] In einer Gruppe aus 56 Personen, die selektiv aufgrund von Problemen mit Titan-Implantaten ausgewählt wurden, zeigten 21 Personen eine positive Reaktion in MELISA-Test mit TiO2, während alle 54 Personen der Gruppe die mittels Patch-Test getestet wurden, negativ getestet wurden. [45]
Nachweis

In der Kälte frisch gefälltes Titandioxid ist amphoter und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O2)·aq]2+-Kation. Mit Salzsäure und Zink(granalie) bildet sich naszierender Wasserstoff, der Ti(IV) zu rotviolettem [Ti(H2O)6]3+ reduziert.
Einzelnachweise
- ↑ a b c d e Eintrag zu Titan(IV)-oxid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ Univ. Freiburg Vorlesungsscript Chemie, Oxide Teil 4: Nichtstöchiometrische binäre Oxide.
- ↑ United States Geological Survey USGS TITANIUM MINERAL CONCENTRATES (engl. PDF).
- ↑ T. Brock, M. Groteklaes, P. Mischke; Lehrbuch der Lacktechnologie; 2. Auflage; Vincentz Network; Hannover; 2000; ISBN 3-87870-569-7; S. 123.
- ↑ a b c Kristallstruktur-Datenbank des Center for Computational Materials Science des U.S. Naval Research Laboratory.
- ↑ Pyrometallurgy South Africa Eletro Smelting of Ilmenite for Production of TiO2 Slag.
- ↑ Firma Djeva Broschüre über die Züchtung nach dem Verneuil-Verfahren (deutsch, 4,2 MB PDF).
- ↑ Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, „Floating zone growth and characterization of aluminum-doped rutile single crystals“, Journal of Crystal Growth, 163, 1996, S. 279–284; doi:10.1016/0022-0248(95)00972-8.
- ↑ H. Machida und T. Fukuda: „Difficulties encountered during the Czochralski growth of TiO2 single crystals“, Journal of Crystal Growth, 112, 1991, S. 835–837; doi:10.1016/0022-0248(91)90142-R.
- ↑ T. Sekiya und S. Kurita, „Defects in Anatase Titanium Dioxide“, Nano- and Micromaterials-Advances in Materials Research, 2008, Volume 9, S. 121–141, doi:10.1007/978-3-540-74557-0_4.
- ↑ a b LS Dubrovinsky, NA Dubrovinskaia, V Swamy, J Muscat, NM Harrison, R Ahuja, B Holm, B Johansson: Materials science: The hardest known oxide. In: Nature. 410. Jahrgang, Nr. 6829, 2001, S. 653–654, doi:10.1038/35070650, PMID 11287944.
- ↑ Oganov A.R., Lyakhov A.O.: Towards the theory of hardness of materials. In: J. of Superhard Materials. 32. Jahrgang, Nr. 3, 2010, S. 143–147, doi:10.3103/S1063457610030019.
- ↑ Y. Al-Khatatbeh, K. K. M. Lee and B. Kiefer: High-pressure behavior of TiO2 as determined by experiment and theory. In: Phys. Rev. B. 79. Jahrgang, Nr. 13, 2009, S. 134114, doi:10.1103/PhysRevB.79.134114.
- ↑ Nishio-Hamane D., Shimizu A., Nakahira R., Niwa K., Sano-Furukawa A., Okada T., Yagi T., Kikegawa T.: The stability and equation of state for the cotunnite phase of TiO2 up to 70 GPa. In: Phys. Chem. Minerals. 37. Jahrgang, Nr. 3, 2010, S. 129–136, doi:10.1007/s00269-009-0316-0.
- ↑ Marchand R., Brohan L., Tournoux M.: A new form of titanium dioxide and the potassium octatitanate K2Ti8O17. In: Materials Research Bulletin. 15. Jahrgang, Nr. 8, 1980, S. 1129–1133, doi:10.1016/0025-5408(80)90076-8.
- ↑ Latroche, M, Brohan, L, Marchand, R, Tournoux,: New hollandite oxides: TiO2(H) and K0.06TiO2. In: Journal of Solid State Chemistry. 81. Jahrgang, Nr. 1, 1989, S. 78–82, doi:10.1016/0022-4596(89)90204-1.
- ↑ J. Akimoto, Y. Gotoh, Y. Oosawa, N. Nonose, T. Kumagai, K. Aoki, H. Takei: Topotactic Oxidation of Ramsdellite-Type Li0.5TiO2, a New Polymorph of Titanium Dioxide: TiO2(R). In: Journal of Solid State Chemistry. 113. Jahrgang, Nr. 1, 1994, S. 27–36, doi:10.1006/jssc.1994.1337.
- ↑ P. Y. Simons, F. Dachille: The structure of TiO2II, a high-pressure phase of TiO2. In: Acta Crystallographica. 23. Jahrgang, Nr. 2, 1967, S. 334–336, doi:10.1107/S0365110X67002713.
- ↑ Sato H. , Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K: Baddeleyite-Type High-Pressure Phase of TiO2. In: Science. 251. Jahrgang, Nr. 4995, 1991, S. 786–788, doi:10.1126/science.251.4995.786, PMID 17775458.
- ↑ Dubrovinskaia N A, Dubrovinsky L S., Ahuja R, Prokopenko V B., Dmitriev V., Weber H.-P., Osorio-Guillen J. M., Johansson B: Experimental and Theoretical Identification of a New High-Pressure TiO2 Polymorph. In: Phys. Rev. Lett. 87. Jahrgang, 27 Pt 1, 2001, S. 275501, doi:10.1103/PhysRevLett.87.275501, PMID 11800890.
- ↑ Mattesini M, de Almeida J. S., Dubrovinsky L., Dubrovinskaia L, Johansson B., Ahuja R.: High-pressure and high-temperature synthesis of the cubic TiO2 polymorph. In: Phys. Rev. B. 70. Jahrgang, Nr. 21, 2004, S. 212101, doi:10.1103/PhysRevB.70.212101.
- ↑ Fa. DuPont „Polymere, Licht und die Wissenschaft von TiO2 DuPont“ (1,42 MB PDF).
- ↑ University of Pennsylvania Dissertation E. Thiele (3,2 MB, engl. PDF).
- ↑ J. Winkler: Titandioxid. Vincentz Network, Hannover 2003, ISBN 3-87870-738-X, S. 55.
- ↑ Michael Grätzel und Franqois P. Rotzinger, „The Influence of the Crystal Lattice Structure on the conduction Band Energy of Oxides of Titanium(IV)“, Chemical Physics Letters, Vol. 118, Nr. 5, 1985, S. 474–477.
- ↑ T. Radhakrishnan, „The optical properties of Titanium Dioxide“, Proceedings Mathematical Sciences, Volume 35, Number 3 (1952), S. 117–125, doi:10.1007/BF03172227.
- ↑ Bora Lee, Choong-ki Lee, Cheol Seong Hwang und Seungwu Han: Influence of exchange-correlation functionals on dielectric properties of rutile TiO2, in: Current Applied Physics, Band 11 (2011), S293–S296 (engl. PDF).
- ↑ Rebecca A. Parker „Static Dielectric Constant of Rutile (TiO2), 1.6-1060°K“, Phys. Rev. 124, 1961, S. 1719–1722.
- ↑ Fa. KRONOS Titan Einsatzgebiete von TiO2.
- ↑ Fa. Sachtleben, Hombikat UV 100.
- ↑ Evonik Aerosil, Aeroxid P25.
- ↑ KRONOS Titan Kronoclean Datenblatt.
- ↑ Neue Zürcher Zeitung „Pflastersteine gegen Smog“, Übersichtsartikel, 16. November 2011.
- ↑ Fraunhofer Allianz Photokatalyse, „Biological efficiency measurements for photocatalyst“ (engl. PDF).
- ↑ Tusnelda E. Doll: „Photochemischer und photokatalytischer Abbau von Carbamazepin, Clofibrinsäure, Iomeprol und Iopromid“, Dissertation, 2004 (PDF), Deutsche Nationalbibliothek.
- ↑ Martin Lindner: „Optimierung der photokatalytischen Wasserreinigung mit Titandioxid: Festkörper- und Oberflächenstruktur des Photokatalysators“, Dissertation, Deutsche Nationalbibliothek.
- ↑ Renewable Resource Data Center Sonnenlichtspektrum ASTM 1.5.
- ↑ Deutscher Wetterdienst Deutschland, Globalstrahlung 2011 (Karte als PDF).
- ↑ TU Dortmund Thorsten Ebbinghaus, „Kombinierter biologisch-photokatalytischerAbbau von umweltrelevanten Stickstoffverbindungen zur Reinigung von landwirtschaftlichen Abwässern mit bewachsenen Pflanzen-filtern und TiO2/UV“, Dissertation.
- ↑ TU Dortmund Martin Klare: „Möglichkeiten des photokatalytischen Abbaus umweltrelevanter Stickstoffverbindungen unter Einsatz von TiO2“, Dissertation (PDF).
- ↑ Kevin bullis: Neuverdrahtung der Elektronik. Technology Review. 8. Mai 2008, abgerufen am 25. März 2010.
- ↑ Nanocare Broschüre, Seite 11ff (deutsch, PDF).
- ↑ PNAS.gov Yazdi, A. S.; Guarda, G.; Riteau, N.; Drexler, S. K.; Tardivel, A.; Couillin, I.; Tschopp, J. (2010). „Nanoparticles activate the NLR pyrin domain containing 3 (Nlrp3) inflammasome and cause pulmonary inflammation through release of IL-1 and IL-1“. Proceedings of the National Academy of Sciences 107 (45): S. 19449–19454 doi:10.1073/pnas.1008155107, PMC 2984140 (freier Volltext).
- ↑ Biodenth.be K. Müller, E. Valentine-Thon, „Hypersensitivity to titanium: Clinical and laboratory evidence“ Neuroendocrinology Letters, Vol. 27, Suppl. 1, 2006, S. 31–35.
Weblinks
- Zusatzstoffe-Online.de: Titandioxid
- Photokatalytische Selbstreinigung am Beispiel der Abwasseraufbereitung Dissertation: Physikalisch-chemische Untersuchungen zur Mineralisierung pharmazeutischer Wirkstoffe an Titandioxid (PDF-Datei; 11,46 MB)


