Dihydrotestosteron
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
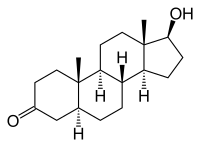
| |||||||||
| Allgemeines | |||||||||
| Freiname | Androstanolon | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C19H30O2 | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Arzneistoffangaben | |||||||||
| ATC-Code | |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 290,44 g·mol−1 | ||||||||
| Aggregatzustand |
fest | ||||||||
| Schmelzpunkt | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Dihydrotestosteron (DHT), genauer 5α-Dihydrotestosteron, auch Androstanolon (INN), ist ein biologisch aktiver Metabolit des Hormons Testosteron. Es ist ein C-19-Steroid und zählt zu den Androgenen, einer Klasse von Sexualhormonen.
Physiologie
DHT wird im Körper durch das Enzym 5α-Reduktase aus Testosteron gebildet. DHT ist die biologisch aktivste Form des Testosterons. In vielen Organen ist DHT das eigentlich wirksame Androgen.
Testosteron selbst ist ein Prohormon für zwei Hormone: DHT und Estradiol. DHT ist ein reines Androgen, da es nicht zu Estradiol aromatisiert werden kann.[2] Auch wenn Testosteron und DHT über den gleichen Rezeptor wirken, so ist ihre Wirkung dennoch unterschiedlich. Während Testosteron die Differenzierung der Wolffschen Gänge induziert, ist Dihydrotestosteron für die äußerliche Virilisierung und auch für das Wachstum und die Differenzierung der Prostata verantwortlich.[3] Über die Blutbahn gelangt das Testosteron in die androgenabhängigen Zellen. Intrazellulär bindet das Hormon entweder direkt an den Androgenrezeptor oder wird durch die 5α-Reduktase zu dem biologisch noch wirksameren DHT metabolisiert, das dann seine Wirkung ebenfalls über den Androgenrezeptor entfaltet. Der Hormon-Rezeptor-Komplex gelangt in den Zellkern und bindet dort an spezifische Hormone Response Elemente (HRE) in der Promoter-Region androgenregulierter Gene. Dabei kontrolliert dieser Komplex so die Aktivität und die spezifische Zellantwort dieser Gene.[3]
Im weiblichen Organismus
Bei der Frau entsteht DHT aus Testosteron und Androstendion. Nur etwa 1 % des DHT zirkuliert frei, während der überwiegende Teil fest an Sexualhormon-bindendes Globulin (SHBG) gebunden ist. DHT wird durch Reduktion zu 17-Ketosteroiden inaktiviert und über den Urin ausgeschieden.[2] Die Bildungsorte der weiblichen Androgene (C-19 Steroide) sind die Thekazellen (der äußeren Zellschicht um einen Follikel) in den Ovarien und Bereiche der Nebennierenrinde. Das hormonell wirksamste Androgen am Steroidrezeptor stellt das DHT dar, weniger wirksam sind das Dehydroepiandrosteron (DHEA) und das Dehydroepiandrosteronsulfat (DHEAS). Das aus dem DHEA mittels des Enzyms 3β-Hydroxysteroid-Dehydrogenase entstehende schwach wirksame Androstendion entstammt ebenfalls größtenteils, zu etwa 90 % aus den Thekazellen, die restlichen 10 % werden in den peripheren Geweben aus dem DHEA umgewandelt.[4] Das Androstendion stellt aber einen Präkursor für die weibliche Testosteron-Synthese dar. Diese Synthese bzw. Freisetzung in den weiblichen Gonaden wird durch das Luteinisierendes Hormon (LH) des Hypophysenvorderlappen (Endokrine Kaskaden: Hypothalamisch-Hypophysäre Achsen) nach dessen Stimulation durch das Releasing-Hormon Gonadoliberin (GnRH) rückgekoppelt geregelt, hingegen in der Nebennierenrinde durch das Adrenocorticotropin (ACTH).
Die im (adulten) weiblichen Organismus gebildeten Androsterone dienen zumeist als Vorstufe (Präkusor) der Östrogensynthese (C-17 Steroide). Das Sexualhormon-bindendes Globulin (SHBG) ist das spezifische Transportprotein für Sexualhormone, wobei nur das nicht-gebundene, „freie“ DHT seine physiologische Wirkung zeigt. Da einige weitere biologisch aktive Moleküle um die Bindungsstellen auf dem SHBG konkurrieren können eine Schwangerschaft, aber auch Thyroxin zu einer Spiegelveränderung etwa des DHT oder anderer Androgene führen.
Im männlichen Organismus
Kleine Mengen DHT werden bei Männern auch direkt in den Hoden gebildet. Dihydrotestosteron ist die erst in den Zielzellen gebildete Wirkform des Testosterons. Entwicklung und Funktion von Prostata und Bläschendrüsen, Körperbehaarung männlichen Typs, Bartwuchs, die Funktion der Talgdrüsen, aber auch die Abnahme der Kopfbehaarung bei genetischer Disposition sind Prozesse, die vom DHT gesteuert werden.[2] Ist die Umwandlung von Testosteron zu Dihydrotestosteron (DHT), welches für die Maskulinisierung der externen Genitalanlage notwendig ist, gestört, was bei genotypischen männlichen Individuen zu verschiedenen Formen der genitalen Fehlbildungen führen. Denn das DHT ermöglicht die männliche Entwicklung des äußeren Genitales. Aus dem Sinus urogenitalis entstehen der Penis und das Scrotum.
Funktion und Nebenwirkungen
(siehe Hauptartikel Testosteron (C-19 Steroid))
Funktion und Nebenwirkungen von DHT entsprechen denen seines Prohormons Testosteron.
Diagnostik
Die Diagnostik von DHT ist für folgende Indikationen gegeben:[2]
- Beurteilung und Verlaufskontrolle Pseudohermaphroditismus
- Verdacht auf genetischen 5α-Reduktase-Mangel
- Therapiekontrolle von 5α-Reduktase-Hemmern (Finasterid, Dutasterid), beispielsweise bei der Behandlung der benignen Prostatahyperplasie (BPH) oder Prostatakrebs
- Androgenisierungserscheinungen bei der Frau, wie zum Beispiel Hirsutismus, Virilisierung, Alopezie
Niedrige DHT-Konzentrationen
Niedrige DHT-Spiegel finden sich beispielsweise bei:[2]
- Pseudohermaphroditismus masculinus
- 5α-Reduktase-Mangel
- Klinefelter-Syndrom
- Primärem und sekundärem Hypogonadismus
- Erektile Dysfunktion (Impotenz)
- Leberzirrhose
- Estrogentherapie
- Therapie mit 5α-Reduktase-Hemmern wie Finasterid und Dutasterid
Erhöhte DHT-Konzentrationen
Hohe DHT-Spiegel können vorliegen bei:[2]
- Chronischen Anovulationssyndromen, wie beispielsweise dem PCO-Syndrom
- Hirsutismus
- Pubertas praecox
- Angeborene Nebennierenrinden-Hyperplasie
- Nebennierenrinden-Tumoren, Hodentumoren, Ovarialtumoren
Bei jungen Männern liegt der DHT-Spiegel bei etwa 10 % des Gesamt-Testosteronspiegels.[2] Ein erhöhter Testosteron-/DHT-Quotient nach HCG-Stimulation (HCG-Test, Leydig-Zell-Funktionstest) weist auf einen 5α-Reduktase-Mangel hin.[2]
Prostatahyperplasie
DHT stimuliert das Wachstum der Prostata. Wird die Funktion von DHT gehemmt, so führt dies zu einer Verkleinerung der Prostata. Diese Therapieform wird häufig bei der benignen (gutartigen) Prostatahyperplasie (BPH) eingesetzt. Dazu werden 5α-Reduktase-Hemmer mit den Wirkstoffen Finasterid oder Dutasterid oral eingenommen.[2]
Androgenetische Alopezie („Haarausfall“)
(siehe auch Hauptartikel Haarausfall)
Die androgenetische Alopezie (AGA), auch als erblich bedingter Haarausfall bezeichnet, ist bei Männern sehr weit verbreitet. Sie bezeichnet die genetisch bedingte Empfindlichkeit der Haarwurzeln gegenüber dem Hormon DHT. Die Empfindlichkeit der Haarwurzeln betrifft nur die Haare am Oberkopf, bei der die Haarfollikel durch DHT geschädigt und geschwächt werden.[5]
Doping
Der prozentuale Anteil der Anwender von Dihydrotestosteron im Bodybuilding ist in den letzten Jahren stark angestiegen. Immer mehr Bodybuilder verwenden DHT, um ihren Androgenspiegel weit über das natürliche Limit zu bringen. Was einerseits großen Muskelwachstum bewirkt, bringt zusätzlich diverse Nebenwirkungen mit sich. Herzrhythmusstörungen, Leber- und Nierentumorbildung, Arteriosklerose sowie Gynäkomastie (Anschwellen der Brustdrüsen beim Mann) sind nur einige der Nebenwirkungen, die bei Verwendung von DHT auftreten können. Bei den weiblichen Sportlerinnen kann die Körperbehaarung (Hirsutismus) im Gesichtsbereich zunehmen, es kann ebenfalls zur Steroidakne kommen, Haarverlust mit Glatzenbildung werden begünstigt, es kann sich ferner eine (permanent) tiefe Stimme einstellen und es ist eine (permanent) Klitorisgrößenveränderung möglich, ebenfalls sind Zyklusstörungen, Brustgrößeveränderungen nachgewiesen und bei Schwangeren ist mit Störung der Fetalentwicklung zu rechnen.
Literatur
- O. Hiort et al.: Androgenresistenzsyndrome – Klinische und molekulare Grundlagen. In: Deutsches Ärzteblatt, 96/1999, S.A-686/B-560/C-527.
- A. Kjellman et al.: Is dihydrotestosteron a prognostic factor among men with screening-detected prostate cancer? In: European Urology Supplements, 5/2006, S. 319.
- R. Paus: Therapeutic strategies for treating hair loss. In: Drug Discovery Today: Therapeutic Strategies, 3/2006, S. 101–110.
Weblinks
- KEGG: Dihydrotestosteron
- Eintrag zu Dihydrotestosteron in der DrugBank der University of Alberta
Einzelnachweise
- ↑ a b c d Datenblatt 5α-Androstan-17β-ol-3-one bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ a b c d e f g h i Endokrinologikum.com: Dihydrotestosteron, abgerufen am 7. August 2007.
- ↑ a b Genetikzentrum: Prostatakarzinom-Risikoanalyse, abgerufen am 8. August 2007.
- ↑ Thomas Weyerstahl, Manfred Stauber: Duale Reihe Gynäkologie und Geburtshilfe. Georg Thieme Verlag, Stuttgart 2013, ISBN 3-1315-2604-1, S. 100–102
- ↑ bnw-natur.com: Hormoneller Haarausfall, abgerufen am 8. August 2007.