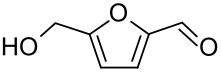
Hydroxymethylfurfural
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Hydroxymethylfurfural | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H6O3 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 126,11 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,21 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
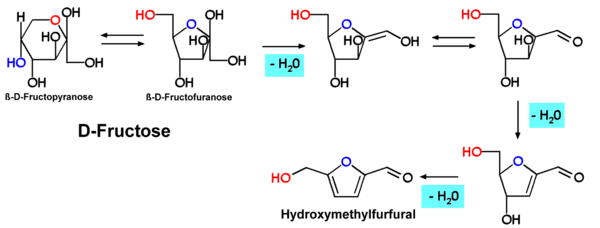
Hydroxymethylfurfural, HMF oder 5-(Hydroxymethyl)furfural, auch 5-Oxymethylfurfurol, ist eine Aldehyd- und Furanverbindung, die sich bei der thermischen Zersetzung von Zucker oder Kohlenhydraten bildet. HMF kann in vielen mit Hitze behandelten Lebensmitteln einschließlich Milch, Fruchtsaft, alkoholischen Getränken, Honig usw. nachgewiesen werden. Aktuelle Studien prüfen den Nachweis von HMF in Zigaretten. HMF kann zur Modifizierung bei der Kunststoffherstellung eingesetzt werden. Hexosen, insbesondere Fructose, bilden durch eine mehrfache (säurekatalysierte) Dehydratisierung das HMF.
Geschichte
Die organische Verbindung wurde 1912 von dem französischen Chemiker Louis Maillard im Rahmen seiner Forschungsarbeit über nicht enzymatische Reaktionen von Glucose und Lysin untersucht.
Synthese
Die Bildung von Hydroxymethylfurfural wurde erstmals im Verlauf einer Karamellisierung von Hexosen (z. B. Fructose, Maltose, Glucose) beobachtet. Der Bildungsmechanismus entspricht dem bei Pentosen zu Furfural führenden Schema.
Im Jahre 2007 haben US-Chemiker um Conrad Zhang vom Institut für Oberflächenkatalyse in Richland (US-Staat Washington) im US-Fachjournal Science ein Verfahren vorgestellt, mit dem sie aus Glucose Produkte herstellten, die bisher vor allem auf Erdölbasis produziert werden.
Auch polymere Zucker wie Stärke oder Cellulose zeigen diese Reaktion. Es ist bekannt, dass sich Hexosen durch die Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung ineinander umwandeln können. Beim Rösten von Zichorienwurzel zur Herstellung von Ersatzkaffee wird Inulin teilweise zu Hydroxymethylfurfural umgewandelt, das für das kaffeeähnliche Aroma sorgt.[3]
In einer einstufigen Synthese kann Cellulose in Gegenwart von gekoppelten Kupfer(II)-chlorid/Chrom(II)-chlorid-Katalysatoren in der ionischen Flüssigkeit 1-Ethyl-3-methylimidazoliumchlorid als Lösungsmittel bei 80–120 °C zu 5-Hydroxymethylfurfural (HMF) umgesetzt werden.[4][5] Unter diesen Bedingungen verläuft die Synthese etwa zehnmal schneller als bei einer herkömmlichen säurekatalysierten Hydrolyse.
HMF in Honig
Eine geringe Menge an HMF im Honig ist ein Indikator für dessen Frische und Naturbelassenheit. Ein hoher HMF-Wert weist auf länger anhaltende Erwärmung oder Lagerung hin. Wenn Honig erhitzt wird, bildet sich aus Fruchtzucker HMF. Der HMF-Gehalt in frisch geschleudertem Honig ist sehr gering und steigt bei korrekter Lagerung, je nach pH-Wert und Lagertemperatur um ca. 2–3 mg/kg pro Jahr an. Lagerung bei Zimmertemperatur (21 °C) kann den HMF-Gehalt in einem Jahr bereits auf 20 mg/kg erhöhen. Die EU hat einen HMF-Grenzwert von maximal 40 mg/kg für Honig, der unter europäischen Bedingungen produziert wurde, festgelegt. Einige nationale Imkerverbände fordern sogar noch niedrigere Werte, z. B. erlaubt der Deutsche Imkerbund höchstens 15 mg/kg für sein Gütesiegel „Echter Deutscher Honig“.
HMF im Honig wird meistens mittels Hochleistungsflüssigkeitschromatographie oder dem sogenannten Winkler-Verfahren[6] nachgewiesen. Seit 2009 ist ein Schnelltest von der Merck KGaA zur Bestimmung von HMF erhältlich. Bei dem „Reflectoquant® HMF“ genannten Test wird eine geringe Menge Honig im Verhältnis 1:4 mit destilliertem Wasser verdünnt, ein Teststreifen in die Probe getaucht und dann in einem RQflex-Reflektometer gemessen.
Mögliche Karzinogenität
Das amerikanische National Institute of Environmental Health Sciences gibt für HMF ein hohes Risiko, dass es krebserregend sein könnte, an. Grund dafür ist, dass andere Mitglieder dieser Gruppe von Verbindungen krebserregende Eigenschaften zeigen. Untersuchungen über die Schädlichkeit von HMF selbst sind bisher jedoch nur in geringem Umfang durchgeführt worden.
Die Vermutung der karzinogenen Eigenschaften von 5-HMF stammt aus älteren wissenschaftlichen Untersuchungen. Es ist bekannt, dass eine ähnliche Verbindung, nämlich 5-Sulfooxymethylfurfural, mutagen und kanzerogen ist.[7]
In Untersuchungen diverser Substanzen im Hinblick auf krebsvorbeugende Eigenschaften konnte für 5-HMF keine solche Wirkung nachgewiesen werden.[8][9]
Die mögliche Fehlinterpretation der kanzerogenen Eigenschaft soll darauf beruhen, dass 5-HMF erst seit einigen Jahren als Reinsubstanz (>99 %) isoliert werden kann. Reinstes 5-HMF ist ein farbloses Pulver.
Einzelnachweise
- ↑ a b c d e Datenblatt Hydroxymethylfurfural bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt 5-(Hydroxymethyl)-furan-2-carbaldehyd bei Merck
- ↑ Ben-Erik van Wyck: Food Plants of the World Timber Press, 2006, ISBN 0-88192-743-0. S. 134.
- ↑ Y. Su, H. M. Brown, X. Huang, X. Zhou, J. E. Amonette, Z. C. Zhang: Single-step conversion of cellulose to 5-hydroxymethylfurfural (HMF), a versatile platform chemical. In: Appl. Catalysis. A 361, 2009, S. 117–122. doi:10.1016/j.apcata.2009.04.002.
- ↑ Zusammenfassung in: Chem. Ing. Techn.. 81, 2009, S. 679.
- ↑ DIN 10751-1:2010-08: Untersuchung von Honig – Bestimmung des Gehaltes an Hydroxymethylfurfural – Teil 1: Photometrisches Verfahren nach Winkler.
- ↑ Y. J. LinksSurh, A. Liem, J. A. Miller, S. R. Tannenbaum: 5-Sulfooxymethylfurfural as a possible ultimate mutagenic and carcinogenic metabolite of the Maillard reaction product, 5-hydroxymethylfurfural. In: Carcinogenesis. 15, Nr. 10, 1994, S. 2375–2377.
- ↑ H. Xiao, K. L. Parkin: Isolation and identification of potential cancer chemopreventive agents from methanolic extracts of green onion (Allium cepa). In: Phytochemistry. 68, Nr. 7, 2007, S. 1059–1067.
- ↑ H. Xiao, K. L. Parkin: Induction of phase II enzyme activity by various selenium compounds. In: Nutrition and Cancer. 55. Nr. 2, 2006, S. 210–223. doi:10.1207/s15327914nc5502_13.