1-Phenylethanol
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
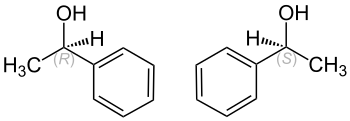
| ||||||||||
| (R)-Form (links) und (S)-Form (rechts) | ||||||||||
| Allgemeines | ||||||||||
| Name | 1-Phenylethanol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C8H10O | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwach blumigem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 122,17 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
1,01 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
204 °C[2] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Brechungsindex |
1,527 (20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
1-Phenylethanol ist eine chemische Verbindung aus der Gruppe der Alkohole und strukturisomer zu 2-Phenylethanol.
Vorkommen
1-Phenylethanol kommt natürlich als Bestandteil des Aromas von Heidelbeeren vor.[4]
Gewinnung und Darstellung
Racemisches 1-Phenylethanol kann durch Reduktion von Acetophenon (z. B. mit Lithiumaluminiumhydrid[5]), durch Reaktion von Methylmagnesiumchlorid mit Benzaldehyd oder durch Oxidation von Ethylbenzol gewonnen werden.[1] Es entsteht auch bei der Hydrolyse von (S)-1-Bromethylbenzol, wobei ebenfalls das Racemat aus (S)- und (R)-1-Phenylethanol erhalten wird.[6]
Es gibt auch gezielte Synthesen für (S)- oder (R)-1-Phenylethanol, die mit hoher Enantioselektivität verlaufen. Die enantioselektive Reduktion von Acetophenon[7] ist dabei die Methoden der Wahl. Jeweils kommen dabei enantioselektive Katalysatoren zum Einsatz.
Eigenschaften
1-Phenylethanol ist eine wenig flüchtige, schwer entzündbare, farblose Flüssigkeit mit schwach blumigem Geruch, die wenig löslich in Wasser ist.[1][2] Mit einer sauren Lösung von Natriumdichromat reagiert es zu Benzoesäure.[8]
Verwendung
1-Phenylethanol wird als Hochsieder in Beschichtungsstoffen verwendet.[2] Es wird auch zur Produktion von Styrol eingesetzt.[9]
Sicherheitshinweise/Toxikologie
1-Phenylethanol wurde 2017 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 1-Phenylethanol waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern und weit verbreiteter Verwendung sowie der möglichen Gefahren durch krebsauslösende und mutagene Eigenschaften. Die Neubewertung läuft seit 2019 und wird von Italien durchgeführt.[10]
Einzelnachweise
- ↑ a b c d Eintrag zu ' in der Hazardous Substances Data Bank (via PubChem)
- ↑ a b c d e f g h i j Eintrag zu 1-Phenylethanol in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Datenblatt 1-Phenylethanol, 98% bei Sigma-Aldrich (PDF).
- ↑ Ralf G. Berger: Flavours and Fragrances. Springer, 2007, ISBN 3-540-49339-5, S. 164 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Joachim Buddrus: Grundlagen Der Organischen Chemie. Walter de Gruyter, 2011, ISBN 3-11-024894-8, S. 509 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie. John Wiley & Sons, 2011, ISBN 3-527-32754-1, S. 282 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Sabine Wallbaum und Jürgen Martens: Asymmetric Syntheses with Chiral Oxazaborolidines, In: Tetrahedron: Asymmetry 1992, 3, 1475–1504, DOI:10.1016/S0957-4166(00)86044-9.
- ↑ Paula Yurkanis Bruice: Organische Chemie: Studieren kompakt. Pearson Deutschland GmbH, 2011, ISBN 3-86894-102-9, S. 611 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ von Hans-Georg Elias: Makromoleküle: Band 3: Industrielle Polymere und Synthesen - Hans-Georg Elias. John Wiley & Sons, 2009, ISBN 3-527-62652-2, S. 203 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 1-phenylethanol
