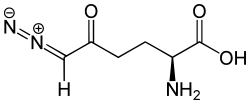
6-Diazo-5-oxo-L-norleucin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 6-Diazo-5-oxo-L-norleucin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H9N3O3 | ||||||||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 171,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
6-Diazo-5-oxo-L-norleucin (L-DON) ist eine nicht-proteinogene Aminosäure, die als Analogon von Glutamin fungiert. Es gehört zu den Diazoverbindungen. L-DON wurde 1956 aus Bakterien der Gattung Streptomyces isoliert und erstmals beschrieben sowie als mögliches Chemotherapeutikum zur Behandlung von Krebs vorgeschlagen.[1] In verschiedenen Tierversuchen wurde eine antitumorale Wirkung bestätigt.[4] In klinischen Studien wurde DON als Chemotherapeutikum gegen Krebs getestet, aber nie zugelassen. Die bisher letzte klinische Studie zu DON wurde 2008 veröffentlicht, hier wurde es in Kombination mit einer Glutaminase verabreicht.[5] Im Jahr 2021 wurde der Biosyntheseweg von DON aufgeklärt und es wurde festgestellt, dass DON durch drei Enzyme aus L-Lysin biosynthetisiert wird. In dieser Studie wurde auch die heterologe Produktion der acetylierten Form von DON erfolgreich erreicht.[6]
Chemie[Bearbeiten | Quelltext bearbeiten]
DON ist ein gelbliches Pulver, das gut wasserlöslich ist, es löst sich aber auch in wässrigen Lösungen von Methanol, Aceton oder Ethanol, allerdings nur schlecht in absoluten Alkoholen. Lösungen von mindestens 50 µM DON in 0,9 % Kochsalzlösung erscheinen leicht gelblich. In kristalliner Form bilden sich gelblich grüne Nadeln. Die spezifische Rotation ist [α]D26= +21° (c = 5,4 % in H2O). In Phosphatpuffer bei pH 7 liegen die ultravioletten Absorptionsmaxima bei 274 nm (E1%1cm. 683) und 244 nm (E1%1cm 376).[1][7]
Biochemie[Bearbeiten | Quelltext bearbeiten]
DON findet eine breite Verwendung als Inhibitor verschiedener Glutamin umsetzender Enzyme. Aufgrund seiner Ähnlichkeit mit Glutamin findet es Zugang zu den katalytischen Zentren dieser Enzyme und blockiert es durch kovalente Bindung bzw. Alkylierung.[8][9] In der folgenden Tabelle sind einige Enzyme aufgeführt, die durch DON inhibiert werden.
|
Wirkmechanismus[Bearbeiten | Quelltext bearbeiten]
DON wirkt als Zellgift inhibierend auf viele Schlüsselenzyme der Nukleotid-Synthese. Unter Zugabe von DON wurde in verschiedenen Krebszelllinien Apoptose (programmierter Zelltod) ausgelöst. Verschiedene Gründe wurden untersucht, der genaue Mechanismus jedoch nicht endgültig geklärt. Zum einen wurde die innere mitochondriale Membran durch DON-Gabe beschädigt,[15] des Weiteren konnten Einzelstrangbrüche in der DNA nachgewiesen werden.[16]
Pharmakologie[Bearbeiten | Quelltext bearbeiten]
DON ist nicht als Arzneimittel zugelassen, wird aber in klinischen Studien in Kombination mit einer Glutaminase für den Einsatz als Chemotherapeutikum gegen Krebs getestet.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c H. W. Dion et al.: 6-diazo-5-oxo-L-norleucine, A new tumor inhibitory substance. II: Isolation and Characterization. In: Antibiotics and Chemotherapy, Vol 78, 1954, 3075–3077.
- ↑ a b c Datenblatt 6-Diazo-5-oxo-L-norleucine bei Sigma-Aldrich, abgerufen am 18. März 2011 (PDF).
- ↑ D. A. Cooney, H. N. Jayaram, H. A. Milman et al.: DON, CONV and DONV-III. Pharmacologic and toxicologic studies. In: Biochem. Pharmacol. Band 25, Nr. 16, August 1976, S. 1859–1870, doi:10.1016/0006-2952(76)90190-8, PMID 9092.
- ↑ K. Yoshioka et al.: Glutamine antagonist with diet deficient in glutamine and aspartate reduce tumor growth. In: Tokushima J Exp Med. 39 (1-2), Jun 1992, S. 69–76. PMID 1412455.
- ↑ a b C. Mueller, S. Al-Batran, E. Jaeger, B. Schmidt, M. Bausch, C. Unger, N. Sethuraman: A phase IIa study of PEGylated glutaminase (PEG-PGA) plus 6-diazo-5-oxo-L-norleucine (DON) in patients with advanced refractory solid tumors. In: Journal of Clinical Oncology. 26, 2008, S. 2533, doi:10.1200/jco.2008.26.15_suppl.2533.
- ↑ Seiji Kawai, Yuko Sugaya, Ryota Hagihara, Hiroya Tomita, Yohei Katsuyama: Complete biosynthetic pathway of alazopeptin, a tripeptide con-sisting of two molecules of 6-diazo-5-oxo-L-norleucine and one molecule of alanine. In: Angewandte Chemie International Edition. Band 60, 2021, S. 10319, doi:10.1002/anie.202100462.
- ↑ H. A. DeWald und A. M. Moore: 6-Diazo-5-oxo-L-norleucine, a new tumor-inhibitory substance. Preparation of L (D and L)-forms, in Am. Chem. Soc. Meeting, Dallas, 1956, S. 13.
- ↑ a b c d e f g h i L. M. Pinkus et al.: Glutamine binding sites. In: Methods Enzymol, 1977, Vol. 46, 414–427.
- ↑ E. Ortlund et al.: Reactions of Pseudomonas 7A glutaminase-asparaginase with diazo analogues of glutamine and asparagine result in unexpected covalent inhibitions and suggests an unusual catalytic triad Thr-Tyr-Glu. In: Biochem (2000) 39: 1199–1104. doi:10.1021/bi991797d
- ↑ a b M. Eidinoff et al.: Pyrimidine Studies, I. Effect of DON (6-Diazo-5Oxo-L-Norleucine) on incorporation of precursors into nucleic acid pyrimidines (PDF; 867 kB), 1957.
- ↑ B. Levenberg et al.: Biosynthesis of the purines, XV. The effect of Aza-L-Serine and 6-Diazo-5-Oxo-L-Norleucine on inosinic acid biosynthesis de novo (PDF; 830 kB). In: J Biol Chem (1956): 163–176.
- ↑ a b c G. S. Ahluwalia et al.: Metabolism and action of amino acid analog anti-cancer agents. In: Pharmacol Ther (1990) 46: 243–271. PMID 2108451.
- ↑ R. K. Barclay et al.: Effects of 6-Diazo-5-Oxo-L-Norleucine and other tumor inhibitors on biosynthesis of nicotinamide adenine dinucleotide in mice. In: Cancer Research (1966) 26: 282–286.
- ↑ R. J. Rosenbluth et al.: DON, CONV and DONV-II. Inhibition of L-Asparagine Synthetase in Vivo. In: Biochemical Pharmacology, Vol. 25, 1851–1858. doi:10.1016/0006-2952(76)90189-1.
- ↑ F. Wu et al.: A mechanism behind the antitumor effect of 6-diazo-5-oxo-L-norleucine (DON): disruption of mitochondria. Eur J Cancer. 35(7), Jul 1999, S. 1155–1161. doi:10.1016/S0959-8049(99)00099-4.
- ↑ K. Hiramoto et al.: DNA strand cleavage by tumor-inhibiting antibiotic 6-diazo-5-oxo-L-norleucine. Mutat Res. 360(2), 10. Jun 1996, S. 95–100. doi:10.1016/0165-1161(95)00073-9.