Diglycolsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Diglycolsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6O5 | |||||||||||||||
| Kurzbeschreibung |
weiße[1] oder hellgelbe[2] geruchlose Flocken oder kristallines Pulver | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser (417 g·l−1[1]), in Wasser bei 0 °C (209 g·l−1[3]), in Wasser bei 25 °C (715 g·l−1[3]), löslich in Ethanol[3], wenig löslich in Diethylether[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Diglycolsäure ist eine aliphatische Dicarbonsäure bzw. die einfachste Oxadisäure, deren Acidität zwischen der von Essigsäure und Oxalsäure liegt.[4] Sie entsteht bei der Oxidation von Diethylenglycol DEG im Organismus und kann zu schweren Komplikationen mit tödlichem Ausgang führen.[5]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Bereits in den 1860er Jahren wurde von A. Wurtz[6] die Herstellung von Diglycolsäure durch Oxidation von Diethylenglycol mit konzentrierter Salpetersäure beschrieben.
Parallel dazu wurde von W. Heintz die Synthese aus Monochloressigsäure durch Erhitzen mit Natronlauge berichtet.[7]
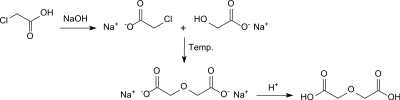
In einer Variante mit Bariumhydroxid-Lösung als alkalisches Medium wird nach dem Ansäuern Diglycolsäure in 68%iger Ausbeute erhalten.[8]
Die Ausbeuten der beschriebenen Reaktionen sind für eine Nutzung im technischen Maßstab unbefriedigend. So liefert der einstufige Salpetersäureprozess auch in Gegenwart eines Oxidationskatalysators (Vanadium(V)-oxid) nur Ausbeuten an Diglycolsäure von 58–60 %.[9] In einem mehrstufigen Prozess der Salpetersäureoxidation bei 70 °C und mehrfachem Auskristallisieren, Eindampfen der Überstände und Rückführung der DEG-haltigen Mutterlauge können Produktausbeuten von bis zu 99 % (bezogen auf DEG) erzielt werden.[10]
Die Oxidation von DEG mit Luft, Sauerstoff oder Ozon vermeidet die Verwendung der teuren Salpetersäure und das unvermeidliche Entstehen nitroser Gase.[11] In Gegenwart eines Platin-Katalysators können bei der Luftoxidation von DEG Ausbeuten von 90 % erhalten werden.[12]
An einem Bismut-Platin-Kontakt sollen unter optimierten Reaktionsbedingungen Ausbeuten von 95 % erzielt werden.[13]
Auch die Oxidation von 1,4-Dioxan-2-on (p-Dioxanon), einem als Comonomer in bioabbaubaren Polyestern eingesetzten Lacton mit Salpetersäure oder Distickstofftetroxid mit Ausbeuten bis 75 % ist in einer Patentschrift[14] beschrieben.

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Diglycolsäure ist sehr gut wasserlöslich und kristallisiert aus Wasser in monoklinen Prismen als weißer, geruchsloser Feststoff. Bei einer Luftfeuchtigkeit über 72 % und 25 °C entsteht das Monohydrat. Das kommerzielle Produkt ist die wasserfreie Form als freifließende Schuppen.[3]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Diester der Diglycolsäure mit (verzweigten) höheren Alkoholen können als Weichmacher für Polyvinylchlorid (PVC) mit vergleichbaren Eigenschaften wie Di-n-octylphthalat (DOP) Verwendung finden.[15]
Basische Lösungen von Diglycolsäure werden zur Entfernung von Kalkablagerungen bei Gas- und Ölbohrungen sowie in Anlageteilen wie Wärmetauschern oder Dampfkesseln beschrieben.[16]
Diglycolsäure kann als Diesterkomponente in homo- und copolymeren Polyestern, sog. Polyalkylendiglycolaten fungieren.

die bioverträglich und bioabbaubare sind und allein oder in Blends mit aliphatischen Polyestern als Gewebekleber, Knorpelersatz oder als Implantatmaterial eingesetzt werden können.[17]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt Diglycolsäure zur Synthese bei Merck, abgerufen am 1. März 2015.
- ↑ a b c d e Datenblatt Diglykolsäure bei Sigma-Aldrich, abgerufen am 1. März 2015 (PDF).
- ↑ a b c d e f g h W.M. Bruner, L.T. Sherwood, Jr.: Diglycolic acid – a new commercial dibasic acid. In: Ind. Eng. Chem. Band 41, Nr. 8, 1949, S. 1653–1656, doi:10.1021/ie50476a032.
- ↑ L. Bhattacharyya, J. Rohrer (Hrsg.): Appendix 1: DISSOCIATION CONSTANTS (pKa) OF ORGANIC ACIDS (AT 20 °C), in Applications of Ion Chromatography for Pharmaceutical and Biological Products. John Wiley & Sons, Inc., 2012, doi:10.1002/9781118147009.app1.
- ↑ A.A. Roscher, E. Jussek, T. Noguchi, S. Franklin: Fatal Accidental Diglycolic Acid Intoxication. In: Bull. Soc. Pharm. Environ. Pathol. Band III, Nr. 4, 1975 (eugenejussekmd.com [PDF]). PDF ( des vom 29. Juni 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ A. Wurtz: Umwandlung des Aethylens zu complicirten organischen Säuren. In: Liebigs Ann. Chem. Band 117, Nr. 1, 1861, S. 136–140, doi:10.1002/jlac.18611170114.
- ↑ W. Heintz: Ueber die Diglycolsäure (Paraäpfelsäure). In: Ann. Phys. Band 191, Nr. 2, 1862, S. 280–295, doi:10.1002/andp.18621910206.
- ↑ K.E. Füger: Synthese und katalytische Reduktion von Glykolsäure und Glykolsäureestern, Promotionsarbeit ETH Zürich. Juris-Verlag, 1959 (ethz.ch [PDF]).
- ↑ C. Erk: Condensation of diglycolic acid dichloride with polyglycols, 5. An improved synthesis of cyclic polyether-esters by cyclization. In: Liebigs Ann. Chem. Band 10, 1991, S. 1083–1084, doi:10.1002/jlac.1991199101186.
- ↑ Patent US4066691: Process for the production of pure diglycolic acid by oxidation if diethylene glycol with nitric acid. Angemeldet am 8. September 1976, veröffentlicht am 3. Januar 1978, Anmelder: Chemische Werke Hüls AG, Erfinder: M. Schröder.
- ↑ Patent US3879452: Method for making diglycolic acid, dipropionic acid and the salts thereof. Angemeldet am 18. Juni 1971, veröffentlicht am 22. April 1975, Anmelder: Conen Corp., Erfinder: G.E. Brown, Jr..
- ↑ Patent US4256916A: Oxidation of polyethylene glycols to dicarboxylic acids. Angemeldet am 15. August 1979, veröffentlicht am 17. März 1981, Anmelder: Eastman Kodak Co., Erfinder: D.L. Morris, W.J. Gammans, J.D. Holmes.
- ↑ Y-Y. Zhang, Z.-Y. Liang, Y.-D. Zhang: Preparation of Diglycolic Acid via Oxidation of Diethylene Glycol with Molecular Oxygen. In: Fine Chemicals. Mai 2012 (com.cn [PDF]).
- ↑ Patent US3952054: Process for preparing diglycolic acid. Angemeldet am 5. Dezember 1974, veröffentlicht am 20. April 1976, Anmelder: Monsanto Co., Erfinder: C.Y. Shen.
- ↑ Patent US3173888: Diesters of diglycolic acid and vinyl chloride polymers plastized therewith. Angemeldet am 13. November 1962, veröffentlicht am 16. März 1965, Anmelder: Eastman Kodak Co., Erfinder: P.T. von Bramer, R.M. Simons.
- ↑ Patent US3639279: Scale removal composition and method using salt of diglycolic acid and base at pH above 5. Angemeldet am 1. April 1969, veröffentlicht am 1. Februar 1972, Anmelder: Halliburton Co., Erfinder: T.R. Gardner, R.M. Lasater, J.A. Knox.
- ↑ Patent US5696178: Absorbable polyalkylene diglycolates. Angemeldet am 22. Juli 1996, veröffentlicht am 9. Dezember 1997, Anmelder: Ethicon, Inc., Erfinder: K. Cooper, A. Scopelianos.

