Ritter-Reaktion
Die Ritter-Reaktion ist eine Namensreaktion der Organischen Chemie und benannt nach dem US-amerikanischen Chemiker John Joseph Ritter. Sie dient der Synthese von N-Alkylamiden aus Nitrilen. Dazu sind Substrate nötig, die Carbeniumionen bilden können (etwa verschiedene Alkylierungsmittel in Gegenwart von starken Mineralsäuren).[1][2][3] Primäre,[4] sekundäre[5] und tertiäre Alkohole[6] sowie Benzylalkohol[7] und tert-Butylacetat[8] und Isobutylen reagieren als Alkylierungsmittel sehr gut.
Neuerdings ist es gelungen, die Ritterreaktion mit Cycloalkanen in Gegenwart eines starken Oxidationsmittels, eines Kupfer-Katalysators und einer Lewis-Säure mit hohen Ausbeuten an Carbonsäureamiden durchzuführen.[9]
Reaktionsmechanismus
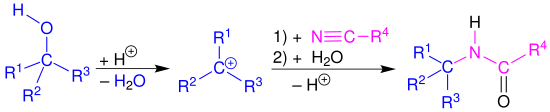
[Bearbeiten | Quelltext bearbeiten]Die Ritter-Reaktion wird in diesem Abschnitt am Beispiel eines tertiären Alkohols 1 beschrieben. Der erste Reaktionsschritt wird durch eine Protonierung der Hydroxygruppe in 1 eingeleitet, um nach einer Wasserabspaltung ein Carbeniumion 3 als Alkylierungsmittel zu erhalten. Darauf erfolgt ein nucleophiler Angriff des Nitrils. Das daraus resultierende Nitrilion 4 wird mit Wasser hydrolysiert. Nach einer Protonenumlagerung (5 → 6) und der anschließenden Abspaltung eines Protons, wird das gewünschte Amid 8 erhalten.[10]

Graf-Ritter-Reaktion
[Bearbeiten | Quelltext bearbeiten]Die Graf-Ritter-Reaktion ist eine Namensreaktion in der organischen Chemie. Sie erlaubt die Synthese von N-alkylierten Amiden mit sekundären oder sekundären Alkylgruppen am Stickstoff.[11]
Die Graf-Ritter-Reaktion ist auch zur Darstellung von N-Acylaminosäuren,[12] Isochinolinen[13] oder Oxazolinen[14] geeignet.[11] Sie wurde nach John J. Ritter[15] und R. Graf (Patent D855994 vom 23. August 1944 von den Farbwerke Hoechst) benannt.[16]
Die Anlagerung von Blausäure an die C=C-Doppelbindung von Alkenen in Gegenwart von Schwefelsäure oder anderen starken Säuren liefert N-alkylierte Formamide:

Die Formamide lassen sich besonders leicht zum Amin verseifen. Damit ist diese Strategie eine besonders elegante Methode zur Herstellung der sonst schwer zugänglichen tertiären Alkylamine. Statt Blausäure kann man auch ein Nitril als Edukt einsetzen. Ausgehend von Acetonitril erhält man analog ein N-alkyliertes Acetamid:[17]
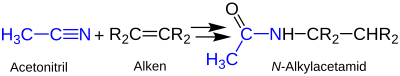
Die Graf-Ritter-Reaktion läuft mit Schwefelsäure über eine kationische Zwischenstufe ab. Dessen Reaktion mit Wasser liefert dann das betreffende Carbonsäureamid:[17]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Ritter, J. J., Minieri, P. P.; J. Am. Chem. Soc., 1948, 70, 4045.
- ↑ Ritter, J. J., Kalish, J.; J. Am. Chem. Soc., 1948, 70, 4048.
- ↑ Krimen, L. I., Cota, D. J.; Org. React. 1969, 17, 213–325 (Übersichtsartikel).
- ↑ Lebedev, M. Y., Erman, M. B.; Tetrahedron Lett. 2002, 43, 1397–1399; doi:10.1016/S0040-4039(02)00057-6.
- ↑ Bishop, R.; In Comp. Org. Synth.; Trost, B.M., Fleming, I.; Eds.; Pergamon Press: New York, 1992; Vol. 6, 261–300 (Übersichtsartikel).
- ↑ Ritter, J. J., Kalish, J.: α,α-Dimethyl-β-Phenethylamine In: Organic Syntheses. 44, 1964, S. 44, doi:10.15227/orgsyn.044.0044; Coll. Vol. 5, 1973, S. 471 (PDF).
- ↑ Parris, C. L.: N-Benzylacrylamide In: Organic Syntheses. 42, 1962, S. 16, doi:10.15227/orgsyn.042.0016; Coll. Vol. 5, 1973, S. 73 (PDF).
- ↑ Fernholz, H., Schmidt, H.J.; Angew. Chem., Int. Ed. Eng., 1969, 8, 521; doi:10.1002/anie.196905211.
- ↑ Sven Doye: Eine intermolekulare Ritter-Reaktion an Alkanen. In: Chemie in unserer Zeit. Band 46, Nr. 3, 2012, S. 137, doi:10.1002/ciuz.201290033.
- ↑ Z. Wang: Comprehensive Organic Name Reactions and Reagents Volume 3, Wiley Verlag, 2009, S. 2399, ISBN 978-0-471-70450-8, (3-Volume Set).
- ↑ a b G. Hilgetag, A. Martini (Herausgeber): Weygand, Hilgetag: Organisch-chemische Experimentierkunst, Johann Ambrosius Barth Verlag, Leipzig, 1970, S. 416–417.
- ↑ Lawrence. W. Hartzel, John J. Ritter: N-Benzoylamino acids, J. Am. Chem. Soc. 71 (1949) S. 4130–4131.
- ↑ John J. Ritter, Francis X. Murphy: N-Acyl-β-phenethylamines, and a New Isoquinoline Synthesis, J. Am. Chem. Soc. 71 (1952) S. 763–765.
- ↑ Robert M. Lusskin, John J. Ritter:A New Reaction of Nitriles. V. Preparation of N-(2-Halo-1-ethyl)-amides, J. Am. Chem. Soc. 72 (1950), S. 5577–5578. doi:10.1021/ja01168a060
- ↑ John J. Ritter, Joseph Kalish: A New Reaction of Nitriles. II. Synthesis of t-Carbinamines. In: Journal of the American Chemical Society. Band 70, Nr. 12, 1948, S. 4048–4050, doi:10.1021/ja01192a023.
- ↑ F. Asinger: Paraffins Chemistry and Technology. Elsevier, 2016, ISBN 978-1-4831-4662-1, S. 428 (google.de).
- ↑ a b G. Hilgetag, A. Martini (Herausgeber): Weygand, Hilgetag: Organisch-chemische Experimentierkunst, Johann Ambrosius Barth Verlag, Leipzig, 1970, S. 416–417.