Itaconsäureanhydrid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Itaconsäureanhydrid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H4O3 | ||||||||||||
| Kurzbeschreibung |
farbloser kristalliner Feststoff[1] bzw. weißes bis blassgelbes Kristallpulver[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 112,09 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
löslich in Aceton und Chloroform, wenig löslich in Diethylether[2], reagiert mit Wasser | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Itaconsäureanhydrid ist das cyclische Anhydrid der ungesättigten Dicarbonsäure Itaconsäure und wird bei der Pyrolyse von Citronensäure erhalten.[4] Das wegen seiner einfachen Zugänglichkeit aus preisgünstigen nachwachsenden Rohstoffen als vielseitiges Monomer und Molekülbaustein (engl. building block) propagierte Itaconsäureanhydrid (als Derivat der so genannten biobasierten Plattformchemikalie[5] Itaconsäure)[6] hat bisher die darauf gesetzten Erwartungen nicht erfüllt.[7]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Bei der Destillation von Citronensäure wurde bereits 1836 als eines der Produkte die so genannte „Brenzcitronensäure“, korrekt Itaconsäureanhydrid, erhalten.[8]
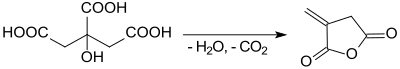
Nach einer Organic Syntheses-Vorschrift[4] wird beim schnellen Erhitzen von Citronensäure-monohydrat Itaconsäureanhydrid in bescheidener Ausbeute (37–47 %) erhalten. Als Nebenprodukt fällt das thermodynamisch stabilere Citraconsäureanhydrid[9] an.
Auch beim Erhitzen von wasserfreier Citronensäure auf 260 °C im Vakuum wird ein Gemisch von Itacon- und Citraconsäureanhydrid „in good yield“ erzielt.[10]
Sehr viel ergiebiger sind Verfahren, die von der biotechnologisch gut zugänglichen Itaconsäure[11] ausgehen, die bei Temperaturen von 165–180 °C und Drücken von 10–30 mmHg in Gegenwart katalytischer Mengen starker Säuren, wie z. B. konzentrierter Schwefelsäure, ausschließlich Itaconsäureanhydrid in Ausbeuten bis 98 % liefert.[12]

Um Überhitzung und damit höhere Anteile an Citraconsäureanhydrid zu vermeiden, kann die Dehydratisierungsreaktion auch in höhersiedenden aromatischen Lösungsmitteln, wie z. B. Toluol oder Xylolen in Gegenwart von saurem Montmorillonit[13] oder in Cumol in Gegenwart von Methansulfonsäure durchgeführt werden.[14]
In beiden Varianten werden Ausbeuten von 95–97 % an Itaconsäureanhydrid erzielt.
Ein neueres Verfahren der Cyclisierung von Dicarbonsäuren mit Diethylcarbonat in Gegenwart eines Chrom-Salen-Komplexes mit µ-Nitrido-bis(triphenylphosphan)-chlorid als Cokatalysator liefert in 1millimolaren Ansätzen bereits bei 40 °C quantitativ mit Citraconsäureanhydrid (18 %) verunreinigtes Itaconsäureanhydrid, ist aber wegen seiner teuren Katalysatoren technisch uninteressant.[15]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Itaconsäureanhydrid ist ein farbloser, kristalliner Feststoff, der sich in vielen polaren organischen Lösungsmitteln löst und mit Wasser unter Bildung von Itaconsäure hydrolysiert.[4] Die Substanz sollte daher unter Feuchtigkeitsausschluss und in inerter Atmosphäre gelagert werden. Bei Temperaturen oberhalb seines Schmelzpunktes lagert sich Itaconsäureanhydrid in Citraconsäureanhydrid um.[12] Auch bei deutlich niedrigeren Temperaturen, wie z. B. in siedendem Chloroform, kann diese Isomerisierung in Gegenwart tertiärer Amine stattfinden.[16]
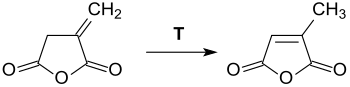
Die schwankenden Werte der angegebenen Schmelzpunkte sind auf die in der Praxis unvermeidlichen Verunreinigungen des Produkts mit Citraconsäureanhydrid zurückzuführen.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Durch Umsetzung von Itaconsäureanhydrid mit Phosphorpentachlorid PCl5 erhält man Itaconsäuredichlorid (Itaconylchlorid),[17]

aus dem mit Diaminen Polyamide mit reaktionsfähigen Vinylidengruppen gebildet werden können.[18]
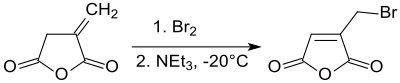
Bromierung von Itaconsäureanhydrid bei – 20 °C und anschließende Dehydrobromierung liefert unter Verschiebung der Doppelbindung in den Fünfring 2-Brommethylmaleinsäureanhydrid in 70 %iger Reinausbeute.[19]
Otto Diels und Kurt Alder beschrieben schon 1928 die Addition (Diels-Alder-Reaktion) des Dienophils Itaconsäureanhydrid an das Dien Cyclopentadien.[20]
Auch der aus nachwachsenden Rohstoffen zugängliche Furfurylalkohol reagiert als Dien unter Bildung des Diels-Alder-Addukts, wobei sich durch Reaktion der Alkoholgruppe mit der cyclischen Anhydridstruktur ein Lacton und eine Carbonsäuregruppe, d. h. der cyclische Halbester der Itaconsäure bildet.[21]

In einer Friedel-Crafts-Acylierung reagiert Itaconsäureanhydrid mit Aromaten, wie z. B. Benzol immer so, dass die Ringöffnung an der Carbonylgruppe erfolgt, die weiter von der Methylengruppe entfernt ist (3-Stellung).[22]
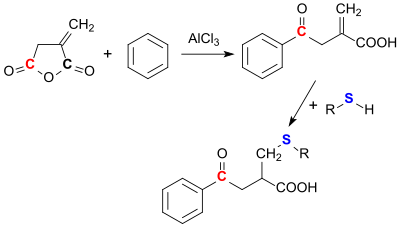
An die Methylengruppe lassen sich Nukleophile, wie z. B. Thiole leicht addieren.
Mit Nukleophilen, wie z. B. Alkoholen, Ammoniak,[23] Aminen und Hydroxylamin reagiert Itaconsäureanhydrid regioselektiv in 3-Stellung zu den entsprechenden Estern, Amiden und Hydroxamsäuren.

Die mit O-Benzylhydroxylamin entstehende Hydroxamsäure kann in hohen Ausbeuten mit Dicyclohexylcarbodiimid DCC zu fünfgliedrigen Isoimiden (Iminofuranone) oder mit Acetanhydrid Ac2O zu Imiden cyclisiert werden.[24]
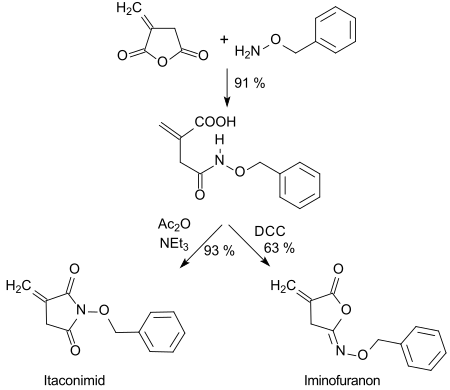
Der postulierte Ersatz von Maleinsäureanhydrid durch Itaconsäureanhydrid in den zur Papierleimung vielfach eingesetzten Alkenylbernsteinsäureanhydriden ist bisher noch nicht technisch realisiert.
Auch eine Reihe fünf-, sechs- und siebengliedriger Heterocyclen, wie z. B. Benzothiazepine, ist aus Itaconsäureanhydrid in brauchbaren Ausbeuten zugänglich.[25]

Polymere mit Itaconsäureanhydrid[Bearbeiten | Quelltext bearbeiten]
Als ungesättigtes cyclisches Anhydrid kann Itaconsäureanhydrid sowohl bei der radikalischen Polymerisation[26] als auch durch Polykondensation mit Diolen oder Diaminen Polymere bilden. Die beiden unterschiedlichen Polymerbildungsreaktionen können auch sequentiell – zuerst Polymerisation, dann Polykondensation oder umgekehrt – durchgeführt werden.[27][28]
Radikalisch erzeugte Itaconsäureanhydrid-Polymere und -Copolymere werden unter Ringöffnung alkalisch zu Polyitaconsäuren hydrolysiert oder durch Polymeranaloge Reaktionen in polymere Säureamide oder Ester überführt.[29]

Die erhaltenen Copolymeren zeigen Eigenschaften, die sie als Biomaterialien für therapeutische Systeme und Prothesen interessant machen.[30]
Ein eleganter Weg der Darstellung von funktionellen Polymeren ausschließlich aus biogenen Monomeren stellt die ringöffnende metathetische Polymerisation ROMP eines aus Itaconsäureanhydrid und Furfurylalkohol durch Diels-Alder-Lactonisierung gebildeten Oxanorbornen-Esters mithilfe eines Grubbs II-Katalysators dar.[31]

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Itaconsäureanhydrid bei Sigma-Aldrich, abgerufen am 28. September 2018 (PDF).
- ↑ a b Eintrag zu Itaconic Anhydride bei TCI Europe, abgerufen am 28. September 2018.
- ↑ J.L. Belletire, R.J. Rauh: Itaconic Anhydride. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.ri086.
- ↑ a b c R.L. Shriner, S.G. Ford, L.J. Roll: Itaconic anhydride and itaconic acid In: Organic Syntheses. 11, 1931, S. 70, doi:10.15227/orgsyn.011.0070; Coll. Vol. 2, 1943, S. 368 (PDF).
- ↑ B. Kamm: Produktion von Plattformchemikalien und Synthesegas aus Biomasse. In: Angew. Chem. Band 119, Nr. 27, 2007, S. 5146–5149, doi:10.1002/ange.200604514j.
- ↑ Birgit Kamm: Das Konzept der Bioraffinerie - Schlüssel für Ressourceneffizienz. GDCh Aktuelle Wochenschau, 14. April 2008, abgerufen am 1. Oktober 2018.
- ↑ Jim Lane: The DOE’s 12 top biobased molecules – what became of them? BiofuelsDigest, 30. April 2015, abgerufen am 1. Oktober 2018.
- ↑ S. Baup: Ueber eine neue Pyrogen-Citronensäure, und ueber Benennung der Pyrogen-Säuren überhaupt. In: Justus Liebigs Ann. Chem. Band 19, Nr. 1, 1836, S. 29–38, doi:10.1002/jlac.18360190107.
- ↑ R.L. Shriner, S.G. Ford, L.J. Roll: Citraconic anhydride and citraconic acid In: Organic Syntheses. 11, 1931, S. 28, doi:10.15227/orgsyn.011.0028; Coll. Vol. 2, 1943, S. 140 (PDF).
- ↑ Patent US2258947: Production of itaconic and citraconic anhydrides. Angemeldet am 21. September 1939, veröffentlicht am 14. Oktober 1941, Anmelder: National Aniline & Chemical Co., Erfinder: J.H. Crowell.
- ↑ Novamont SpA: Final Report Summary - BIO-QED (Quod Erat Demonstrandum: Large scale demonstration for the bio-based bulk chemicals BDO and IA aiming at cost reduction and improved sustainability). CORDIS, 26. Juli 2018, abgerufen am 1. Oktober 2018.
- ↑ a b Patent GB854999: A process for the production of itaconic anhydride. Angemeldet am 6. April 1959, veröffentlicht am 23. November 1960, Anmelder: Chas. Pfizer & Co., Inc..
- ↑ Patent US5260456: Process for producing itaconic anhydride. Angemeldet am 21. April 1992, veröffentlicht am 9. November 1993, Anmelder: Rhone-Poulenc Chimie, Erfinder: M. Alas, M. Gubelmann, J.-M. Popa.
- ↑ Patent WO9506026: Dehydration of itaconic acid. Angemeldet am 25. August 1994, veröffentlicht am 2. März 1995, Anmelder: Akzo Nobel N.V., Erfinder: A.G. Talma, A.G. Bovenkamp-Bouwman, H.P. Verlaanhooft.
- ↑ C. Robert, F. de Montigny, C.M. Thomas: Tandem synthesis of alternating polyesters from renewable resources. In: Nature Commun. Band 2, 2011, S. 1–6, doi:10.1038/ncomms1596.
- ↑ M.C. Galanti, A.V. Galanti: Kinetic study of the isomerization of itaconic anhydride to citraconic anhydride. In: J. Org. Chem. Band 47, Nr. 8, 1982, S. 1572–1574, doi:10.1021/jo00347a041.
- ↑ W. Petri: Beiträge zur Kenntnis der Itaconsäure, Mesaconsäure und Citraconsäure. In: Ber. Dtsch. Chem. Ges. Band 14, Nr. 2, 1881, S. 1634–1637, doi:10.1002/cber.18810140213.
- ↑ C. Wang, X. Wang, Z. Wie, X. Zeng: Synthesis and characterization of poly(p-phenyleneitaconamide). In: Polym. Mater. Sci. Eng. Band 34, Nr. 6, 2018, S. 9–15, doi:10.16865/j.cnki.1000-7555.2018.06.002.
- ↑ J. Nokami, T. Tamaoka, H. Ogawa, S. Wakabayashi: Facile synthesis of 2-methylene-4-butyrolactones. In: Chem. Lett. Band 15, Nr. 4, 1986, S. 541–544, doi:10.1246/cl.1986.541.
- ↑ O. Diels, K. Alder: Synthesen in der hydroaromatischen Reihe. In: Justus Liebigs Ann. Chem. Band 460, Nr. 1, 1928, S. 98–122, doi:10.1002/jlac.19284600106.
- ↑ A.D. Pehere, S. Xu, S.K. Thompson, M.A. Hillmyer, T.R. Hoye: Diels-Alder reactions of furans with itaconic anhydride: Overcoming unfavorable thermodynamics. In: Org. Lett. Band 18, Nr. 11, 2016, S. 2584–2587, doi:10.1021/acs.orglett.6b00929.
- ↑ K. Kameo, K. Ogawa, K. Takeshita, S. Nakaike, K. Tomisawa, K. Sato: Studies on antirheumatic agents: 3-benzoylpropionic acid derivatives. In: Chem. Pharm. Bull. Band 36, Nr. 6, 1988, S. 2050–2060, doi:10.1248/cpb.36.2050.
- ↑ H. Takeda, T.Tachinami, S. Hosokawa, M. Aburatani, K. Inoguchi, K. Achiwa: Efficient Preparation of Optically Active (S)-(-)-3-Methyl-γ-butyrolactone by Catalytic Asymmetric Hydrogenation Using Chiral N-Substituted Pyrrolidinebisphosphine Rhodium Complexes. In: Chem. Pharm. Bull. Band 39, Nr. 10, 1991, S. 2706–2708, doi:10.1248/cpb.39.2706.
- ↑ M. Akiyama, K. Shimizu, S. Aiba, F. Banba: Synthesis of N-Hydroxymaleimide and N-Hydroxyitaconimide and their related derivatives. In: J. Chem. Soc. Perkin I. Band 0, 1980, S. 2122–2125, doi:10.1039/P19800002122.
- ↑ A.M. Medway, J. Sperry: Heterocycle construction using the biomass-derived building block itaconic acid. In: Green Chem. Band 16, 2014, S. 2084–2101, doi:10.1039/c4gc00014e.
- ↑ D. Stawski, S. Polowinski: Polymerization of itaconic acid. In: Polimery. Band 50, Nr. 2, 2005, S. 118–122 (ichp.pl).
- ↑ F.H. Isikgor, C.R. Becer: Lignocellulosic biomass: a sustainable platform for the production of bio-based chemicals and polymers. In: Polym. Chem. Band 6, 2015, S. 4497–4559, doi:10.1039/c5py00263j.
- ↑ T. Okuda, K. Ishimoto, H. Ohara, S. Kobayashi: Renewable biobased polymeric materials: Facile synthesis of itaconic anhydride-based copolymers with poly(L-lactic acid) grafts. In: Macromolecules. Band 45, Nr. 10, 2012, S. 4166–4174, doi:10.1021/ma300387j.
- ↑ T. Otsu, J.-Z. Yang: Radical polymerization of itaconic anhydride and reactions of the resulting polymers with amines and alcohols. In: Polymer Int. Band 25, Nr. 4, 1991, S. 245–251, doi:10.1002/pi.4990250408.
- ↑ S. Shang, S.J. Huang, R.A. Weiss: Comb-like ionomers from sustainable resources: Copolymers of itaconic anhydride-co-stearyl methacrylate. In: Polymer. Band 52, Nr. 13, 2011, S. 2764–2771, doi:10.1016/j.polymer.2011.04.025.
- ↑ Y. Bai, J.H. Clark, T.J. Farmer, I.D.V. Ingram, M. North: Wholly biomass derivable sustainable polymers by ring-opening metathesis polymerization of monomers obtained from furfuryl alcohol and itaconic anhydride. In: Polymer Chem. Band 8, Nr. 20, 2017, S. 3074–3081, doi:10.1039/C7PY00486A.
