Sulpirid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
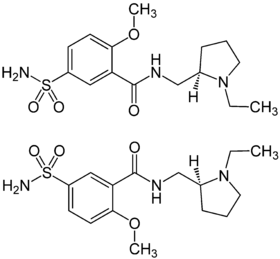
| ||||||||||||||||||||||
| (R)-Form (oben) und (S)-Form (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sulpirid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C15H23N3O4S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Blockade der D2-Rezeptoren | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 341,43 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
9,12[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Sulpirid ist ein Arzneistoff, der vor allem in der Psychiatrie eingesetzt wird. Es zählt zu den atypischen Neuroleptika[6][7] (wird aber in einigen Texten auch als typisches Neuroleptikum gehandhabt[2]), hat allerdings auch eine gewisse antidepressive Wirkung. Von der chemischen Struktur her handelt es sich um ein substituiertes Benzamid. Sulpirid wurde 1972 auf den Markt gebracht.[8]
Wirkprofil
[Bearbeiten | Quelltext bearbeiten]Sulpirid hat im Gehirn eine starke Affinität zu den D2- und D3-Rezeptoren. Andere Neurotransmittersysteme werden kaum beeinflusst.
Die antipsychotische Wirkung setzt erst ab Dosen über 600 mg/Tag ein. Grund dafür ist vermutlich die geringe Schrankengängigkeit von Sulpirid, welche den eigentlich hochpotenten Stoff erst bei höheren Dosen als Neuroleptikum wirken lässt. Die höhere Durchlässigkeit der Blut-Hirn-Schranke im Bereich des tubero-infundibulären Systems führt dazu, dass schon relativ geringe Dosen Sulpirid eine erhöhte Prolaktin-Ausschüttung bewirken können. Bei niedrigeren Dosen wirkt Sulpirid stimmungsaufhellend und aktivierend.
Indikation
[Bearbeiten | Quelltext bearbeiten]Sulpirid ist zur Behandlung von Depressionen zugelassen, wenn andere Antidepressiva versagt haben oder nicht angewendet werden konnten. In höherer Dosis kann es zur Behandlung von Schizophrenien verwendet werden.
Sulpirid ist außerdem zur symptomatischen Therapie von Schwindelzuständen (Morbus Menière) zugelassen. Die Anwendung für diese Indikation ist jedoch umstritten.[9]
Obwohl dem Sulpirid ein Rückschlag wie beim Clozapin erspart blieb, ließ das Interesse an der Substanz in den 1980er Jahren merklich nach.[10] In den USA wurde Sulpirid nicht eingeführt.
Das enantiomerenreine Levosulpirid [(S)-Sulpirid] ist wegen seiner prokinetischen Wirksamkeit zur Behandlung von dyspeptischen Störungen angezeigt.[11][12]
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Die wichtigste Nebenwirkung von Sulpirid ist die Erhöhung der Prolaktin-Ausschüttung, die bei Frauen z. B. zu Zyklusstörungen, bei Männern zu Verweiblichung und Brustvergrößerung (Gynäkomastie) führen kann. Die aktivierende Wirkung von Sulpirid kann mitunter als sehr störend empfunden werden und Schlafstörungen verursachen.
Besonders in hohen Dosen kann Sulpirid extrapyramidal-motorische Störungen (Extrapyramidales Syndrom) verursachen. Am Herzen kann es zu einer Verlängerung der QTc-Zeit[13] kommen.
Darreichungsformen
[Bearbeiten | Quelltext bearbeiten]Sulpirid liegt in verschiedensten Darreichungsformen zur oralen Einnahme (Tabletten, Kapseln, Saft etc.) sowie als Injektionslösung vor.
Die Tagesdosis richtet sich nach dem jeweiligen Anwendungsgebiet, wegen der aktivierenden Wirkung sollte Sulpirid morgens eingenommen werden, bzw. die letzte Einzeldosis sollte spätestens bis 16:00 Uhr gegeben werden. Die Dosierung soll – speziell bei höherer Zieldosis – ein- bzw. ausschleichend geändert werden.
Synthese
[Bearbeiten | Quelltext bearbeiten]
Eine mehrstufige Synthese für Sulpirid ist in der Literatur beschrieben.[14] Zur Herstellung von Sulpirid werden viele Verfahren zur Aktivierung der 2-Methoxy-5-sulfamoylbenzoesäure herangezogen.[15][16] Die deutlich differenzierte Reaktivität der Säurechloride im 2-Methoxy-5-fluorsulfonylbenzoylchlorid gegenüber Aminen und Ammoniak nützt ein weiteres Verfahren.[17] Ein alternativer Weg dazu besteht in der Chlorsulfonierung eines Benzamids.[18][19] (siehe Schema).
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]Amisulprid und Tiaprid sind Analogsubstanzen von Sulpirid; Remoxiprid ist ebenfalls ein Analogon, jedoch außer Handel.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
Arminol (D), Dogmatil (D, A, CH), Meresa (D), Meresasul (D, A), Neogama (D), Sulpivert (D), Vertigo-Meresa (D), Vertige-Neogama (D), zahlreiche Generika (D)
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Europäische Arzneibuch-Kommission (Hrsg.): Europäische Pharmakopöe, 5. Ausgabe. Band 5.0–5.8, 2006.
- ↑ a b Joint Formulary Committee. British National Formulary (BNF) (65 ed.). Pharmaceutical Press, London UK, ISBN 978-0-85711-084-8.
- ↑ a b The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1542–1543.
- ↑ a b c Eintrag zu Sulpiride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt (±)-Sulpiride, powder bei Sigma-Aldrich, abgerufen am 26. Februar 2013 (PDF).
- ↑ Peter Riederer, Gerd Laux, Walter Pöldinger(Hrsg.): Neuro-Psychopharmaka: Ein Therapie-Handbuch, Band 4: Neuroleptika. 2. Auflage, Springer 1998, ISBN 3-211-82943-1, S. 28.
- ↑ Claus-Jürgen Estler, Harald Schmidt: Pharmakologie und Toxikologie: für Studium und Praxis. 6. Auflage. Schattauer Verlag 2007, ISBN 3-7945-2295-8, S. 231.
- ↑ Psychopharmaka Zeittafel. ePsy.de
- ↑ N. Perez, S. Fernandez, I. Legarda, R Garcia-Tapia: Distonia aguda por neurolepticos en el tratamiento del vertigo: a proposito de dos casos. In: Acta Otorrinolaringol Esp., Juli–August 1992, 43(4), S. 287–289; PMID 1419163.
- ↑ Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4, S. 93.
- ↑ A. Madisch et al.: Diagnose und Therapie der funktionellen Dyspepsie, Dtsch Arztebl Int 2018; 115: 222-32; doi:10.3238/arztebl.2018.0222
- ↑ Levosulpiride Teva 25 mg compresse/Levosulpiride Teva 25 mg/ml gocce orali soluzione. (PDF; 0,3 MB) farmaci.agenziafarmaco.gov.it, Fachinformation (italienisch); abgerufen am 10. Dezember 2019.
- ↑ Torsten Kratz, Albert Diefenbacher: Psychopharmakotherapie im Alter. Vermeidung von Arzneimittelinteraktionen und Polypharmazie. In: Deutsches Ärzteblatt. Band 116, Heft 29 f. (22. Juli) 2019, S. 508–517, S. 512.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 2 Bände. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ Charles Stewart Miller, Edward L. Engelhardt, Michel L. Thominet: Nouveux médicaments à base de benzamides hétérocycliques. In: Chem.Abstr., 1969, S. 470–484. FR 5 916 M Volltext worldwide.espacenet.com
- ↑ Patent DE2901170: Substituierte heterocyclische Benzamide, Verfahren zu ihrer Herstellung und diese enthaltende Arzneimittel. Veröffentlicht am 26. Juli 1979, Anmelder: Ile de France, Erfinder: Michel Thominet, Jacques Acher, Jean Claude Monier.
- ↑ Patent DE2414498: Verfahren zur Herstellung von [N,N-Dialkylamino-alkyl]-2-alkoxy-5-sulfamoylbenzamiden. Veröffentlicht am 2. Oktober 1975, Anmelder: Ludwig Heumann & Co GmbH, Erfinder: Walter Liebenow, Ingomar Grafe.
- ↑ Patent DE2331959: Verfahren zur Herstellung heterocyclischer Benzamidverbindungen. Veröffentlicht am 10. Januar 1974, Anmelder: Delmar Chem., Erfinder: Ctirad Podesva, William Thomas Scott, Milada M. Navratil.
- ↑ Patent DE2358267: Verfahren zur Herstellung von Benzolsulfonamiden. Veröffentlicht am 6. Juni 1974, Anmelder: Ile de France, Erfinder: Akira Morimoto.