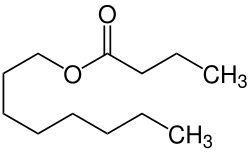
Octylbutyrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Octylbutyrat | ||||||||||||||||||
| Andere Namen |
Buttersäureoctylester | ||||||||||||||||||
| Summenformel | C12H24O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 200,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,862 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
244 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,425 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Octylbutyrat ist ein Carbonsäureester der Buttersäure mit 1-Octanol.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Octylbutyrat kommt verbreitet in den ätherischen Ölen von Doldenblütlern vor. Das ätherische Öl der Pastinake enthält beispielsweise viel Octylacetat und Octylbutyrat. In kultivierten Varianten macht das Butyrat die Hauptmenge aus, während die Verteilung bei wilden Arten umgekehrt ist.[4] Die Verbindung wird bei Beschädigung der Blüten vermehrt gebildet und dient vermutlich als Fraßschutz, da sie gegen die Raupen des Schädlings Depressaria pastinacella sowohl abschreckend als auch giftig wirkt.[5] Golpar-Öl enthält ebenfalls einige Prozent Octylbutyrat[6] es ist ein wichtiger Bestandteil (über 20 %) im Öl des Wiesen-Bärenklaus[7] außerdem kommt es auch in vielen weiteren Arten der Gattung Heracleum vor.[8][9][10] In geringen Mengen (bis etwa 2 %) kommt es im Öl von Zosima absinthifolia vor.[11][12]
Octylbutyrat kommt auch in der Zuckermelone[13], sowie Zitrusfrüchten und einigen anderen Früchten vor.[14]
-
Pastinake
-
Wiesen-Bärenklau
-
Zosima absinthifolia
-
Zuckermelone
Synthese
[Bearbeiten | Quelltext bearbeiten]Es kann durch Umesterung von Vinylbutyrat mit 1-Octanol durch verschiedene bakterielle Lipasen gewonnen werden.[15][16] Ebenfalls möglich ist die Synthese durch Reaktion von Buttersäure mit 1-Octanol in Gegenwart von Salzsäure.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Octylbutyrat ist in der EU unter der FL-Nummer 09.046 als Aromastoff für Lebensmittel allgemein zugelassen.[17] Außerdem eignet es sich als Köder für verschiedene Arten von Wespen (Gattung Vespula).[18][19]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2004, ISBN 978-1-4200-3787-6, S. 1440 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f Datenblatt Octyl butyrate; 98% bei Sigma-Aldrich, abgerufen am 10. August 2023 (PDF).
- ↑ CRC Handbook of Chemistry and Physics, 87th Edition. Taylor & Francis, ISBN 978-0-8493-0594-8, S. 641 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mj Carroll, Ar Zangerl, Mr Berenbaum: Brief communication. Heritability estimates for octyl acetate and octyl butyrate in the mature fruit of the wild parsnip. In: Journal of Heredity. Band 91, Nr. 1, Januar 2000, S. 68–71, doi:10.1093/jhered/91.1.68.
- ↑ A. R. Zangerl, M. R. Berenbaum: Effects of florivory on floral volatile emissions and pollination success in the wild parsnip. In: Arthropod-Plant Interactions. Band 3, Nr. 3, September 2009, S. 181–191, doi:10.1007/s11829-009-9071-x.
- ↑ Seyed Hamid Mustafavi, Amin Abbasi, Mohammad Reza Morshedloo, Mirian Pateiro, Jose M. Lorenzo: Essential Oil Variability in Iranian Populations of Heracleum persicum Desf. ex Fischer: A Rich Source of Hexyl Butyrate and Octyl Acetate. In: Molecules. Band 27, Nr. 19, 23. September 2022, S. 6296, doi:10.3390/molecules27196296, PMID 36234832, PMC 9573637 (freier Volltext).
- ↑ Gökalp İşcan, Fatih Demirci, Mine Kürkçüoǧlu, Merih Kıvanç, K. Hüsnü Can Başer: The Bioactive Essential Oil of Heracleum sphondylium L. subsp. ternatum (Velen.) Brummitt. In: Zeitschrift für Naturforschung C. Band 58, Nr. 3-4, 1. April 2003, S. 195–200, doi:10.1515/znc-2003-3-410.
- ↑ Tayebeh Radjabian, Azam Salimi, Nosrat Rahmani: Essential-Oil Composition of the Fruits of Six Heracleum L. Species from Iran: Chemotaxonomic Significance. In: Chemistry & Biodiversity. Band 11, Nr. 12, Dezember 2014, S. 1945–1953, doi:10.1002/cbdv.201400085.
- ↑ T. Özek, G. Özek, K. H.C. Baser, A. Duran: Comparison of the Essential Oils of Three Endemic Turkish Heracleum Species Obtained by Different Isolation Techniques. In: Journal of Essential Oil Research. Band 17, Nr. 6, November 2005, S. 605–610, doi:10.1080/10412905.2005.9699009.
- ↑ Krystyna Skalicka-Woźniak, Agnieszka Grzegorczyk, Łukasz Świątek, Magdalena Walasek, Jarosław Widelski, Barbara Rajtar, Małgorzata Polz-Dacewicz, Anna Malm, Hosam O. Elansary: Biological activity and safety profile of the essential oil from fruits of Heracleum mantegazzianum Sommier & Levier (Apiaceae). In: Food and Chemical Toxicology. Band 109, November 2017, S. 820–826, doi:10.1016/j.fct.2017.05.033.
- ↑ Songul Karakaya, Mehmet Koca, Serdar Yılmaz, Kadir Yıldırım, Nur Pınar, Betül Demirci, Marian Brestic, Oksana Sytar: Molecular Docking Studies of Coumarins Isolated from Extracts and Essential Oils of Zosima absinthifolia Link as Potential Inhibitors for Alzheimer’s Disease. In: Molecules. Band 24, Nr. 4, 17. Februar 2019, S. 722, doi:10.3390/molecules24040722, PMID 30781573, PMC 6412260 (freier Volltext).
- ↑ K. H. C Başer, T. Özek, B. Demirci, M. Kürkçüoǧlu, Z. Aytaç, H. Duman: Composition of the essential oils of Zosima absinthifolia (Vent.) Link and Ferula elaeochytris Korovin from Turkey. In: Flavour and Fragrance Journal. Band 15, Nr. 6, November 2000, S. 371–372, doi:10.1002/1099-1026(200011/12)15:6<371::AID-FFJ919>3.0.CO;2-Z.
- ↑ Thomas R. Kemp, D.E. Knavel, L.P. Stoltz: Characterization of some volatile components of muskmelon fruit. In: Phytochemistry. Band 10, Nr. 8, August 1971, S. 1925–1928, doi:10.1016/S0031-9422(00)86460-2.
- ↑ A.M. Api, D. Belsito, D. Botelho, M. Bruze, G.A. Burton, J. Buschmann, M.L. Dagli, M. Date, W. Dekant, C. Deodhar, M. Francis, A.D. Fryer, L. Jones, K. Joshi, S. La Cava, A. Lapczynski, D.C. Liebler, D. O’Brien, A. Patel, T.M. Penning, G. Ritacco, J. Romine, N. Sadekar, D. Salvito, T.W. Schultz, I.G. Sipes, G. Sullivan, Y. Thakkar, Y. Tokura, S. Tsang: RIFM fragrance ingredient safety assessment, octyl butyrate, CAS Registry Number 110-39-4. In: Food and Chemical Toxicology. Band 122, Dezember 2018, S. S396–S405, doi:10.1016/j.fct.2018.09.036.
- ↑ Erick A. Snellman, Rita R. Colwell: Transesterification activity of a novel lipase from Acinetobacter venetianus RAG-1. In: Antonie van Leeuwenhoek. Band 94, Nr. 4, November 2008, S. 621–625, doi:10.1007/s10482-008-9276-5.
- ↑ Francesco Secundo, Simona Spadaro, Giacomo Carrea, P. L. Antoine Overbeeke: Optimization ofPseudomonas cepacia lipase preparations for catalysis in organic solvents. In: Biotechnology and Bioengineering. Band 62, Nr. 5, 5. März 1999, S. 554–561, doi:10.1002/(SICI)1097-0290(19990305)62:5<554::AID-BIT7>3.0.CO;2-2.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 14. Oktober 2023.
- ↑ Ashraf M El-Sayed, Lee-Anne Manning, C Rikard Unelius, Kye Chung Park, Lloyd D Stringer, Nicola White, Barry Bunn, Andrew Twidle, David M Suckling: Attraction and antennal response of the common wasp, Vespula vulgaris (L.), to selected synthetic chemicals in New Zealand beech forests: Synthetic attractants for social wasps in New Zealand. In: Pest Management Science. Band 65, Nr. 9, September 2009, S. 975–981, doi:10.1002/ps.1782.
- ↑ Harry G. Davis, Ronald J. Peterson, William M. Rogoff, Terrence P. McGovern, Morton Beroza: Octyl Butyrate, an Effective Attractant for the Yellowjacket 1. In: Environmental Entomology. Band 1, Nr. 5, 1. Oktober 1972, S. 673–674, doi:10.1093/ee/1.5.673.



