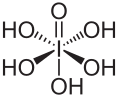
Periodsäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Periodsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H5IO6 | |||||||||||||||
| Kurzbeschreibung |
farbloser, fast geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 227,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung bei 130–140 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Periodsäure, auch Perjodsäure, ist eine Säure des Elements Iod. Ihre Salze heißen Periodate und können als Oxidationsmittel beispielsweise in organischen Synthesen dienen.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die Verbindung ist als Orthoperiodsäure (H5IO6) die einzige in Wasser beständige Iod(VII)-Säure.
Sie ist ein starkes Oxidationsmittel und eine schwache mehrbasige Säure mit einem pKs-Wert von 3,29.[3]
Orthoperiodsäure kristallisiert monoklin, Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2), mit den Gitterparametern a = 5,28 Å, b = 18,35 Å, c = 4,95 Å und β = 111,4°.[4] Sie hat eine nahezu oktaedrische Struktur, wobei die Doppelbindung zum Sauerstoff mehr Platz beansprucht und damit eine Ligandenebene etwas eindrückt. Es ergeben sich Winkel von unter 90° zwischen den Liganden.
Beim Erhitzen im Vakuum bildet sich durch fortgesetzte Kondensationsreaktionen über oligo-Periodsäuren, beispielsweise die Triperiodsäure (H7I3O14), die polymere meta-Periodsäure ((HIO4)n). In den oligo-Periodsäuren und der meta-Periodsäure ist das Iod verzerrt oktaedrisch von Sauerstoffatomen umgeben. Die Oktaeder sind jeweils über zwei Ecken miteinander verknüpft.[5]
-
Strukturformel von Triperiodsäure
-
Struktur der meta-Periodsäure
Herstellung[Bearbeiten | Quelltext bearbeiten]
Orthoperiodsäure wird aus Bariumorthoperiodat und Salpetersäure hergestellt. Man macht sich zunutze, dass Bariumnitrat in Salpetersäure unlöslich ist.[6]
Die Anodische Oxidation von Iodsäure führt ebenfalls zur Periodsäure.[7]
Verwendung[Bearbeiten | Quelltext bearbeiten]
- Malaprade-Reaktion (Glycolspaltung)
- PAS-Reaktion
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Periodsäure zur Synthese bei Merck, abgerufen am 10. November 2021.
- ↑ a b Eintrag zu Periodsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- ↑ Cotton-Wilkinson: Anorganische Chemie, 3. Auflage, Verlag Chemie, Weinheim 1974, ISBN 3-527-25503-6.
- ↑ Y.D. Feikema: The Crystal Structures of Two Oxy-Acids of Iodine. I. A Study of Orthoperiodic Acid, H5IO6, by Neutron Diffraction. In: Acta Crystallographica, 20, 1966, S. 765–769, doi:10.1107/S0365110X66001828.
- ↑ Holleman/Wiberg: Anorganische Chemie, 103. Auflage, Band 1: Grundlagen und Hauptgruppenelemente, de Gruyter, 2017, ISBN 978-3-11-026932-1.
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., Vol. 1, Academic Press 1963, S. 322–323.
- ↑ Periodsäure. In: Spektrum der Wissenschaft. Abgerufen am 19. Februar 2024.






