Trimethylolethan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trimethylolethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H12O3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 120,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
| ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Methanol, Ethanol und Aceton[7], sehr gut löslich in Essigsäure, unlöslich in Diethylether und Benzol[8] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trimethylolethan ist ein dreiwertiger Polyalkohol (Polyol) mit Neopentylstruktur, bei dem drei Hydroxymethylgruppen und eine Methylgruppe an einem quartären Kohlenstoffatom positioniert sind. Wie andere kugelförmige Moleküle, wie z. B. Adamantan oder die Stammverbindung Neopentan zeigt 1,1,1-Tris(hydroxymethyl)ethan plastisch kristalline Eigenschaften, d. h. eine geringe Orientierungsfernordnung im festen Zustand, die mit einer weichen, wachsartigen Konsistenz einhergeht. Die Ester von TME zeichnen sich durch hohe Stabilität gegenüber Temperatur, Licht und Hydrolyse aus.[5][9]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Bei der Reaktion von Propionaldehyd mit Formaldehyd im Verhältnis 1:3 wurde in Gegenwart von Ätzkalk (Calciumoxid) bereits 1893 das als Pentaglycerin bezeichnete 1,1,1-Tris(hydroxymethyl)ethan erhalten und charakterisiert.[10]
1901 wurde erkannt, dass in Gegenwart von Kaliumcarbonat zunächst eine Aldolreaktion erfolgt und das erhaltene Aldol mit Aluminiumamalgam zum Pentaglycerin reduziert werden kann.[11]
Die doppelte Aldoladdition von Formaldehyd in wässriger Lösung (Formalin) an Propionaldehyd führt zunächst in glatter Reaktion zu 2,2-Dihydroxymethylpropionaldehyd und kann bei entsprechender Verfahrensweise auf dieser Stufe gehalten werden.[12]
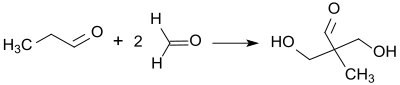
Die anschließende gekreuzte Cannizzaro-Reaktion mit überschüssigem Formaldehyd in Gegenwart von Natriumhydroxid liefert Trimethylolethan in Ausbeuten von ca. 90 %.[6]

Wegen der hohen Wasserlöslichkeit und des hohen Siedepunkts des 1,1,1-Tris(hydroxymethyl)ethan lässt es sich nicht einfach vom in stöchiometrischen Mengen entstandenen Natriumformiat abtrennen. Nach Entfernung des überschüssigen Formaldehyds und der Hauptmenge des Wassers kann TME mit Isopropanol oder Methylisobutylketon MIBK[6] extrahiert, durch Kristallisation isoliert und durch Sublimation hochgereinigt werden.
Da Aldoladdition und Cannizzaro-Reaktion bei erhöhter Temperatur und im Alkalischen gleichzeitig ablaufen, kann die Gesamtreaktion auch kontinuierlich mit Ausbeuten > 90 % geführt werden.[13]
Eine moderne Prozessvariante vermeidet die Cannizzaro-Reaktion mit dem stöchiometrischen (und in der Regel unerwünschten) Nebenprodukt Natriumformiat und bedient sich dazu fester heterogener Katalysatoren im wässrigen Medium für die erste Stufe der Aldoladdition (Anionenaustauscher mit Aminogruppen) und für die zweite Stufe der Hydrierung des Aldoladditionsprodukts (Nickel-Chrom- oder Kupfer-Chrom-Katalysator). Nach destillativer Entfernung des Formaldehydüberschusses wird bei der katalytischen Hydrierung quantitative Ausbeute an Trimethylolethan erzielt.[14]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trimethylolethan ist ein Feststoff, der als weißes, hygroskopisches Kristallpulver oder beim Umkristallisieren aus Alkoholen als „weiße, kammartig aufgestellte Nadeln“[10] bzw. als prismatische Nadeln[8] anfällt. Das Triol löst sich sehr gut in Essigsäure und in Alkoholen, sowie in Wasser, wobei Löslichkeiten von 140 g/l bei 25 °C,[3] 60 g/l bei 20 °C[1] und 40 g/l bei 25 °C[5] angegeben werden. In unpolaren Lösungsmitteln ist TME praktisch unlöslich. Die Verbindung schmeckt wie andere Polyole süß.[7]
Wegen der fehlenden Wasserstoffatome in Nachbarstellung zu den Hydroxygruppen besitzt das Molekül eine geringe Neigung zur thermischen Eliminierung. Die räumliche Abschirmung der Hydroxygruppen gegenüber radikalischem Angriff erhöht deren Stabilität gegenüber Hitze und Licht und die Stabilität z. B. der TME-Ester gegenüber Hydrolyse.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Trimethylolethan bildet mit Carbonsäuren unter saurer Katalyse oder durch Umesterung einfacher Carbonsäureester in Gegenwart von Titan-Katalysatoren, wie z. B. Tetrabutylorthotitanat oder Zinn-Katalysatoren, wie z. B. Dibutylzinnoxid die entsprechenden Mono-, Di- und Triester und deren Gemische.
Ester des Trimethylolethans mit längeren verzweigten Carbonsäuren werden als Stabilisatoren und als Weichmacher für Kunststoffe, solche mit Fettsäuren werden als Emulgatoren eingesetzt.
Umsetzungsprodukte mit Ethylenoxid EO oder Propylenoxid PO werden als Polyester- und Polyurethan-Komponenten verwendet. TME-Ester vereinen hohe Temperaturbeständigkeit mit niedrigerer Temperaturviskosität und eignen sich für anspruchsvolle Anwendungen, wie z. B. synthetische Schmierstoffe für Verbrennungsmotoren und Flugzeugtriebwerke.
Das kompakte TME-Molekül verleiht Alkydharzen und Polyesterharzen für hochwertige Lackanwendungen verbesserte Witterungsbeständigkeit sowie höhere Härte und Kratzfestigkeit. Bei der Nitrierung von 1,1,1-Tris(hydroxymethyl)ethan mit Oleum-Salpetersäure-Gemischen oder Nitriersäure entsteht das Trinitrat, das als Explosivstoff und als Treibladungskomponente für Feststoffraketen verwendet wird.
Trimethylolethan fungiert als dreizähniger O-Donorligand für kupferkatalysierte Kreuzkupplungsreaktionen von Aryliodiden mit Amiden, Thiolen und Phenolen in guten bis exzellenten Ausbeuten.[15]

Trimethylolethan eignet sich im Gemisch mit Wasser[16] und ggf. anderen polaren Substanzen, wie z. B. Sulfolan oder Harnstoff, als so genanntes Phasenwechselmaterial (engl. phase change materials, PCM) mit Phasenübergangstemperaturen zwischen 0 °C und 25 °C und großer thermischer Speicherdichte. Solche Gemische können als passive Wärmespeicher- oder als Kältespeichermedien im Gebäudesektor genutzt werden.[17]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Peter Wehrle, Marcus Morawietz, Stefan Lundmark, Kent Sörensen, Esko Karvinen, Juha Letonen: Alcohols, Polyhydric. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-30673-2, doi:10.1002/14356007.a01_305.pub2.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Trimethylolethane bei TCI Europe, abgerufen am 30. April 2018.
- ↑ a b c d Eintrag zu 2-(Hydroxymethyl)-2-methyl-1,3-propandiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. November 2022. (JavaScript erforderlich)
- ↑ a b David R. Lide: CRC Handbook of Chemistry and Physics, 86th Edition. CRC Press, Boca Raton, FL, U.S.A. 2005, ISBN 0-8493-0486-5, S. 3–294.
- ↑ Datenblatt 1,1,1-Tris(hydroxymethyl)ethane bei Sigma-Aldrich, abgerufen am 30. April 2018 (PDF).
- ↑ a b c TRIMETR TME (Trimethylolethane) Product Data, Technical Data Sheet. (PDF; 325 kB) In: trimet@geosc.com. GEO Specialty Chemicals, 2017, abgerufen am 30. April 2018 (englisch).
- ↑ a b c G.J. Laemmle, J.G. Milligan, W.J. Peppel: Trimethylolethane from propionaldehyde and formaldehyde. In: Ind. Eng. Chem. Band 52, Nr. 1, 1960, S. 33–36, doi:10.1021/ie.50601a032.
- ↑ a b R. Pummerer, H. Hahn, F. John, H. Kehlen: Über den photochemischen Aufbau verzweigter Kohlenstoffketten aus Äther und Formaldehyd. In: Chem. Ber. Band 75, Nr. 7, 1942, S. 867–881, doi:10.1002/cber.19420750719.
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–310.
- ↑ A Complete Guide to TRIMETR Brand of Trimethylolethane. (PDF; 448 kB) In: trimet@geosc.com. GEO Specialty Chemicals, 1999, ehemals im (nicht mehr online verfügbar); abgerufen am 30. April 2018 (englisch). (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ a b H. Hosaeus: XXXVI. Ueber das Penta-Glycerin (Methyl-trimethylol-methan). In: Liebigs Ann. Chem. Band 276, Nr. 1, 1893, S. 75–79, doi:10.1002/jlac.18932760108.
- ↑ H. Koch, T. Zerner: Über die Condensation von Propion- und Formaldehyd. In: Monatsh. Chem. Band 22, Nr. 5, 1901, S. 443–459, doi:10.1007/BF01524089.
- ↑ Patent US4247485: Process for the preparation of 2,2-dimethylolalkanals. Angemeldet am 19. März 1979, veröffentlicht am 27. Januar 1981, Anmelder: Bayer AG, Erfinder: O. Immel, H.-H. Schwarz, H. Quast.
- ↑ Patent US2790837: Continuous production of trimethylolethane. Angemeldet am 8. Juni 1954, veröffentlicht am 30. April 1957, Anmelder: Celanese Corp., Erfinder: M.O. Robeson.
- ↑ T. Salmi, V. Serra-Holm, T.-K. Rantakylä, P. Mäki-Arvela, L.P. Lindfors: Development of clean technology for the production of triols. In: Green Chem. Band 1, 1999, S. 283–288, doi:10.1039/A907691C.
- ↑ Y.-J. Chen, H.-H. Chen: 1,1,1-Tris(hydroxymethyl)ethane as a new, efficient, and versatile tripod ligand for copper-catalyzed cross-coupling reactions of aryl iodides with amides, thiols, and phenols. In: Org. Lett. Band 8, Nr. 24, 2006, S. 5609–5612, doi:10.1021/ol062339h.
- ↑ H. Kakiuchi, M. Yabe, M. Yamazaki: A study of trimethylolethane hydrate as a phase change material. In: J. Chem. Eng. Jpn. Band 36, Nr. 7, 2003, S. 788–793, doi:10.1252/jcej.36.788.
- ↑ Patent EP1113065A1: Heat-storage material composition. Angemeldet am 3. März 1999, veröffentlicht am 4. Juli 2001, Anmelder: Mitsubishi Chemical Corporation, Erfinder: M. Yabe, H. Kakiuchi, M. Yamazaki.