Zellmembran

1. Nucleolus (Kernkörperchen)
2. Zellkern (Nukleus)
3. Ribosomen
4. Vesikel
5. Raues (Granuläres) ER (Ergastoplasma)
6. Golgi-Apparat
7. Cytoskelett
8. Glattes (Agranuläres) ER
9. Mitochondrien
10. Lysosom
11. Cytoplasma (mit Cytosol und Cytoskelett)
12. Peroxisomen
13. Zentriolen
14. Zellmembran
| Übergeordnet |
|---|
| Zelle |
| Gene Ontology |
| QuickGO |

Zellmembran oder lateinisch Membrana cellularis, Zytomembran, Plasmamembran, auch Plasmalemma, wird die jeder lebenden Zelle eigene Biomembran genannt, die das Zellinnere umschließend und abgrenzend ihr inneres Milieu aufrechterhält.
Die Zellmembran von eukaryoten Zellen und Bakterien besteht aus einer zweilagigen Schicht von Lipiden (Lipiddoppelschicht) und verschiedenen Membranproteinen, die peripher, integral oder transmembranal darin eingelassen sind. Die hydrophilen, wasserlöslichen Pole der Lipiddoppelschicht bilden die innere und äußere Zellmembranoberfläche, wohingegen die hydrophoben, wasserabweisenden Pole der Lipiddoppelschicht zum Membranzentrum gerichtet sind. Die Zellmembran ist in Abhängigkeit von der Größe, der Fettlöslichkeit und der Ladung bestimmter Stoffe unterschiedlich gut bzw. schlecht durchlässig, sie ist also semipermeabel.[1] Mit etwa sechs bis zehn Nanometer Dicke ist sie lichtmikroskopisch nur vage als Linie zu ahnen. Die Zellmembran grenzt den Cytoplasmaraum einer Zelle gegen den Extrazellulärraum ab und stellt die Grenzfläche dar, über die ein Stoffaustausch mit der Umgebung stattfindet.
Darüber hinaus übernimmt die Zellmembran wesentliche Aufgaben bei Zell-Zell-Kontakten, Zell-Matrix-Verbindungen, Signalübermittlungen, Zellwanderungen und Zellformänderungen. Bei Prokaryoten ist sie auch Ort der Photosynthese oder der chemotrophen Bereitstellung von Energie und Anordnungsfläche für Photosysteme, Atmungskettenkomplexe und weitere Enzymsysteme. Die auswärtige, extrazelluläre Seite der Zellmembran ist bei allen Zellen auch strukturell verschieden von der inwendigen, intrazellulären Membranseite. Die Plasmamembran kann nach außen von einer Zellwand als schützende Hülle umgeben sein. Nach innen kann sie mit den Proteinen des Zytoskeletts in Verbindung stehen oder bei manchen Einzellern zur Pellicula versteift sein.
Organisation der Zellmembran
[Bearbeiten | Quelltext bearbeiten]Zusammensetzung
[Bearbeiten | Quelltext bearbeiten]Die Zellmembran besteht zunächst aus einer Vielzahl an unterschiedlichen membranogenen Lipiden in zwei einander zugewandten Lagen, die zusammen eine Lipiddoppelschicht bilden, lediglich bei einigen Archaeen ist sie als Lipidmonoschicht ausgebildet.[2] Ihre Hauptbestandteile sind Phospholipide, zumeist verschiedene Phosphoglyceride – hierzu zählen etwa Lecithine als Phosphatidylcholine (PC) und Kephaline als Phosphatidylethanolamine (PE) oder als Phosphatidylserine (PS) sowie auch Phosphatidylinositole (PI). Weitere wesentliche Membranbestandteile sind neben Sphingomyelin noch andere Sphingolipide und außerdem Sterine wie Cholesterin. Die nicht-steroidalen Lipidkomponenten unterscheiden sich außer in ihrer Kopfgruppe beispielsweise in dem Sättigungsgrad und der Kettenlänge von gebundenen Fettsäureresten. Zusätzlich können sie mit Kohlenhydratresten zu Glykolipiden modifiziert worden sein.
Außer Lipiden enthält die Zellmembran zudem eine Vielfalt spezifischer Membranproteine. Auf der Außenseite oder der Innenseite liegend dienen sie jeweils unterschiedlichen Aufgaben. Einige reichen als Transmembranprotein beide Seiten verbindend durch die Membran, so etwa Zelladhäsionsmoleküle, Ionenkanäle oder Rezeptoren für die Signaltransduktion durch die Membran. Ihre jeweilige Ausstattung mit Membranproteinen kennzeichnet eine Zelle somit nach bestimmten Funktionen. Doch schon die Zusammensetzung ihrer Lipide unterscheidet die Zellmembran von anderen Membranen der Zelle, die Zellorganellen einfassen.
Als äußerste Schicht der menschlichen Zelloberfläche bilden antennenförmige Zuckerketten von Glykoproteinen und Glykolipiden der Zellmembran – sowie eventuell solche der extrazellulären Matrix – eine kohlenhydratreiche Hülle, die sogenannte Glykokalyx. Diese schützt als erste Barriere die Zelle vor mechanischen und chemischen Einwirkungen, vermittelt Zell-Zell-Interaktionen und verhindert unerwünschte Protein-Protein-Kontakte zu anderen Zellen.[3][1]
Polarität
[Bearbeiten | Quelltext bearbeiten]Die Lipidzusammensetzung ist in Bezug auf die intrazelluläre/zytosolische Seite und die extrazelluläre Seite der Zytomembran unterschiedlich. Diese orientierte Organisation wird bewerkstelligt durch selektive Phospholipidtranslokatoren, Flippasen bzw. Floppasen genannt. Im Verlauf einer Apoptose wird diese Orientierung umgedreht und dient als Signal für die umgebenden Zellen.
Lipid rafts
[Bearbeiten | Quelltext bearbeiten]Sphingolipide und Cholesterin können innerhalb der Zellmembran Domänen formen, die sogenannten Lipid Rafts. Lipid rafts sind selektiv angereichert an bestimmten Membranproteinen entsprechend deren Transmembrandomänen und spielen eine Rolle im Clustern von Membranproteinen etwa im Verlauf einer Signalkaskade. Über die typische Größe und Lebensdauer von Lipid rafts gibt es gegenwärtig (2015) noch keinen Konsens.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mit der Zellmembran grenzt die Zelle einen ihr eigenen Raum ab, in dem andere Milieubedingungen möglich sind als in der Umgebung. In der Membran liegen oder „schwimmen“ nach dem Fluid-Mosaik-Modell unterschiedliche Membranproteine, die für Kontakte nach außen wichtig sind. Als Rezeptor-Proteine auf der Außenseite nehmen sie Reize auf oder empfangen Signale, als membrandurchspannende Proteine erlauben sie den Transport durch die Membran oder verankern die Zelle in der Umgebung oder verbinden sie mit anderen Zellen.
Viele der nach außen gerichteten peripheren Proteine und manche der Membranlipide tragen oft kurzkettige, teilweise bäumchenartig verzweigte Kohlenhydratverbindungen und werden daher auch als Glykoproteine beziehungsweise als Glykolipide bezeichnet. Insgesamt bilden diese Oberflächenstrukturen die Glykokalyx, die bei Zellen ohne Zellwand neben dem Zytoskelett für Stabilität sorgt. An charakteristischen Strukturen, auch Oberflächenantigene genannt, kann eine Zelle beispielsweise von Immunzellen erkannt werden – oder umgekehrt sich so ausweisen und identifizieren.
Auch kann die Zellmembran in besonderer Weise Moleküle, Molekülkomplexe oder größere Partikel aus der Umgebung binden. Weiterhin können darüber Verformungen der Zellmembran herbeigeführt werden, etwa Einbuchtungen. Kommt es über besondere Protein-Lipid-Interaktionen zur Einstülpung und Abschnürung von Zellmembranabschnitten, so werden damit Bereiche des umgebenden Mediums eingefasst und aufgenommen, was Endozytose genannt wird. Unterschieden wird hierbei nach eingeschlossenem Inhalt zwischen der Phagozytose fester Stoffe oder anderer Organismen und der Pinozytose von Flüssigkeitsmengen, beziehungsweise nach dem Volumen zwischen Nahrungsvakuolen und den kleineren Vesikeln.
Exozytose heißen Prozesse in umgekehrter Richtung, bei denen die Membran von Vesikeln mit der Zytomembran fusioniert und der Bläscheninhalt damit ausgeschleust wird in den umgebenden extrazellulären Raum. Bei eukaryoten Zellen ist die Bildung von Vesikeln auch durch Abschnürung innerer Membranen möglich, aus Hohlräumen des Endoplasmatischen Retikulums und des Golgi-Apparats. In der konstitutiven Exozytose dienen derartige Vesikel nicht der Sekretion eines besonderen Bläscheninhalts, sondern der Erweiterung oder dem Umbau der Zellmembran sowie dem Einbau von Membranproteinen.
Als Formänderungen der Zelle können zudem Regionen der Zellmembran vorgewölbt oder, weiter fortgesetzt, als Zellfortsatz vorgestülpt werden, gestützt durch ein Gerüst von Mikrotubuli des Zytoskeletts beispielsweise als Zilie. Anders als diese sind die Mikrovilli Sonderbildungen tierischer Zellmembranen – in Form pseudopodienartiger Ausstülpungen nach außen –, die von Aktinfilamenten getragen die Oberfläche der Membran vergrößern und zusammen den sogenannten Bürstensaum einer Zelle bilden. Bei Einzellern wie Amöben sind deren Scheinfüßchen ähnlich gebaute ausgestülpte Zellfortsätze, mit denen sie sich fortbewegen.
Alle Zellmembranen sind semipermeabel, sie sind für manche Stoffe durchlässig und für andere weniger oder gar nicht. Während für lipophile Moleküle die Lipidschicht keine Barriere darstellt, können kleine hydrophile diese nur durch Öffnungen wie Poren oder Kanäle passieren – wenn sie hindurchpassen und als geladenes Ion nicht abgestoßen werden – und für größere wie etwa Glucose ist zur Membranpassage ein unterstützter Transport durch besondere Carrier nötig. Die Proteine im Zytoplasma können, außer in exozytotischen Vesikeln, die Zellmembran nicht überwinden. Deshalb kommt es innerhalb der Zelle zu anderen Stoff- und Ladungsverteilungen als außerhalb. Damit entstehen über die Membran elektrochemische Gradienten, die zu einer Potentialdifferenz zwischen innen und außen führen. Alle Zellen haben daher ein Membranpotential, das vorwiegend durch Ionenkanäle und Ionenpumpen auf eine bestimmte Höhe eingestellt werden kann.
Elektrophysiologisch kann die Zellmembran vereinfacht als Plattenkondensator angesehen werden, dessen spezifische Kapazität bei Membranen verschiedener Zelltypen im Bereich von etwa 1 µF·cm−2 liegt.[4]
Kanäle, Transporter, Pumpen und Rezeptoren
[Bearbeiten | Quelltext bearbeiten]Die Zellmembran hat an der äußeren und inneren Oberfläche eine hydrophile, wasseranziehende, polare Kopfgruppe. Das Zentrum der Zellmembran kann als hydrophob verstanden werden. Diese doppellagige Lipidschicht ist für kleine Moleküle wie Wasser gut permeabel und für gelöste Gase (O2, CO2, N2) besitzt sie eine sehr gute Durchlässigkeit. Da die Membran für die meisten Stoffe auf Grund der Molekülgröße oder der Ladung (Ionen) weitgehend undurchlässig ist[5][1][3], kann innerhalb der Zelle ein besonderes Milieu eingerichtet werden, das sich von der wässrigen, äußeren Umgebung des Extrazellularraums unterscheidet. Den im Wasser gelösten Stoffen ist die Membranpassage durch besondere Poren, Kanäle oder Transporter möglich, deren Art und Anzahl von der Zelle bestimmt werden.[6]
Kanäle
[Bearbeiten | Quelltext bearbeiten]Bei Ionenkanälen handelt es sich um Proteine, die durch die Zellmembran reichen und einen hydrophilen Kanal bilden, den vorwiegend Ionen passieren können. Dabei ist der Transport passiv, die Ionen fließen den elektrochemischen Gradienten folgend entweder in die Zelle hinein oder aus ihr hinaus. Dieser Vorgang geschieht spontan (mit Abnahme freier Enthalpie, er ist exergon). Die Öffnung und Schließung eines Kanals kann in der Regel kontrolliert werden und wird z. B. durch elektrische Spannung oder über Signalstoffe gesteuert.[7]
Die meisten Zellen haben auch für Wasser spezifische Kanäle, sogenannte Aquaporine.[7]
Transporter
[Bearbeiten | Quelltext bearbeiten]Transporter oder Carrier ermöglichen Ionen oder kleinen hydrophilen Molekülen wie etwa Glukose oder Aminosäuren den Durchtritt. Sie werden durch die Membran gebracht, indem die jeweiligen Transportproteine eine Konformationsänderung durchmachen im Wechsel zwischen Konformationen, deren Bindungsstellen auf der einen oder der anderen Seite der Membran liegen. Nur wenn ein Konzentrationsgradient für den jeweiligen Stoff besteht, kommt es bilanziert zu dessen Transport (Uniport), weshalb hier auch von einer erleichterten Diffusion gesprochen wird.[7]
Der Cotransporter kann dem Transporter zugeordnet oder als eigenständig angesehen werden. Im Prinzip handelt es sich um einen Carrier, der zwei Stoffe gleichzeitig durch die Membran transportiert, entweder in gleiche Richtung (Symport) oder in Gegenrichtung (Antiport). Dabei folgt der eine Stoff meist passiv einem Gradienten, dessen treibende Kraft daneben genutzt werden kann, den anderen Stoff einem Gradienten entgegen zu transportieren. Man spricht in diesem Fall auch von sekundär aktivem Transport. Beispiele dafür sind der Natrium-Glukose-Symport im Darmepithel oder der Natrium-Wasserstoff-Antiport im proximalen Tubulus.[8]
Pumpen
[Bearbeiten | Quelltext bearbeiten]Pumpen transportieren Stoffe entgegen einem Gradienten durch die Zellmembran und bauen so Verteilungsunterschiede auf. Dieser primär aktive Transport kostet die Hydrolyse von ATP. Daher sind diese Pumpen zugleich Enzyme, die ATP spalten und die freiwerdende Gibbs-Energie für den Transport verwenden; sie werden deshalb auch als Transport-ATPase bezeichnet. Beispiele dafür sind Ionenpumpen, wie die Natrium-Kalium-Pumpe, oder die Calcium-Pumpe des Endoplasmatischen Retikulums.[9]
Zellmembran von Archaeen
[Bearbeiten | Quelltext bearbeiten]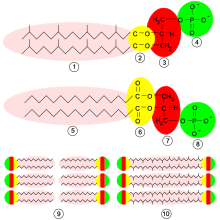
Bei Archaeen zeigt die Zellmembran oft einen besonderen Aufbau. So finden sich öfters als Lipidkomponente nicht Fettsäuren, sondern Isoprenoid-Alkohole, die mit Glycerin nicht über eine Ester-, sondern Etherbildung verknüpft sind. Es kommen dabei auch Isoprenoide vor, welche zu beiden Seiten Bindungen eingehen und (als Bola-Lipide) somit beide Lagen der Lipidschicht verbindend die Membran durchziehen und verspannen.[10] Die Zellmembran dieser Organismen wird mit solchen Di- und Tetraethern einlagig arrangiert und wesentlich temperatur- und säurestabiler.[11] Dies ermöglicht es Archaeen, auch Habitate mit extremen Umgebungsbedingungen zu besiedeln, beispielsweise heiße Thermalquellen.
Evolutionäre Ursprünge
[Bearbeiten | Quelltext bearbeiten]Die entwicklungsgeschichtlichen Ursprünge von Zellmembranen und damit von Zellen und zellulären Organismen überhaupt werden bei alkalischen Hydrothermalquellen (Weiße Raucher, heutiges Beispiel: Lost City) vermutet.[12] Im Januar 2024 von Purvis et al. veröffentlichte Ergebnisse unterstützen diese Annahme.[13]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Plasmamembran als Fluid Mosaikmodell dargestellt mit Aufbau und Funktion im Zusammenhang der Zellbiologie – Graphik
- Miniaturbildübersicht Zellmembran (Membrana cellularis)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Stephan Dönitz: Mensch Körper Krankheit für den Rettungsdienst. Hrsg.: Frank Flake. 1. Auflage. Elsevier, 2015, ISBN 978-3-437-46201-6, S. 37.
- ↑ Frank Hoffmann: Charakterisierung von chiralen Langmuir-Filmen mit Hilfe von IR-spektroskopischen, thermodynamischen und abbildenden Methoden sowie biomimetische Ansätze zur Aufklärung der Wirkweise des antibiotischen Peptids Surfactin. Diss. Univ. Hamburg 2002, S. 6 (d-nb.info PDF).
- ↑ a b Agamemnon Despopoulos: Taschenatlas Physiologie. 8., überarb. u. erw. Auflage. Thieme, Stuttgart 2012, ISBN 978-3-13-567708-8.
- ↑ Gerold Adam, Peter Läuger, Günther Stark: Physikalische Chemie und Biophysik. 5. Auflage. Springer-Verlag, 2009, ISBN 978-3-642-00424-7, S. 359 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Günther Jung: Organische Chemie. Grundlagen, Verbindungsklassen, Reaktionen, Konzepte, Molekülstruktur, Naturstoffe. 6., überarb. Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-541506-2, S. 936 (mit 133 Tabellen).
- ↑ Renate Lüllmann-Rauch unter Mitarbeit von Esther Asan: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 11.
- ↑ a b c Renate Lüllmann-Rauch unter Mitarbeit von Esther Asan: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 12.
- ↑ Renate Lüllmann-Rauch unter Mitarbeit von Esther Asan: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 12 und 13.
- ↑ Renate Lüllmann-Rauch unter Mitarbeit von Esther Asan: Taschenlehrbuch Histologie. 5. Auflage. Thime, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 13.
- ↑ A. Pearson, Y. Pi, W. Zhao, W. Li, Y. Li, W. Inskeep, A. Perevalova, C. Romanek, S. Li, C. Zhang: Factors Controlling the Distribution of Archaeal Tetraethers in Terrestrial Hot Springs. In: Applied and Environmental Microbiology. Band 74, Nr. 11, Juni 2008, ISSN 0099-2240, S. 3523–3532, doi:10.1128/AEM.02450-07, PMID 18390673 (asm.org [PDF]).
- ↑ E. Boyd, T. Hamilton, J. Wang, L. He, C. Zhang: The Role of Tetraether Lipid Composition in the Adaptation of Thermophilic Archaea to Acidity. In: Frontiers in Microbiology. Band 4, Nr. 62, April 2013, ISSN 1664-302X, doi:10.3389/fmicb.2013.00062, PMID 23565112, PMC 3615187 (freier Volltext).
- ↑ Nick Lane: Der Funke des Lebens – Energie und Evolution, Konrad Theiss Verlag, (C) 2017 by WBG, ISBN 978-3-8062-3484-8, Kapitel 3: Energie und Ursprung des Lebens. Englischer Originaltitel: Nick Lane: The Vital Question – Why Is Life The Way It Is? Energy, Evolution, and the Origins of Complex Life, 2015-07-20, ISBN 978-0-393-08881-6, PDF ( vom 10. September 2017 im Internet Archive). In der deutschen Ausgabe heißt es 'alkaline hydrothermale Schlote' statt korrekt 'alkalische'.
- ↑
Graham Purvis, Lidija Šiller, Archie Crosskey, Jupiter Vincent, Corinne Wills, Jake Sheriff, Cijo Xavier, Jon Telling: Generation of long-chain fatty acids by hydrogen-driven bicarbonate reduction in ancient alkaline hydrothermal vents. In: Nature: Communications Earth & Environment, Band 5, Nr. 30, 10. Januar 2024; doi:10.1038/s43247-023-01196-4 (englisch). Dazu:
- Claudia Krapp: Biochemie: Wie die ersten Ur-Membranen entstanden – Ursprünge des irdischen Lebens könnten in warmen Quellen liegen. Auf: scinexx.de vom 23. Januar 2024.
- Russell McLendon: The Very First Cells Could Have Bubbled Out of Hot Springs on The Ocean Floor. Auf: sciencealert vom 24. Januar 2024.Anm.: Das zweite Bild zeigt einen heißen Schwarzen Raucher – hier sind aber die alkalischen Weißen Raucher gemeint, wie das im ersten Bild gezeigte Champagne-Feld am Eifuku.