„Dimethyltryptamin“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Literatur: wikilink |
培养皿 (Diskussion | Beiträge) →Literatur: + lit |
||
| Zeile 61: | Zeile 61: | ||
* Jonathan Ott: ''Ayahuasca Analoge'' (ISBN 3-930442-08-6) |
* Jonathan Ott: ''Ayahuasca Analoge'' (ISBN 3-930442-08-6) |
||
* Steven A. Barker, Ethan H. McIlhenny, Rick Strassman: ''A critical review of reports of endogenous psychedelic N, N-dimethyltryptamines in humans: 1955-2010.'' In: ''[[Drug Testing and Analysis]].'' 4, 2012, S. 617–635, {{DOI|10.1002/dta.422}}. |
* Steven A. Barker, Ethan H. McIlhenny, Rick Strassman: ''A critical review of reports of endogenous psychedelic N, N-dimethyltryptamines in humans: 1955-2010.'' In: ''[[Drug Testing and Analysis]].'' 4, 2012, S. 617–635, {{DOI|10.1002/dta.422}}. |
||
* Attila Szabo, Attila Kovacs u. a.: ''Psychedelic N,N-Dimethyltryptamine and 5-Methoxy-N,N-Dimethyltryptamine Modulate Innate and Adaptive Inflammatory Responses through the Sigma-1 Receptor of Human Monocyte-Derived Dendritic Cells.'' In: ''PLoS ONE.'' 9, 2014, e106533, {{DOI|10.1371/journal.pone.0106533}}. |
|||
== Weblinks == |
== Weblinks == |
||
Version vom 30. August 2014, 16:02 Uhr
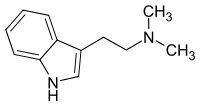
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Dimethyltryptamin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel |
| ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse |
| ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,096 g·cm−1 (Base)[3] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| pKS-Wert |
8,68 [5] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
N,N-Dimethyltryptamin, kurz DMT, ist ein halluzinogenes Tryptamin-Alkaloid, welches in etlichen Pflanzen, in den Hautdrüsensekreten der Aga-Kröte sowie auch in Spuren im Menschen und in Säugetieren zu finden ist.[8][9][10] Es findet auch Anwendung als Halluzinogen bzw. Entheogen, indem es geraucht (Freibase), geschnupft (als Yopo) oder injiziert (Fumarat) wird.[11] Die perorale Aufnahme (als Ayahuasca) wird nur bei gleichzeitiger bzw. vorheriger Einnahme von Monoaminooxidase-Hemmern (kurz MAOH oder MAOI) erreicht, da DMT sehr rasch (First-Pass-Effekt) vom körpereigenen Enzym Monoaminooxidase abgebaut wird.[11]
Wirkungen
Bei exogener Zufuhr wirkt DMT intensiv auf den visuellen Cortex des Gehirns ein und führt zu einer ausgeprägten Veränderung des visuellen Erlebens. Der Konsument bleibt sich in der Regel der Tatsache bewusst, dass er berauscht ist, und unterliegt im strengeren Sinn keinen halluzinierten Sinnestäuschungen, sondern extremen Formen von Pseudohalluzinationen. Höhere Dosierungen führen teils zum Erleben anderer Wirklichkeiten, die durchaus als real existent erfahren werden. Bei oraler Einnahme, kombiniert mit MAO-Hemmern, stellt sich meist Erbrechen ein, teils begleitet von Durchfall.
Pharmakologie
DMT wirkt als Voll-Agonist am 5-HT2A-Rezeptor[12] und bindet sich nichtselektiv mit Bindungsaffinitäten < 0,6 μM an folgende Serotonin-Rezeptoren: 5-HT1A, 5-HT1B, 5-HT1D, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT6 und 5-HT7.[13][14][15][16][17] Auch bindet sich DMT an den Sigma-1-Rezeptor, was als Hinweis für seine Rolle als endogener Neurotransmitter gedeutet wird.[18][19] Im Gegensatz zu typverwandten Halluzinogenen wie LSD, Psilocin und Meskalin bildet DMT keine Toleranz aus, der Grund dafür ist unklar.[20]
Vorkommen
DMT ist der Hauptwirkstoff von Ayahuasca, einem kultisch verwendeten Gebräu indigener Kulturen Südamerikas. Ayahuasca besteht aus einer DMT-Quelle (meist Psychotria viridis oder Diplopterys cabrerana) sowie monoaminooxidasehemmender Zutaten (meist Banisteriopsis caapi, eine Lianenart).[21]
Weitere Pflanzen, in denen DMT mit erhöhtem Anteil enthalten ist, sind Mimosa hostilis, Anadenanthera peregrina, Codariocalyx motorius (Telegrafenpflanze), Phalaris arundinacea (Rohrglanzgras) und andere Unterarten sowie viele Arten der Gattung Acacia.
Rechtsstatus in der Bundesrepublik Deutschland
DMT ist in der Bundesrepublik Deutschland gemäß Betäubungsmittelrecht aufgrund seiner Aufführung in der Anlage 1 BtMG ein nicht verkehrsfähiges Betäubungsmittel. Der Umgang ohne Erlaubnis ist grundsätzlich strafbar.
Literatur
- Rick Strassman: DMT, Das Molekül des Bewusstseins, AT Verlag, Baden 2004, ISBN 3-85502-967-9
- Bert Marco Schuldes: Psychoaktive Pflanzen, Nachtschatten Verlag, ISBN 3-925817-64-6
- Jonathan Ott: Ayahuasca Analoge (ISBN 3-930442-08-6)
- Steven A. Barker, Ethan H. McIlhenny, Rick Strassman: A critical review of reports of endogenous psychedelic N, N-dimethyltryptamines in humans: 1955-2010. In: Drug Testing and Analysis. 4, 2012, S. 617–635, doi:10.1002/dta.422.
- Attila Szabo, Attila Kovacs u. a.: Psychedelic N,N-Dimethyltryptamine and 5-Methoxy-N,N-Dimethyltryptamine Modulate Innate and Adaptive Inflammatory Responses through the Sigma-1 Receptor of Human Monocyte-Derived Dendritic Cells. In: PLoS ONE. 9, 2014, e106533, doi:10.1371/journal.pone.0106533.
Weblinks
- DMT. In: Erowid. (englisch)
- isomerdesign.com: DMT (englisch)
- Vorlage:IMDb Titel
Einzelnachweise
- ↑ Qu, Shi-Jin; Tan, Chang-Heng; Zhu, Da-Yuan; Wang, Gui-Feng; Zuo, Jian-Ping; Duan, Wen-Hu; Yao, Shan-Yan: Tryptamine derivatives as novel non-nucleosidic inhibitors against hepatitis B virus in Bioorg. Med. Chem. 19 (2011) 3120–3127, doi:10.1016/j.bmc.2011.04.004.
- ↑ a b Royal Pharmaceutical Society (Hrsg.): Clarke's Analysis of Drugs and Poisons FOURTH EDITION. Pharmaceutical Press, London/Chicago 2011, ISBN 978-0-85369-711-4.
- ↑ R. Bergin, D. Carlström, G. Falkenberg, H. Ringertz: Preliminary X-ray crystallographic study of some psychoactive indole bases in Acta Cryst. B 24 (1968) 882, doi:10.1107/S0567740868003353.
- ↑ Eintrag zu 'N,N-Dimethyltryptamin. In: Römpp Online. Georg Thieme Verlag
- ↑ a b Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Datenblatt DMT (PDF; 38 kB) bei Tocris Bioscience, abgerufen 8. März 2013.
- ↑ Barker S.A., Monti J.A., Christian S.T.: N, N-dimethyltryptamine: an endogenous hallucinogen. In: International Review of Neurobiology. 22. Jahrgang, 1981, S. 83–110, doi:10.1016/S0074-7742(08)60291-3, PMID 6792104.
- ↑ Wallach J.V.: Endogenous hallucinogens as ligands of the trace amine receptors: a possible role in sensory perception. In: Medical Hypotheses. 72. Jahrgang, Nr. 1, Januar 2009, S. 91–4, doi:10.1016/j.mehy.2008.07.052, PMID 18805646.
- ↑ M. A. Thompson: Rabbit Lung Indolethylamine N-Methyltransferase. cDNA AND GENE CLONING AND CHARACTERIZATION. In: Journal of Biological Chemistry. 273, , S. 34502–34510, doi:10.1074/jbc.273.51.34502.
- ↑ a b Rick Strassman: DMT, Das Molekül des Bewusstseins, AT Verlag, Baden 2004, ISBN 3-85502-967-9
- ↑ Smith RL, Canton H, Barrett RJ, Sanders-Bush E: Agonist properties of N,N-dimethyltryptamine at serotonin 5-HT2A and 5-HT2C receptors. In: Pharmacol. Biochem. Behav. 61. Jahrgang, Nr. 3, November 1998, S. 323–30, doi:10.1016/S0091-3057(98)00110-5, PMID 9768567.
- ↑ Keiser M.J., Setola V., Irwin J.J., Laggner C., Abbas A.I., Hufeisen S.J., Jensen N.H. et al.: Predicting new molecular targets for known drugs. In: Nature. 462. Jahrgang, Nr. 7270, November 2009, S. 175–81, doi:10.1038/nature08506, PMID 19881490, PMC 2784146 (freier Volltext).
- ↑ Deliganis A.V., Pierce P.A., Peroutka S.J.: Differential interactions of dimethyltryptamine (DMT) with 5-HT1A and 5-HT2 receptors. In: Biochemical Pharmacology. 41. Jahrgang, Nr. 11, Juni 1991, S. 1739–44, doi:10.1016/0006-2952(91)90178-8, PMID 1828347.
- ↑ Pierce P.A., Peroutka S.J.: Hallucinogenic drug interactions with neurotransmitter receptor binding sites in human cortex. In: Psychopharmacology. 97. Jahrgang, Nr. 1, 1989, S. 118–22, doi:10.1007/BF00443425, PMID 2540505 (springerlink.com [PDF]).
- ↑ Smith R.L., Canton H., Barrett R.J., Sanders-Bush E.: Agonist properties of N,N-dimethyltryptamine at serotonin 5-HT2A and 5-HT2C receptors. In: Pharmacology, Biochemistry, and Behavior. 61. Jahrgang, Nr. 3, November 1998, S. 323–30, doi:10.1016/S0091-3057(98)00110-5, PMID 9768567.
- ↑ Ray T.S.: Psychedelics and the Human Receptorome. In: PLoS ONE. 5. Jahrgang, Nr. 2, 2010, S. e9019, doi:10.1371/journal.pone.0009019, PMID 20126400, PMC 2814854 (freier Volltext) – (plos.org).
- ↑ Fontanilla D., Johannessen M., Hajipour A.R., Cozzi N.V., Jackson M.B., Ruoho A.E.: The Hallucinogen N,N-Dimethyltryptamine (DMT) Is an Endogenous Sigma-1 Receptor Regulator. In: Science. 323. Jahrgang, Nr. 5916, Februar 2009, S. 934–7, doi:10.1126/science.1166127, PMID 19213917, PMC 2947205 (freier Volltext) – (sciencemag.org).
- ↑ Su T.P., Hayashi T., Vaupel D.B.: When the Endogenous Hallucinogenic Trace Amine N,N-Dimethyltryptamine Meets the Sigma-1 Receptor. In: Science Signaling. 2. Jahrgang, Nr. 61, 2009, S. pe12, doi:10.1126/scisignal.261pe12, PMID 19278957, PMC 3155724 (freier Volltext).
- ↑ D. E. Nichols: Hallucinogens. In: Pharmacology & Therapeutics. Band 101, Nummer 2, Februar 2004, S. 131–181, ISSN 0163-7258. doi:10.1016/j.pharmthera.2003.11.002. PMID 14761703.
- ↑ Dennis J. McKenna, G.H.N. Towers, et al.: Monoamine oxidase inhibitors in South American hallucinogenic plants: Tryptamine and ß-carboline constituents of Ayahuasca. In: Journal of Ethnopharmacology. 10, 1984, S. 195–223, doi:10.1016/0378-8741(84)90003-5.