„Rhodopsin“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Einleitung: Unnötiges entfernt/verschoben, Nötiges ergänzt, bequellt, verständlicher, kein Mensch nennt Rh. mehr Sehpurpur |
|||
| Zeile 37: | Zeile 37: | ||
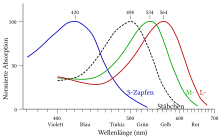
[[Datei:Cone-response-de(2).svg|miniatur|Normalisierte Absorptionsspektren der drei menschlichen Photopsine und des menschlichen Rhodopsins (gestrichelt)]] |
[[Datei:Cone-response-de(2).svg|miniatur|Normalisierte Absorptionsspektren der drei menschlichen Photopsine und des menschlichen Rhodopsins (gestrichelt)]] |
||
'''Rhodopsin''' |
'''Rhodopsin''' (vor allem in älteren Lehrbüchern und Forschungsarbeiten wegen seiner Farbe auch '''Sehpurpur''' genannt), ist ein lichtempfindliches [[Rezeptor|Rezeptorprotein]]. Rhodopsin ist eines der Sehpigmente in der [[Netzhaut]] (Retina) der [[Auge]]n von [[Wirbeltiere]]n (Vertebraten), in den [[Facettenauge]]n der Insekten und in den [[Photorezeptor]]en von anderen [[Wirbellose]]n (Invertebraten).<ref name="mueller">{{Literatur|Autor=Werner A. Müller, Stephan Frings, Frank Möhrlen|Titel=Tier- und Humanphysiologie: Eine Einführung|Kapitel=Der Sehsinn|Seiten=605|Verlag=Springer Spectrum|Ort=Berlin|Datum=2019|ISBN= 978-3-662-58461-3| Online=[https://books.google.de/books?id=qfacDwAAQBAJ&pg=PA605&f=false#v=onepage&q&f=false]}}</ref> Darüber hinaus kommen Rhodopsine (siehe [[Bacteriorhodopsin|Bakteriorhodopsin]] und [[Channelrhodopsin]]) auch in [[Bakterien]], [[Archaeen|Archaebakterien]] und einzelligen Algen vor.<ref>{{Internetquelle|url=https://www.mpg.de/optogenetik/oesterhelt|autor=Christina Beck|titel=Einzeller bringen Licht in die Neurobiologie|hrsg=www.mpg.de|datum=2014-11-20|zugriff=2019-10-02}}</ref> |
||
Beim Menschen und in den meisten Wirbeltieraugen ist das Rhodopsin in den [[Stäbchen (Auge)|Stäbchen]] der Netzhaut für das Hell-Dunkel-Sehen bei geringer Helligkeit ([[Skotopisches Sehen]]) verantwortlich. Dagegen beruht das [[Farbensehen]] bzw. Tagsehen mit Hilfe der [[Zapfen (Auge)|Zapfen]] auf drei, bei einer Reihe von Tierarten auch vier verschiedenen Varianten des [[Iodopsin]]s, eines verwandten Sehpigments.<ref name="mueller" /> |
|||
== Details == |
== Details == |
||
| Zeile 47: | Zeile 47: | ||
== Medizinischer Bezug == |
== Medizinischer Bezug == |
||
[[Mutation]]en im Opsin-Gen können zu einer [[Retinitis pigmentosa]] und erblicher [[Nachtblindheit]] führen. |
|||
Ein Mangel an [[Vitamin A]] als Quelle des Retinals führt zu [[Nachtblindheit]], Trockenheit des Auges (Xerophthalmie) sowie einer Hornhautentzündung (Keratitis) des Auges. Bei Kindern kann Vitamin-A-Mangel zur Erblindung führen. Dies tritt wegen der auf Reis basierenden Ernährung besonders häufig in Ländern der Dritten Welt auf. Der [[Recommended Daily Allowance|Tagesbedarf]] eines Erwachsenen an Vitamin A ist nach [[Richtlinie (EU)|Europäischer Richtlinie]] 90/496/EWG (EU-Nährwertkennzeichnungsrichtlinie) mit 800 µg festgelegt.<ref name=EURDAaktuell>{{EG-RL|2008|285|format=PDF}} der Kommission vom 28. Oktober 2008 zur Änderung der Richtlinie 90/496/EWG des Rates über die Nährwertkennzeichnung von Lebensmitteln hinsichtlich der empfohlenen Tagesdosen, der Umrechnungsfaktoren für den Energiewert und der Definitionen.</ref> |
Ein Mangel an [[Vitamin A]] als Quelle des Retinals führt zu [[Nachtblindheit]], Trockenheit des Auges (Xerophthalmie) sowie einer Hornhautentzündung (Keratitis) des Auges. Bei Kindern kann Vitamin-A-Mangel zur Erblindung führen. Dies tritt wegen der auf Reis basierenden Ernährung besonders häufig in Ländern der Dritten Welt auf. Der [[Recommended Daily Allowance|Tagesbedarf]] eines Erwachsenen an Vitamin A ist nach [[Richtlinie (EU)|Europäischer Richtlinie]] 90/496/EWG (EU-Nährwertkennzeichnungsrichtlinie) mit 800 µg festgelegt.<ref name=EURDAaktuell>{{EG-RL|2008|285|format=PDF}} der Kommission vom 28. Oktober 2008 zur Änderung der Richtlinie 90/496/EWG des Rates über die Nährwertkennzeichnung von Lebensmitteln hinsichtlich der empfohlenen Tagesdosen, der Umrechnungsfaktoren für den Energiewert und der Definitionen.</ref> |
||
Version vom 4. Oktober 2019, 02:08 Uhr
| Rhodopsin | ||
|---|---|---|

| ||
| Dreidimensionales Strukturmodell des Backbones von Rhodopsin. In der Mitte (hellgrau) ist das für die Signalkaskade wichtige 11-cis-Retinal zu sehen. Nach PDB 1L9H. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 348 Aminosäuren | |
| Sekundär- bis Quartärstruktur | multipass Membranprotein | |
| Bezeichner | ||
| Gen-Name | RHO | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Zweiseitentiere[1] (Opsine) | |
Rhodopsin (vor allem in älteren Lehrbüchern und Forschungsarbeiten wegen seiner Farbe auch Sehpurpur genannt), ist ein lichtempfindliches Rezeptorprotein. Rhodopsin ist eines der Sehpigmente in der Netzhaut (Retina) der Augen von Wirbeltieren (Vertebraten), in den Facettenaugen der Insekten und in den Photorezeptoren von anderen Wirbellosen (Invertebraten).[2] Darüber hinaus kommen Rhodopsine (siehe Bakteriorhodopsin und Channelrhodopsin) auch in Bakterien, Archaebakterien und einzelligen Algen vor.[3]
Beim Menschen und in den meisten Wirbeltieraugen ist das Rhodopsin in den Stäbchen der Netzhaut für das Hell-Dunkel-Sehen bei geringer Helligkeit (Skotopisches Sehen) verantwortlich. Dagegen beruht das Farbensehen bzw. Tagsehen mit Hilfe der Zapfen auf drei, bei einer Reihe von Tierarten auch vier verschiedenen Varianten des Iodopsins, eines verwandten Sehpigments.[2]
Details
Rhodopsin ist ein Protein, das aus Stäbchen-Opsin (Skotopsin) und dem ungesättigten Aldehyd 11-cis-Retinal zusammengesetzt ist. Das 11-cis-Retinal (Aldehyd des Retinols) ist an die ε-Aminogruppe der Lysin-Einheit K256 des Proteins als Imin (Schiffsche Base) kovalent gebunden. Sein Absorptionsmaximum im sichtbaren Bereich liegt bei λ = 500 nm.[4] Am Beginn des Sehprozesses führt der Einfall von Licht zu einer Isomerisierung des Retinals (11-cis-Retinal → all-trans-Retinal). Hierfür wird nur ein Photon ausreichender Energie benötigt. Dadurch kommt es zu einer Konformationsänderung im Opsin, was über die Aktivierung des G-Proteins Transducin zur Auslösung der visuellen Signaltransduktion führt.
Rhodopsin ist ein Vertreter einer Proteinfamilie von G-Protein gekoppelten Rezeptoren (GPCR). Das Charakteristische an dieser Familie sind sieben Transmembrandomänen und ein Rezeptor, der durch Anlagerung eines Liganden das G-Protein aktiviert (indem GTP an G-Protein angelagert wird und das in inaktivem Zustand dort befindliche GDP ersetzt). Bovines Rhodopsin war der erste GPCR, von dem eine durch Röntgenstrukturanalyse gewonnene Kristallstruktur vorlag. Er dient daher als Vorlage für Modelle anderer GPCRs, auch wenn die Übereinstimmung in der Primärstruktur teilweise sehr gering ist. Seit dem 21. Oktober 2007 ist aber auch eine Kristallstruktur des menschlichen β2-Adrenozeptors publiziert. Im Juni 2008 folgten Strukturen des β1-Adrenozeptors vom Truthuhn (Meleagris gallopavo) und des Rhodopsins des Japanischen Fliegenden Kalmars (Todarodes pacificus).
Medizinischer Bezug
Mutationen im Opsin-Gen können zu einer Retinitis pigmentosa und erblicher Nachtblindheit führen.
Ein Mangel an Vitamin A als Quelle des Retinals führt zu Nachtblindheit, Trockenheit des Auges (Xerophthalmie) sowie einer Hornhautentzündung (Keratitis) des Auges. Bei Kindern kann Vitamin-A-Mangel zur Erblindung führen. Dies tritt wegen der auf Reis basierenden Ernährung besonders häufig in Ländern der Dritten Welt auf. Der Tagesbedarf eines Erwachsenen an Vitamin A ist nach Europäischer Richtlinie 90/496/EWG (EU-Nährwertkennzeichnungsrichtlinie) mit 800 µg festgelegt.[5]
Verwandte Themen
Ein ähnliches Molekül, das Bakteriorhodopsin, findet sich in Halobakterien. Es enthält ebenfalls Retinal und ist ebenfalls aus sieben Transmembran-Domänen aufgebaut. Jedoch ist es nicht an ein G-Protein gekoppelt. Es handelt sich um eine lichtgetriebene Protonenpumpe.
In höheren grünen Pflanzen fungiert hingegen Phytochrom als Lichtrezeptor, das ebenso wie Rhodopsin in verschiedenen Zuständen vorkommen kann und der Pflanze damit Auskunft über die gerade vorhandenen Lichtbedingungen gibt.
Siehe auch
Weblinks
Einzelnachweise
- ↑ Suchergebnis UniProt Opsins by Taxonomy.
- ↑ a b Werner A. Müller, Stephan Frings, Frank Möhrlen: Tier- und Humanphysiologie: Eine Einführung. Springer Spectrum, Berlin 2019, ISBN 978-3-662-58461-3, Der Sehsinn, S. 605 ([1]).
- ↑ Christina Beck: Einzeller bringen Licht in die Neurobiologie. www.mpg.de, 20. November 2014, abgerufen am 2. Oktober 2019.
- ↑ Bowmaker & Mollon: Human rods and cones. 1983, Wertetabelle bei 500 nm (Colour and Vision Research Labs).
- ↑ Vorlage:EG-RL der Kommission vom 28. Oktober 2008 zur Änderung der Richtlinie 90/496/EWG des Rates über die Nährwertkennzeichnung von Lebensmitteln hinsichtlich der empfohlenen Tagesdosen, der Umrechnungsfaktoren für den Energiewert und der Definitionen.