Chlorethan
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
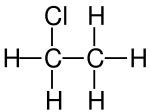
| |||||||||
| Allgemeines | |||||||||
| Name | Chlorethan | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C2H5Cl | ||||||||
| Kurzbeschreibung |
farbloses Gas mit etherartigem Geruch[1] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 64,51 g·mol−1 | ||||||||
| Aggregatzustand |
gasförmig | ||||||||
| Dichte |
2,884 kg·m−3 (15 °C)[2] | ||||||||
| Schmelzpunkt | |||||||||
| Siedepunkt |
13,1 °C[2] | ||||||||
| Dampfdruck | |||||||||
| Löslichkeit | |||||||||
| Dipolmoment | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| MAK | |||||||||
| Thermodynamische Eigenschaften | |||||||||
| ΔHf0 |
−112,1 kJ/mol[7] | ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Chlorethan ist eine chemische Verbindung, die synthetisch als Ethylierungsreagenz eingesetzt werden kann. Weitere Namen sind Aethylchlorid, Chloräthyl, Monochloräthan, Chlorwasserstoffäther, leichter Salzäther, Kelen und Chelen.
Gewinnung und Darstellung
Chlorethan kann bei erhöhten Temperaturen unter Aluminiumchlorid-Katalyse durch Chlorwasserstoff-Addition an Ethen hergestellt werden. Der Prozess ist exotherm.
Eigenschaften
Physikalische Eigenschaften
Chlorethandämpfe sind schwerer als Luft und reichern sich am Boden an ("Schwergas"). Es besitzt eine kritische Temperatur von 187,2 °C, einen kritischen Druck von 52,7 bar, eine kritische Dichte von 0,331 kg/l und eine Tripelpunkt-Temperatur von −138,3 °C (Schmelztemperatur).[2]
Chemische Eigenschaften
Chlorethan ist unter Normalbedingungen gasförmig, sehr reaktionsfreudig und lichtempfindlich. Bei der thermischen Zersetzung unter Sauerstoffausschluss entsteht Chlorwasserstoff und Ethylen. An Luft und unter Lichteinwirkung zersetzt es sich langsam unter Bildung von Chlorwasserstoff und Phosgen.[2]
Verwendung
Chlorethan wird wegen der schwierigen Handhabung praktisch nur industriell genutzt, etwa als Ethylierungs-, Löse- und Extraktionsmittel.[2] In der Medizin dient es zur Lokalanästhesie (Vereisung).[8] Industriell war Chlorethan ein wichtiger Ausgangsstoff zur Herstellung des Antiklopf-Additivs Tetraethylblei für Kraftstoffe. In der Zahnmedizin dient es zur Sensibilitätsprüfung der Zähne („Vitalitätsprüfung“).
Chlorethan wurde früher auch als Einleitungsnarkotikum verwendet, nicht aber für Vollnarkosen, da die therapeutische Breite hierfür zu gering ist.[9]
Sicherheitshinweise
Chlorethan ist hochentzündlich und gesundheitsschädlich, möglicherweise sogar krebserregend.
Das Gas wirkt stark betäubend; bereits 4 % in der Atemluft verursachen Narkose.[1]
Schon narkotische Konzentrationen können zu Kammerflimmern und Herzstillstand führen, höhere Konzentrationen (6 %) nach kurzer Zeit zu Atemlähmung.[2]
Einzelnachweise
- ↑ a b Eintrag zu Ethylchlorid. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d e f g h i j k l Eintrag zu Chlorethan in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Datenblatt Chlorethan bei Merck
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ Eintrag zu Chloroethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ Johannes Petres, Rainer Rompel: Operative Dermatologie: Lehrbuch und Atlas. 2. Auflage, Springer-Verlag, Heidelberg 2006, ISBN 978-3-540-34086-7, S. 44.
- ↑ Harry Auterhoff, Lehrbuch der pharmazeutischen Chemie, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1968



