Cuban-1,4-dicarbonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
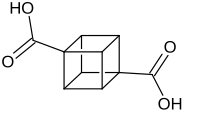
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cuban-1,4-dicarbonsäure | ||||||||||||||||||
| Andere Namen |
Pentacyclo[4.2.0.02,5.03,8.04,7]octan-1,4-dicarbonsäure (IUPAC) | ||||||||||||||||||
| Summenformel | C10H8O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 192,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Cuban-1,4-dicarbonsäure ist eine chemische Verbindung aus der Gruppe der Dicarbonsäuren. Sie bildet sich aus dem Grundgerüst des Cuban-Moleküls und besitzt an erster und vierter Stelle jeweils eine Carboxygruppe (–COOH). Die Cuban-1,4-dicarbonsäure ist eine Basisverbindung für die Synthese weiterer substituierter Cubanverbindungen und lässt sich über wenige, recht komplexe Schritte in das würfelförmige Molekül Cuban umwandeln.[2]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Mit der Entdeckung des Cuban-Moleküls, welches zuerst, aufgrund der Bindungswinkel von 90° als äußerst instabil galt, wurde die Cuban-1,4-dicarbonsäure entdeckt. Die Darstellung der Cuban-1,4-dicarbonsäure erfolgte allerdings erst, als die neue Syntheseroute die alte ablöste, welche ebenso von Philip Eaton aufgestellt und 1964 erstmalig durchgeführt und publiziert wurde.[3][4] In der ersten Syntheseroute wurde lediglich die Monocarbonsäure als Zwischenprodukt isoliert (siehe: Cuban).[3]
Synthese[Bearbeiten | Quelltext bearbeiten]

Durch die neue Syntheseroute, welche viele Stufen erspart und gleichzeitig kostengünstiger ist, erhält sich die Cuban-1,4-dicarbonsäure nach bereits sechs Stufen.[5]
Das Edukt der Synthese ist Cyclopentanon. Dieses wird im ersten Schritt mittels Ethylenglykol zum cyclischen Ethylenketal umgewandelt. Durch Bromierung entsteht das dreifach bromierte 2,2,5-Tribromcyclopentanonethylenketal, welches nach Dehydrohalogenierung und Diels-Alder-Reaktion in ein polycyclisches Diels-Alder-Zwischenprodukt überführt wird. Durch anschließende Entschützung mit Schwefelsäure entsteht das Diels-Alder-Diketon. Eine intramolekulare photochemische [2+2]-Cycloaddition führt zu dem Decahedron. Durch eine Faworski-Reaktion wird die Cuban-1,4-dicarbonsäure erhalten.[2][5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
So wie das Cuban-Molekül ist die Cuban-1,4-dicarbonsäure trotz der speziellen Bindungswinkel ein stabiles Molekül.[2] Es wurde bereits erforscht, dass die Carboxygruppen der Dicarbonsäure mit nahezu allen funktionellen Gruppen substituiert werden können.[2]
Substitutionen und Reaktionen[Bearbeiten | Quelltext bearbeiten]
Durch radikalische Chlorierung lässt sich die Dicarbonsäure in ein monochloriertes Derivat umwandeln. Die Ausbeuten bei diesem Versuch betragen etwa 70 %, als Nebenprodukte fallen noch weitere dichlorierte Derivate an.[6] Die Dicarbonsäure lässt sich durch Reaktion mit Thionylchlorid in das Säurechlorid umwandeln, welches Einsatz bei der Umwandlung in das Cuban findet.[2][3]
Durch Umwandlungen funktioneller Gruppen ist es möglich, viele mono- und disubstituierte Cubane zu synthetisieren, da die entsprechenden Carbonsäuren leicht zuganglich sind. Höhere Substitutionen am Cubangerüst über das Cubylradikal sind verhältnismäßig einfach durchzuführen. Der einzige Nachteil dabei ist, dass ein Produktgemisch erhalten wird, welches in seine Bestandteile getrennt werden muss.
Die lichtinduzierte Iodierung von Cuban mit tert-Butylhypoiodit liefert zum Beispiel Mono-, Di-, Triiodcubane usw. Die Herstellung von polycarboxylierten Cuban-Molekülen ist auch möglich.[2]
Cubyl-Grignard-Verbindungen wurden ebenso isoliert, indem Transmetallierungen mit Magnesiumsalzen durchgeführt wurden. Die Umwandlung verläuft dabei über eine Lithiierung oder eine Brommagnesiierung. Es können höchstens zwei Metallierungen durchgeführt werden, was zu Mono- und Di-Grignard-Verbindungen führt. Die Ausbeuten betragen bei kleinen und großen Ansätzen etwa 90–95 %.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt 1,4-Cubanedicarboxylic acid, ≥97% bei Sigma-Aldrich, abgerufen am 23. Januar 2024 (PDF).
- ↑ a b c d e f g Philip E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts. In: Angewandte Chemie. Band 104, Nr. 11, November 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
- ↑ a b c Philip E. Eaton, Thomas W. Cole: Cubane. In: Journal of the American Chemical Society. Band 86, Nr. 15, August 1964, S. 3157–3158, doi:10.1021/ja01069a041.
- ↑ Philip E. Eaton, Thomas W. Cole: The Cubane System. In: Journal of the American Chemical Society. Band 86, Nr. 5, März 1964, S. 962–964, doi:10.1021/ja01059a072.
- ↑ a b Norman Bellamy Chapman, J. M. Key, Kenneth J. Toyne: Preparations and properties of caged polycyclic systems. 1. Pentacyclo[5.3.0.02,5.03,9.04,8]decane and pentacyclo[4.3.0.02,5.03,8.04,7]nonane derivatives. In: The Journal of Organic Chemistry. Band 35, Nr. 11, November 1970, S. 3860–3867, doi:10.1021/jo00836a062.
- ↑ Adéla Křížková, Guillaume Bastien, Igor Rončević, Ivana Císařová, Jiří Rybáček, Václav Kašička, Jiří Kaleta: Chlorinated Cubane-1,4-dicarboxylic Acids. In: The Journal of Organic Chemistry. 1. Februar 2023, doi:10.1021/acs.joc.2c02872.
