Ethylenglycol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Ethylenglycol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, viskose Flüssigkeit mit süßlichem Geschmack[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 62,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,11 g·cm−3 (20 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
197 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
15,1 (25 °C)[4] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4318 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−460,0 kJ/mol (l) −392,2 kJ/mol (g)[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
(Mono-)Ethylenglycol (MEG, Trivialname Glycol) ist der einfachste zweiwertige Alkohol mit der chemischen Bezeichnung Ethan-1,2-diol. Es ist das einfachste vicinale Diol. Der Trivialname leitet sich von süß-schmeckend (altgriechisch γλυκύς glykýs, deutsch ‚süß‘) ab.
Die Bezeichnung Glycole wird darüber hinaus für zwei Klassen von Diolen, die sich vom Ethylenglycol ableiten, verwendet. Das sind zum einen 1,2-Diole wie 1,2-Propandiol und zum anderen α,ω-Diole, die durch Kondensation von Ethylenglycol entstehen: Polyethylenglycole. Beispiele sind Diethylenglycol (DEG), Triethylenglycol (TEG).
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Technische Herstellung[Bearbeiten | Quelltext bearbeiten]
Die großtechnische Herstellung von Ethylenglycol erfolgt meistens durch die katalysatorfreie Hydratisierung von Ethylenoxid bei Temperaturen von 150–200 °C und Drücken von 20–40 bar.[9]

Die Umsetzung wird in adiabatisch betriebenen Rohrreaktoren durchgeführt. Man arbeitet mit einem 10–20-fachen molaren Überschuss an Wasser, um die Bildung von höheren Glycolen zu unterdrücken (vor allem Diethylenglycol und Triethylenglycol). Die Aufarbeitung und Trennung der Komponenten aus dem Produktgemisch erfolgt für gewöhnlich durch mehrstufige Destillation in Rektifikationskolonnen.[9][10]
Des Weiteren kann die Hydratisierung auch mit sauren oder basischen Katalysatoren bei niedrigen Temperaturen (50–70 °C) und drucklos durchgeführt werden.[9]
OMEGA-Prozess der Royal Dutch Shell[Bearbeiten | Quelltext bearbeiten]
Eine Weiterentwicklung dieses Verfahrens ist der OMEGA-Prozess der Royal Dutch Shell. Hierbei wird das Ethylenoxid zunächst mit Kohlenstoffdioxid in Wasser zum Ethylencarbonat umgesetzt. Dieses hydrolysiert dann mit Wasserdampf zum 2-Hydroxyethylhydrogencarbonat, welches anschließend durch Decarboxylierung in Wasser zu Ethylenglycol und Kohlenstoffdioxid zerfällt. Letzteres wird nach Aufbereitung wieder zur ersten Reaktionsstufe zurückgeführt.[11]
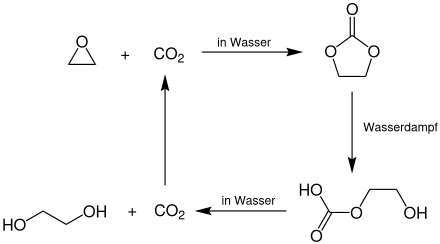
Die Ausbeute an Ethylenglycol beträgt in diesem Prozess ca. 99 %. Als Katalysatoren dienen hierbei Gemische von Kaliumiodid (KI) und Kaliummolybdat (K2MoO4).[11]
Die Produktionskapazitäten für Ethylenglycol betrugen im Jahre 2010 weltweit etwa 25 Millionen Jahrestonnen.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ethylenglycol ist bei Raumtemperatur eine farblose, viskose Flüssigkeit. Der Schmelzpunkt liegt bei −16 °C. Unter Normaldruck siedet die Verbindung bei 197 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A − (B / (T + C)) (P in Torr, T in °C) mit A = 9,6, B = 3225 und C = 283 im Temperaturbereich von 53 °C bis 198 °C.[12]
Ethylenglycol besitzt bei 20 °C eine Viskosität von 20,81 mPa·s. Bei 30 °C sinkt die Viskosität auf 13,87 mPa·s.[13]
Bei Verwendung als Kühlflüssigkeit schwankt die Wärmekapazität je nach Wasserzusatz von 2,4 bis 4,2 kJ/(kg·K) für reines Wasser. Ein 50/50-Gemisch friert bei −40 °C, siedet bei 108 °C und erreicht eine Wärmekapazität von 3,5 kJ/(kg·K).[14][15] Es bildet, abweichend von anderen Glycolethern, mit Wasser kein Azeotrop.
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ethylenglycol zersetzt sich bei Luftzutritt am Siedepunkt und setzt dabei unter anderem Glycolaldehyd, Glyoxal, Acetaldehyd, Methan, Formaldehyd, Kohlenstoffmonoxid und Wasserstoff frei.[3]
Ethylenglycol wirkt nicht stärker korrosiv auf Metallrohre und deren Lötstellen als Wasser. Im Kontakt mit gelöstem Sauerstoff kann es sich jedoch zersetzen und es entstehen Carbonsäuren. Dadurch sinkt der pH-Wert. ggf. auf Werte unter 4. Dadurch steigt die Korrosion stark an. Daher werden Frostschutzmitteln nicht nur Korrosionshemmer, sondern auch Puffersubstanzen wie Borax zugegeben.[16]
Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
Ethylenglycol bildet oberhalb des Flammpunktes bei 111 °C entzündbare Dampf-Luft-Gemische.[3][12] Die untere Explosionsgrenze liegt bei 3,2 Vol.‑% (80 g/m³), die obere Explosionsgrenze (OEG) im Bereich von 43 bis 51 Vol.‑% (1090 – 1326 g/m³).[3][12] Der untere Explosionspunkt beträgt 109 °C. Die Sauerstoffgrenzkonzentration wurde mit 7,5 Mol.–% unter Stickstoff und 10,3 Mol.–% unter Kohlendioxid als Inertgas bestimmt.[17] Mit einer Zündtemperatur von 410 °C resultiert eine Temperaturklasse T2.[3][12] Mit einer elektrischen Leitfähigkeit von 1,16·10−4 S·m−1 bzw. einem spezifischen Widerstand von 8,62·103 Ω·m ist Ethylenglycol entsprechend der TRGS 727 als noch leitfähig anzusehen.[18]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Es wurde 1928 von der I.G. Farben in Ludwigshafen als frostsichere Kühlflüssigkeit für Verbrennungsmotoren entwickelt und unter dem Markennamen Glysantin vertrieben.[19]
(Mono)Ethylenglycol dient heute hauptsächlich zur Herstellung von Polyesterfasern und Polyethylenterephthalat, einem Polyester aus stöchiometrischen Mengen Terephthalsäure und Ethylenglycol mit 100 % Veresterungsgrad.[20] 45 % der weltweit produzierten Menge werden in China verarbeitet.
Wegen seiner hygroskopischen Eigenschaften findet es als Absorptionsmittel für die Entfernung von Wasserdampf aus Erd- und Raffineriegas oder Kreislaufgasen der Hydroraffination Anwendung. Auf allen Verkehrsflughäfen werden Glycol-Wasser-Gemische als Enteisungsmittel für Flugzeuge und Verkehrsflächen genutzt.
In der Forschung wird Ethylenglycol als Lösungsmittel und Reduktionsmittel für die Flüssigphasensynthese von eindimensionalen Metallnanostrukturen verwendet.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
- Die Hautdurchgängigkeit von Ethylenglycol ähnelt der von Ethanol und Glycerin. Ethylenglycol wird sehr schwer durch die intakte Haut aufgenommen. Rötung oder Entzündung kann auftreten, bei Kontakt von Augen oder Schleimhäuten können Reizeffekte empfunden werden.[21]
- Wegen des geringen Dampfdrucks kann es praktisch nur als Aerosol oder Dampf von heißen ethylenglycolhaltigen Produkten eingeatmet werden.[21]
- Bei oraler Aufnahme von 30 ml oder mehr handelt es sich um eine schwere, bei mehr als 100 ml um eine lebensbedrohliche Intoxikation.[22] Das BfR gibt für Menschen eine toxische Dosis von 0,1 ml/kg Körpergewicht an.[23]
Orale Toxizität[Bearbeiten | Quelltext bearbeiten]
Die Symptome ähneln denen einer Methanolvergiftung („gepanschter Alkohol“). Die Abbauprodukte sind jedoch vollkommen unterschiedlich. Wegen des süßen Geschmacks von wasserverdünnten Frostschutzmitteln sind Vergiftungen durch Ethylenglycol nicht ungewöhnlich.[24] Für Erwachsene wird als Antidot die sofortige Aufnahme von Trinkethanol empfohlen (150 ml Whisky oder Weinbrand), klinisch wird 4-Methylpyrazol (Fomepizol) oder Ethanol i.v. gegeben.[21]

Zelltoxisch wirkt nicht das Ethylenglycol selbst, sondern dessen Metaboliten mit Aldehydfunktionen, Glycolaldehyd, Glyoxal und Glyoxylsäure. Diese reagieren mit allen Thiol- und Aminofunktionen von Enzymen und Proteinen.[25] Das Enzym Alkoholdehydrogenase (ADH) katalysiert diese Oxidationsschritte (Alkohol → Aldehyd). Die empfohlenen Antidote wirken als kompetitive Hemmer der Alkoholdehydrogenase. Das Enzym Aldehydoxidase (AO) steuert den langsamen Oxidationsschritt (Aldehyd → Carbonsäure).
Unbehandelt verläuft die Vergiftung in drei Stadien über erste Symptome (Schwindel, Trunkenheit, Bewusstseinsstörungen), Schäden an Herz und Leber (nach 12–24 Stunden) bis zum urämischen Koma mit akutem Nierenversagen. Typische Abbau- und Folgeprodukte wie Glycolsäure, Hippursäure und Oxalsäure werden nachgewiesen.
Umwelt- bzw. Wassergefährdung[Bearbeiten | Quelltext bearbeiten]
Ethylenglycol ist in der Umwelt und in Klärwerken biologisch abbaubar. Dennoch gehört es der Wassergefährdungsstufe 1 an und darf nicht in das Erdreich gelangen. In die Kanalisation darf Kühlflüssigkeit je nach Menge und Konzentration nach Genehmigung eingeleitet werden. Ethylenglycol wirkt im Klärwerk stark sauerstoffentziehend und kann daher Probleme verursachen.[26]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu GLYCOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- ↑ a b c Eintrag zu Ethylenglycol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Ethylenglykol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 8-42.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-232.
- ↑ Eintrag zu Ethane-1,2-diol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 107-21-1 bzw. Ethylenglycol), abgerufen am 2. November 2015.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 89. Auflage. (Internet-Version: 2009), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- ↑ a b c d Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013, ISBN 978-3-527-33072-0.
- ↑ Manfred Fedtke, Wilhelm Pritzkow, Gerhard Zimmermann: Technische Organische Chemie – Grundstoffe, Zwischenprodukte, Finalprodukte, Polymere. 1. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1992, ISBN 3-342-00420-7.
- ↑ a b Eintrag zu Ethylenglycol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Februar 2019.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003, ISBN 3-89701-745-8.
- ↑ Nikos G. Tsierkezos, Ioanna E. Molinou: Thermodynamic Properties of Water + Ethylene Glycol at 283.15, 293.15, 303.15, and 313.15 K. In: Journal of Chemical & Engineering Data. Band 43, Nr. 6, 1. November 1998, S. 989–993, doi:10.1021/je9800914.
- ↑ schmidtler.de: Frostschutzmittel
- ↑ Datenblatt Glycosol N (PDF; 838 kB) bei glykolundsole.de
- ↑ Wolfgang Stichel: Einsatz von Frostschutzmitteln in Heizanlagen: Alterung von Glykol-/Wassergemischen. Bundesanstalt für Materialforschung und -prüfung, 125 Jahre IKZ-Haustechnik, Ausgabe 21/1997, S. 32ff.
- ↑ S. Zakel, J. Förster, M. Mitu: Abschlussbericht zum PTB-Forschungsvorhaben 37064 Sauerstoffgrenzkonzentration von Alkoholen und Ketonen in Stickstoff und Kohlendioxid, PTB Braunschweig, Mai 2023 pdf.
- ↑ Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- ↑ BASF-History 1924–1944 (Memento vom 28. Februar 2017 im Internet Archive)
- ↑ Bericht zur Weltmarktlage von PTA und MEG, 2007 (Memento vom 31. August 2011 im Internet Archive)
- ↑ a b c BASF Medizinische Leitlinien bei akuten Einwirkungen von Ethylenglykol, Informationen und Empfehlungen für Rettungsassistenten/Notärzte/Ärzte vor Ort. (Seite nicht mehr abrufbar, festgestellt im Dezember 2023. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (Stand: 2012; PDF; 36 kB)
- ↑ Als minimale letale Dosis für den Menschen werden etwa 100 ml (GESTIS) und 1,4 g/kg Körpergewicht (Agency for Toxic Substances and Disease Registry: Toxicological Profile for Ethylene Glycol, S. 50) angegeben. In Einzelfällen und mit optimaler medizinischer Therapie wurde auch die Aufnahme von zirka 1000 ml (GESTIS) Ethylenglycol überlebt.
- ↑ BfR – Ärztliche Mitteilungen bei Vergiftungen, S. 41 (2005)
- ↑ Merck Veterinary Manual – Overview of Ethylene Glycol Toxicity (rev. May 2013).
- ↑ G. Eisenbrand, M. Metzler: Toxikologie für Chemiker, Georg Thieme Verlag Stuttgart ISBN 3-13-127001-2, S. 207.
- ↑ Stadt Frankfurt am Main / Umweltamt: Merkblatt zum Umgang mit glykolhaltigen Kälteträgerflüssigkeiten, Mitteilung vom 5. Nov. 2019, abgerufen am 19. Sep. 2022
- ↑ Auskunft zur internationalen Marke Genantin im Register des Deutschen Patent- und Markenamtes (DPMA)
- ↑ Auskunft zur Marke Glysantin im Register des Deutschen Patent- und Markenamtes (DPMA)

