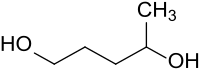
1,4-Pentandiol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,4-Pentandiol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H12O2 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose und ölige Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
sehr leicht löslich in Wasser[2], Methanol[1], Ethanol[2] und Chloroform[1][2] | |||||||||||||||
| Brechungsindex |
1,4452 (23 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,4-Pentandiol ist ein chirales Diol mit einer primären und einer sekundären Hydroxygruppe. Es ist aus der biobasierten Plattformchemikalie Lävulinsäure durch katalytische Hydrierung zugänglich[4] und könnte sich z. B. als Diolkomponente für Polyester aus nachwachsenden Rohstoffen eignen.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Entstehung von 1,4-Pentandiol bei der katalytischen Hydrierung von Lävulinsäure an einem Kupfer-Chromoxid-Kontakt unter den Bedingungen der damals noch gängigen „Feuer-und-Schwert-Chemie“ (Wasserstoffdrücke bis 267 atm ≈ 27 MPa und Temperaturen bis 300 °C) in 44%iger Ausbeute (neben 11 % γ-Valerolacton) wurde 1947 berichtet. Auch aus γ-Valerolacton wurde unter ähnlich drastischen Bedingungen 1,4-Pentandiol in Ausbeuten von 32 bis 83 % erhalten.[5]
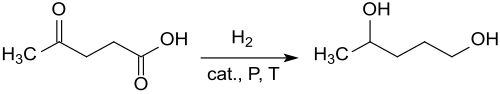
Die stark streuenden Ausbeuten und geringen Selektivitäten weisen auf einen komplexen Reaktionsablauf hin, der über mehrere Zwischenprodukte zu 1,4-Pentandiol – und weiter zum Endprodukt 2-Methyltetrahydrofuran – verläuft.[6]

In Abhängigkeit von den Hydrierbedingungen und -katalysatoren können zu Lasten der Ausbeute an 1,4-Pentandiol weitere (unerwünschte) Folgeprodukte, wie 1-Pentanol, 2-Pentanol und 2-Butanol gebildet werden.[7]

Intensive Forschungsarbeiten in jüngster Vergangenheit zielten darauf ab, die Selektivität der Hydrierung von Lävulinsäure zu 1,4-PDO bei schonenderen Bedingungen zu erhöhen, wobei meist teure Edelmetallkatalysatoren, wie Rhodium[8] oder Palladium[6] oder aufwendige Phosphin-Komplexliganden[9] eingesetzt wurden.
Hydrierung an einem MoOx Molybdänoxid-modifizierten Ruthenium-Festbettkatalysator auf Aktivkohle in Wasser bei 70 °C und 4 MPa Wasserstoffdruck liefert aber im Labormaßstab mit 97 % Ausbeute von 1,4-Pentandiol bei quantitativem Lävulinsäureumsatz bereits vielversprechende Werte.[7]
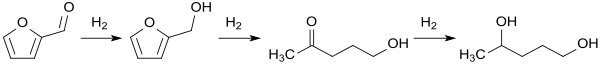
Ein alternativer Zugang zu 1,4-Pentandiol aus nachwachsenden Rohstoffen könnte in der katalytischen Hydrierung von Furfural liegen, wobei ebenfalls an einem Ruthenium-Kontakt auf mesoporösem Kohlenstoff bei 80 °C und 1 MPa H2-Druck 1,4-Pentanol in 90%iger Ausbeute erzeugt wird.[10]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,4-Pentandiol ist eine ölige, hygroskopische Flüssigkeit, die sich sehr gut mit Wasser und polaren organischen Lösungsmitteln mischt.[1]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]1,4-Pentandiol ist als Diolkomponente in bioabbaubaren Polyorthoestern zur kontrollierten Wirkstofffreigabe beschrieben worden.[11]
1,4-Dihydroxypentan wurde als Baustein für Polyester aus nachwachsenden Rohstoffen in jüngerer Zeit mehrfach vorgeschlagen, hat aber seine Eignung bisher noch nicht überzeugend dargelegt. Während der Modellpolyester Polybutylensuccinat mit einem Schmelzpunkt von 115 °C zu Formteilen und Verbundwerkstoffen thermoplastisch verarbeitbar ist, fallen die bisher beschriebenen 1,4-PDO-basierten Polyester mit biobasierten Dicarbonsäuren als gelbe, klebrige Öle oder spröde Massen an.[12]

Die weniger reaktive sekundäre Hydroxygruppe hindert die Bildung höherer Molmassen und die seitenständige Methylgruppe stört die Kristallisation der Molekülketten. Bei den erhaltenen Polyestern wurden daher durch Dynamische Differenzkalorimetrie (engl. differential scanning calorimetry, DSC) keine Schmelzpunkte gefunden. Auch in Polycarbonaten und Polyurethanen ist derzeit noch kein Anwendungspotential für 1,4-Pentandiol erkennbar.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu 1,4-Pentanediol bei Toronto Research Chemicals, abgerufen am 30. Dezember 2018 (PDF).
- ↑ a b c d e f William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–438.
- ↑ a b c Datenblatt 1,4-Pentandiol 99% bei Sigma-Aldrich, abgerufen am 1. Januar 2024 (PDF).
- ↑ A. Phanopoulos, A.J.P. White, N.J. Long, P.W. Miller: Catalytic transformation of levulinic acid to 2-methyltetrahydrofuran using ruthenium-N-triphos complexes. In: ACS Catal. Band 5, Nr. 4, 2015, S. 2500–2512, doi:10.1021/cs502025t.
- ↑ R.V. Christian, H.D. Brown, R.M. Hixon: Derivatives of γ-valerolactone, 1,4-pentanediol and 1,4-d-(β-cyanoethoxy)-pentane. In: J. Amer. Chem. Soc. Band 69, Nr. 8, 1947, S. 1961–1963, doi:10.1021/ja01200a036.
- ↑ a b S.C. Patankar, G.D. Yadav: Cascade engineered synthesis of γ-valerolactone, 1,4-pentanediol, and 2-methyltetrahydrofuran from levulinic acid using Pd-Cu/ZrO2 catalyst in water as solvent. In: ACS Sust. Chem. Eng. Band 3, Nr. 11, 2015, S. 2619–2630, doi:10.1021/acssuschemeng.5b00763.
- ↑ a b J. Cui, J. Tan, Y. Zhu, F. Cheng: Aqueous hydrogenation of levulinic acid to 1,4-pentanediol over Mo-modified Ru/activated carbon catalyst. In: ChemSusChem. Band 11, Nr. 8, 2018, S. 1316–1320, doi:10.1002/cssc.201800038.
- ↑ M. Li, G. Li, N. Li, A. Wang, W. Dong, X. Wang, Y. Cong: Aqueous phase hydrogenation of levulinic acid to 1,4-pentanediol. In: Chem. Commun. Band 50, 2014, S. 1414–1416, doi:10.1039/c3cc48236g.
- ↑ A. Phanopoulos, A.J.P. White, N.J. Long, P.W. Miller: Catalytic transformation of levulinic acid to 2-methyltetrahydrofuran using ruthenium-N-triphos complexes. In: ACS Catal. Band 5, Nr. 4, 2015, S. 2500–2521, doi:10.1021/cs502025t.
- ↑ F. Liu et al.: Catalytic cascade conversion of furfural to 1,4-pentanol in a single reactor. In: Green Chem. Band 20, Nr. 8, 2018, S. 1770–1776, doi:10.1039/C8GC00039E.
- ↑ J. Heller et al.: Development of poly(ortho esters) and their application for bovine serum albumin and bupivacaine delivery. In: J. Control. Release. Band 78, Nr. 1–3, 2002, S. 133–141, doi:10.1016/S0168-3659(01)00482-5.
- ↑ F. van der Klis, R.J.I. Knoop, J.H. Bitter, L.A.M. van den Broek: The effect of Me-substitutents of 1,4-butanediol analogues on the thermal properties of biobased polyesters. In: J. Polym. Sci., Part A: Polym. Chem. Band 56, Nr. 17, 2018, S. 1903–1906, doi:10.1002/pola.29074.