Benutzer:Orci/Namensreaktionen/N
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Nagata-Reaktion | |||||
| Wataru Nagata | 1962 | α,β-ungesättigten Carbonylverbindungen, Cyanodiethylaluminium (Nakata-Reagenz), Säure | Hydrocyanierung | β-Cyanocarbonylverbindungen | [1] |

| |||||
| Nametkin-Umlagerung | |||||
| Sergei Semjonowitsch Namjotkin | 1923 | Halogen-substituierte Campfer-Derivate | Wagner-Meerwein-Umlagerung | Camphen | [2] |
| Narasaka-Prasad-Reduktion | |||||
| Koichi Narasaka, Kapa Prasad | 1984 | β-Hydroxyketone, Bor-Chelatkomplexe wie BBu2OMe, Natriumborhydrid | stereoselektive Reduktion | syn-Dialkohole | [3][4] |

| |||||
| Nazarov-Cyclisierung | |||||
| Iwan Nikolajewitsch Nasarow | 1942 | Divinylketone, Säure | Cyclisierung | Cyclopentenone | [5] |
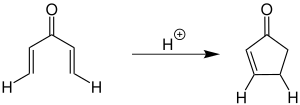
| |||||
| Neber-Bössel-Synthese | |||||
| Neber-Umlagerung | |||||
| Peter Neber | 1926 | Ketone, Hydroxylamin, p-Toluolsulfonsäurechlorid, Base | Bildung eines Oxims, Tosylierung, Deprotonierung, Cyclisierung zum Azirin, Hydratisierung | α-Aminoketone | [6] |

| |||||
| Nef-Reaktion | |||||
| John Ulric Nef | 1894 | Nitroalkane, Natriumhydroxid, Säure | Deprotonierung zum Nitronat, Protonierung, Umlagerung, Abspaltung von Distickstoffmonoxid | Ketone/Aldehyde | [7] |

| |||||
| Nef-Synthese | |||||
| John Ulric Nef | 1899 | Natriumacetylide, Aldehyde/Ketone | Addition | Alkincarbinole | [8] |
| Negishi-Kupplung | |||||
| Ei-ichi Negishi | 1976 | Arylhalogenide, Organozinkverbindungen, Nickel-, oder Palladiumkatalystor | Kreuzkupplung | C-C-Bindung | [9] |
| Nencki-Reaktion | |||||
| Marcel Nencki | 1881 | Phenole, Carbonsäurechloride/-anhydride, Zinkchlorid | ähnlich Friedel-Crafts-Acylierung | acylierte Phenole | [10] |

| |||||
| Nenitzescu-Indolsynthese | |||||
| Costin Nenitzescu | 1929 | 1,4-Benzochinone, β-Amino-α,β-ungesättigte Carbonylverbindungen | Michael-Addition, Ringschluss unter Wasserabspaltung | 5-Hydroxyindole | [11] |

| |||||
| Nenitzescu-Synthese | |||||
| siehe Darzens-Nenitzescu-Ketonsynthese | |||||
| Nenitzescu-reduktive-Acylierung | |||||
| Costin Nenitzescu | 1936 | Cycloalkene, Carbonsäurechloride, Aluminiumtrichlorid | reduktive Acyclierung | Cycloalkylketone | [12] |
| Newman-Kwart-Reaktion | |||||
| Melvin Spencer Newman, Harold Kwart | 1966 | arylsubstituierte Thionourethane | Umlagerung | Thiolourethane | [13][14] |

| |||||
| Nicholas-Reaktion | |||||
| Kenneth M. Nicholas | 1971 | Propargylalkohole/-ether, Nucleophile, Dicobaltoctacarbonyl | Bildung eines Propargylkations, schützen durch Cobaltcarbonylkomplex, nucleophiler Angriff, oxidative Entfernung der Schutzgruppe | alkylierte Alkine | [15] |
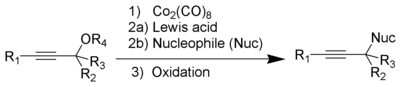
| |||||
| Nicolaou-Dehydrogenierung | |||||
| Kyriacos Costa Nicolaou | 2000 | Aldehyde/Ketone, 2-Iodoxybenzoesäure | Oxidation | α,β-ungesättigte Aldehyde/Ketone | [16] |
| Nicolaou-Hydoxy-Dithioketal-Cyclisierung | |||||
| Kyriacos Costa Nicolaou | 1968 | Diketal-Hydroxyverbindungen, Silbernitrat, Siliciumdioxid, N-Chlorsuccinimid | Cyclisierung | Mcrocyclische Ether | [17] |
| Nicolaou-Hydroxyketon-reduktive-cyclische-Etherbildung | |||||
| Kyriacos Costa Nicolaou | 1989 | Hydroxyketone, Triethylsilan, Triflate | reduktive Cyclisierung | cyclische Ether | [18] |
| Nicolaou-Oxyselenierung | |||||
| Kyriacos Costa Nicolaou | 1979 | Alkene, N-Phenylselenophthalimid/N-phenylselenosuccinimid, Nukleophile | Selenierung, Addition des Nukleophils | Organoselenverbindungen mit Nukleophil in α-Stellung | [19] |
| Niementowski-Reaktion | |||||
| Stefan Niementowski | 1895 | Anthranilsäure, Amide/Ketone/Aldehyde | Cyclisierung | Chinazoline/Chinoline | [20][21] |

| |||||
| Nierenstein-Reaktion | |||||
| Maximilian Nierenstein | 1915 | Carbonsäurechoride, Diazomethan | Reaktion beider Reaktanden, Umlagerung unter Chloridabspaltung, nucleophile Substitution unter Stickstoffabspaltung | α-Chlormethylketone | [22] |

| |||||
| Norrish-Spaltung | |||||
| Norrish-Typ-I-Spaltung | |||||
| Ronald Norrish | 1932 | Carbonylverbindungen | photochemische Spaltung | Radikale | [23] |
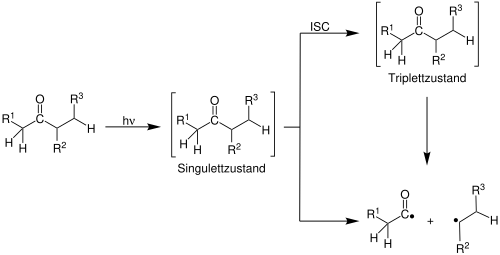
| |||||
| Norrish-Typ-II-Spaltung | |||||
| Ronald Norrish | 1937 | Carbonylverbindungen mit γ-Wasserstoff | photochemische Bildung eines Biradikals, Bildung eines Alkohols, Fragmentierung oder Rekombination | Enole + Alkene oder Cyclobutanole | [24] |

| |||||
| asymmetrische Noyori-Hydrierung | |||||
| Ryoji Noyori | 1980 | Ketone, Ruthenium-BINAP-Komplex, Wasserstoff | Reduktion | enantioselektive Alkohole | [25] |

| |||||
| Nozaki-Hiyama-Kishi-Reaktion | |||||
| Hitoshi Nozaki, Tamejiro Hiyama, Yoshito Kishi | 1977 | Aldehyde, Allyl-/Vinylhalogenide, Chrom(II)-Salz, Nickel-Katalysator | Kupplungsreaktion | sekundäre Allyl- oder Vinylalkohole | [26] |
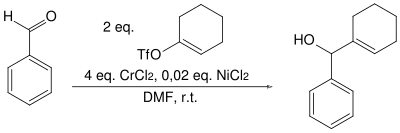
| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ W. Nagata, M. Yoshioka, S. Hirai: Eine neue hydrocyanierungs-methode. In: Tetrahedron Letters. 3, 1962, S. 461, doi:10.1016/S0040-4039(00)70493-X.
- ↑ S. Nametkin: Untersuchungen auf dem Gebiete der Campher- und Camphenilonreihe. In: Justus Liebig's Annalen der Chemie. 432, 1923, S. 207, doi:10.1002/jlac.19234320109.
- ↑ Koichi Narasaka, Fong-Chang Pai: Stereoselective reduction of β hydroxyketones to 1,3-diols highly selective 1,3-asymmetric induction via boron chelates. In: Tetrahedron. 40, 1984, S. 2233, doi:10.1016/0040-4020(84)80006-X.
- ↑ Kau-Ming Chen, Goetz E Hardtmann, Kapa Prasad, Oljan Repič, Michael J Shapiro: 1,3-syn-diastereoselective reduction of β-hydroxyketones utilizing alkoxydialkylboranes. In: Tetrahedron Letters. 28, 1987, S. 155-158, doi:10.1016/S0040-4039(00)95673-9.
- ↑ I. N. Nazarov, I. I. Zaretskaya: Derivatives of acetylene. XXVII. Hydration of divinylacetylene. In: Bull. acad. sci. U.R.S.S., Classe sci. chim. 1942, S. 200–209.
- ↑ P. W. Neber, Adolf V. Friedolsheim: Über eine neue Art der Umlagerung von Oximen. In: Justus Liebig's Annalen der Chemie. 449, 1926, S. 109, doi:10.1002/jlac.19264490108.
- ↑ J. U. Nef: Ueber die Constitution der Salze der Nitroparaffine. In: Justus Liebig's Annalen der Chemie. 280, 1894, S. 263, doi:10.1002/jlac.18942800209.
- ↑ J. V. Nef: Ueber das Phenylacetylen, seine Salze und seine Halogensubstitutionsproducte. In: Justus Liebig's Annalen der Chemie. 308, 1899, S. 264, doi:10.1002/jlac.18993080303.
- ↑ Shigeru Baba, Eiichi Negishi: A novel stereospecific alkenyl-alkenyl cross-coupling by a palladium- or nickel-catalyzed reaction of alkenylalanes with alkenyl halides. In: Journal of the American Chemical Society. 98, 1976, S. 6729, doi:10.1021/ja00437a067.
- ↑ M. Nencki, N. Sieber: Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen. In: Journal für Praktische Chemie. 23, 1881, S. 147, doi:10.1002/prac.18810230111.
- ↑ C. D. Nenitzescu: Derivatives of 2-methyl-5-hydroxyindole. In: Bull soc. chim. Romania. 11, 1929, S. 37-43.
- ↑ Costin D. Nenitzescu, Ecaterina Ciorănescu: Durch Aluminiumchlorid katalysierte Reaktionen, XV. Mitteil.: Über die Darstellung gesättigter Ketone durch Anlagerung von Säurechloriden an Olefine und Hydrierung mittels Aluminium-chlorids. In: Berichte der deutschen chemischen Gesellschaft. 69, 1936, S. 1820-1823, doi:10.1002/cber.19360690804.
- ↑ Melvin S. Newman, Harold A. Karnes: The Conversion of Phenols to Thiophenols via Dialkylthiocarbamates. In: The Journal of Organic Chemistry. 31, 1966, S. 3980, doi:10.1021/jo01350a023.
- ↑ Harold Kwart, E. Robert Evans: The Vapor Phase Rearrangement of Thioncarbonates and Thioncarbamates. In: The Journal of Organic Chemistry. 31, 1966, S. 410, doi:10.1021/jo01340a015.
- ↑ K.M. Nicholas, R. Pettit: An alkyne protecting group. In: Tetrahedron Letters. 12, 1971, S. 3475, doi:10.1016/S0040-4039(01)97209-0.
- ↑ K. C. Nicolaou, Y.-L. Zhong, P. S. Baran: A New Method for the One-Step Synthesis of α,β-Unsaturated Carbonyl Systems from Saturated Alcohols and Carbonyl Compounds. In: Journal of the American Chemical Society. 122, 2000, S. 7596, doi:10.1021/ja001825b.
- ↑ K. C. Nicolaou, M. E. Duggan, C. K. Hwang: New synthetic technology for the construction of oxocenes. In: Journal of the American Chemical Society. 108, 1986, S. 2468, doi:10.1021/ja00269a067.
- ↑ K. C. Nicolaou, C. K. Hwang, D. A. Nugiel: Synthetic studies on the dioxepane region of brevetoxin B. New synthetic technology for the construction of oxepanes and synthesis of a model for the CDEF ring skeleton of brevetoxin B. In: Journal of the American Chemical Society. 111, 1989, S. 4136, doi:10.1021/ja00193a076.
- ↑ K. C. Nicolaou, D. A. Claremon, W. E. Barnette, S. P. Seitz: N-Phenylselenophthalimide (N-PSP) and N-phenylselenosuccinimide (N-PSS). Two versatile carriers of the phenylseleno group. Oxyselenation of olefins and a selenium-based macrolide synthesis. In: Journal of the American Chemical Society. 101, 1979, S. 3704, doi:10.1021/ja00507a069.
- ↑ St. Von Niementowski: Synthesen von Chinazolinverbindungen. In: Journal für Praktische Chemie. 51, 1894, S. 564, doi:10.1002/prac.18950510150.
- ↑ St. Niementowski, B. Orzechowski: Synthesen der Chinolinderivate aus Anthranilsäure und Aldehyden. In: Berichte der deutschen chemischen Gesellschaft. 28, 1895, S. 2809, doi:10.1002/cber.18950280393.
- ↑ Douglas Arthur Clibbens, Maximilian Nierenstein: CLXV.—The action of diazomethane on some aromatic acyl chlorides. In: J. Chem. Soc., Trans.. 107, 1915, S. 1491, doi:10.1039/CT9150701491.
- ↑ Ronald G. W. Norrish, Frederick W. Kirkbride: 204. Primary photochemical processes. Part I. The decomposition of formaldehyde. In: Journal of the Chemical Society. 1932, S. 1518, doi:10.1039/JR9320001518.
- ↑ R. G. W. Norrish, C. H. Bamford: Photo-decomposition of Aldehydes and Ketones. In: Nature. 140, 1937, S. 195, doi:10.1038/140195b0.
- ↑ A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori: Synthesis of 2,2'-bis(diphenylphosphino)-1,1'-binaphthyl (BINAP), an atropisomeric chiral bis(triaryl)phosphine, and its use in the rhodium(I)-catalyzed asymmetric hydrogenation of .alpha.-(acylamino)acrylic acids. In: Journal of the American Chemical Society. 102, 1980, S. 7932, doi:10.1021/ja00547a020.
- ↑ Yoshitaka Okude, Shigeo Hirano, Tamejiro Hiyama, Hitosi Nozaki: Grignard-type carbonyl addition of allyl halides by means of chromous salt. A chemospecific synthesis of homoallyl alcohols. In: Journal of the American Chemical Society. 99, 1977, S. 3179, doi:10.1021/ja00451a061.