Benutzer:Orci/Namensreaktionen/D
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Dakin-Reaktion | |||||
| Henry Drysdale Dakin | 1909 | phenolische Aldehyde/Ketone, Wasserstoffperoxid, Natronlauge | Oxidation | Diphenole, Carbonsäuren | [1] |

| |||||
| Dakin-West-Reaktion | |||||
| Henry Drysdale Dakin, Randolph West | 1928 | α-Aminosäuren, Essigsäureanhydrid, Base | Acylierung, Cyclisierung, Ringöffnung | α-Azetamidoketone | [2] |
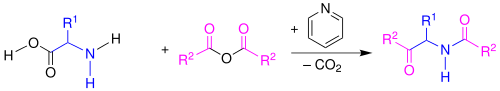
| |||||
| Danheiser-Benzanellierung | |||||
| Rick L. Danheiser | 1984 | Cyclobutanone, Alkine | Annelierung | hochsubstituierte Aromaten | [3] |
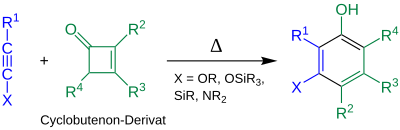
| |||||
| Danheiser-Cyclopentenanellierung | |||||
| Rick L. Danheiser | 1981 | Enone, Allene | Annelierung | Cyclopentene | [4] |

| |||||
| Darapski-Synthese | |||||
| August Darapski | 1915 | Cyanessigsäureester, Hydrazin, salpetrige Säure | Bildung eines Azides, Curtius-Reaktion, Hydrolyse | Aminosäuren | [5] |

| |||||
| Darzens-Glycidester-Kondensation | |||||
| Georges Darzens | 1904 | α-Halogenester, Carbonylverbindung, Base | Kondensation | α,β-Epoxyester | [6] |

| |||||
| Darzens-Halogenierung (Darzens-Alkylchlorid-Synthese) | |||||
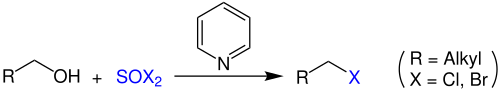
| Georges Darzens | 1911 | Alkohole, Thionylchlorid/Thionylbromid, Stickstoffbase | nukleophile Substitution | Halogenalkane | [7] |
| |||||
| Darzens-Nenitzescu-Ketonsynthese (Darzens-Kondakoff-Acylierung) | |||||
| Georges Darzens, Costin Nenitzescu | 1910 | Alkene, Carbonsäurechloride, Aluminiumtrichlorid | β-Chlorketone oder α,β-ungesättigte Carbonylverbindungen | [8][9] | |
| Darzens-Tetralinsynthese | |||||
| Georges Darzens | 1926 | α-Benzyl-α-allylessigsäuren, Schwefelsäure | Cyclisierung | Tetraline | [10] |

| |||||
| Davidson-Oxazol-Synthese | |||||
| David Davidson | 1937 | α-Hydroxyketone, Carbonsäurechloride, Ammonimacetat oder Ammoniak | Bildung eines Ketoesters, Ringschluss | Oxazole | [11] |

| |||||
| David–Thieffry-Monophenylierung | |||||
| Serge David, Annie Thieffry | 1981 | Glycole, Triphenylbismutacetat | selektive Phenylierung einer Alkoholgruppe | Phenolether | [12] |
| Davis-Oxidation | |||||
| Franklin A. Davis | 1978 | Ketone, Davis-Reagenz, Base | Enolisierung, Oxidation | α-Hydroxyketone | [13] |
| Deacon-Reaktion | |||||
| Glen B. Deacon | 1971 | Quecksilbersulfonate | Eliminierung von Schwefeltrioxid | organische Quecksilberverbindungen | [14] |
| Decker-Becker-sekundäre-Amine-Synthese | |||||
| siehe Forster-Decker-Reaktion | |||||
| De-Kimpe-Aziridinsynthese | |||||
| Norbert De Kimpe | 1975 | α-Halogenimine, Grignard-Verbindungen/Lithiumaluminiumhydrid | Reduktion | Aziridine | [15] |
| De-Kimpe-Amidinsynthese | |||||
| Norbert De Kimpe | 1878 | α-Cyanoenamine, Grignard-Verbindungen | Reduktion | Amidine | [16] |
| Delépine-Reaktion | |||||
| Stéphane Marcel Delépine | 1895 | Alkylhalogenide, Hexamethylentetramin, Säure | Nukleophile Substitution, Hydrolyse | primäre Amine | [17] |

| |||||
| Delépine-Aldehydoxidation | |||||
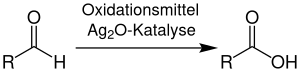
| Stéphane Marcel Delépine | 1909 | Aldehyde, Silber(I)-oxid, Base | Oxidation | Carbonsäuren | [18] |
| |||||
| Demjanov-Umlagerung | |||||
| Nikolai Jakowlewitsch Demjanow | 1903 | Amine, salpetrige Säure, Wasser | Substitutionsreaktion, teilweise unter Ringerweiterung oder -verkleinerung | Alkohole | [19] |

| |||||
| De-Mayo-Reaktion | |||||
| Paul Jose de Mayo | 1962 | 1,3-Diketone, Alkene | Photochemische Tandem-Reaktion | 1,5-Diketone | [20] |
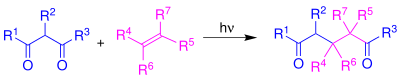
| |||||
| Denmark-Vinylierung | |||||
| Scott E. Denmark | 2005 | Aryl-/Vinylbromide/-iodide, Polyvinylsiloxane, Palladium(II)-bromid, Tetrabutylammoniumfluorid | Hiyama-Kupplung | substituierte Styrole | [21] |
| Dess-Martin-Oxidation | |||||
| Daniel Benjamin Dess, James Cullen Martin | 1983 | Alkohole, Dess-Martin-Periodinan | Oxidation | Aldehyde/Ketone | [22] |

| |||||
| Dieckmann-Kondensation | |||||
| Walter Dieckmann | 1894 | Diester, Base | intramolekulare Claisen-Kondensation | cyclische β-Ketoester | [23] |

| |||||
| Diels-Alder-Reaktion | |||||
| Otto Diels, Kurt Alder | 1928 | Dien, Alken | [4+2]-Cycloaddition | Cycloalkene | [24] |

| |||||
| Diels-Reese-Reaktion | |||||
| Otto Diels, Johannes Reese | 1934 | Hydrazobenzole, Acetylendicarbonsäuredimethylester | Konjugierte Addition | Pyrazolone, Indole oder Chinoline (lösungsmittelabhängig) | [25] |

| |||||
| Dimroth-Umlagerung | |||||
| Otto Dimroth | 1909 | exo- und endo-ständige Heteroatome | Umlagerung | Positionstausch der Heteroatome | [26] |
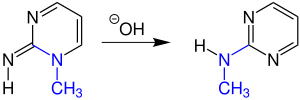
| |||||
| Djerassi-Rylander-Oxidation | |||||
| Carl Djerassi, Paul N. Rylander | 1953 | Alkene/Aromaten, Ruthenium(VIII)-oxid | oxidative Spaltung | Carbonsäuren | [27][28] |
| Doebner-Miller-Reaktion | |||||
| Oskar Doebner, Wilhelm von Miller | 1881 | Aniline, α,β-ungesättigte Carbonylverbindungen | Kondensation | Chinoline | [29] |

| |||||
| Doebner-Reaktion | |||||
| Oscar Gustav Doebner | 1887 | Aniline, Brenztraubensäure, Aldehyde | Aldolreaktion, Michael-Reaktion, Cyclisierung | Chinolin-4-carbonsäuren | [30] |

| |||||
| Doering-LaFlamme-Allensynthese | |||||
| William von Eggers Doering, P. LaFlamme | 1958 | Alkene, Dichlorocarben, Natrium/Grignard-Reagenz | Bildung eines Dichlorcyclopropanes, Carbenbildung, Umlagerung | Allene | [31] |

| |||||
| Doering-Moore-Skattebøl-Reaktion | |||||
| William von Eggers Doering, William Moore, Lars Skatteböl | 1961 | Cyclopropyldihalogenide, Lithiumalkyle | Metall-Halogenen-Austausch, Carbenbildung, Umlagerung | Allene | [31][32][33] |

| |||||
| Dondoni-Homologisierung | |||||
| Alessandro Dondoni | 1986 | Aldehyde/Ketone/Säurechloride, Trimethylsilylthiazol | Addition, Umwandlung des Thiazolrings in Aldehyd/Keton/Säurechlorid | Homologisierte Aldehyde/Ketone/Säurechloride | [34] |
| Dornow-Wiehler-Isoxazolsynthese | |||||
| Alfred Dornow, Gerhard Wiehler | 1952 | Aromatische Aldehyde, α-Nitroester | Kondensation, Ringschluss | Isoxazole | [35] |
| Dötz-Reaktion | |||||
| Karl Heinz Dötz | 1975 | Chrom-Fischer-Carbene, Alkine | Abspaltung von CO, [2+2]-Cycloaddition, CO-Insertion, Ringschluss | Hydrochinone | [36] |

| |||||
| Dowd-Beckwith-Ringerweiterung | |||||
| Paul Dowd, Athelstan L. J. Beckwith | 1987 | 2-Halogenmethyl-cycloalkanone, Tributylzinnhydrid, AIBN | radikalische Ringerweiterung | Cycloalkanone | [37] |
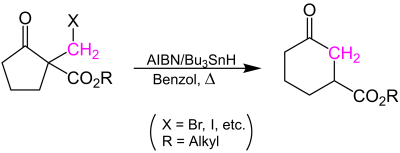
| |||||
| Doyle–Kirmse-Reaktion | |||||
| Wolfgang Kirmse, Michael P. Doyle | 1968/1981 | Allylsulfide, Trimethylsilyldiazomethan | nukleophile Addition am Schwefel, Stevens-Umlagerung | Homoallylsulfide | [38][39] |
| Dow-Phenol-Synthese | |||||
| Warren Kaeding (Dow Chemical) | 1961 | Benzoesäure, Kupfer(II)-benzoat | Oxidation | Phenol | [40] |
| Duff-Reaktion | |||||
| James C. Duff | 1932 | Phenole, Hexamethylentetramin | Elektrophile Substitution, Umlagerungen, Hydrolyse | ortho-Aldehyd-Phenole | [41] |
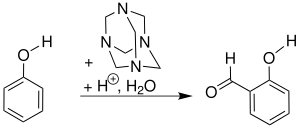
| |||||
| Dutt-Wormall-Reaktion | |||||
| Pavitra Kumar Dutt, Arthur Wormall | 1921 | Diazoniumsalze, Sulfonamide, alkalische Lösung | Azide | [42] | |

| |||||
| Dzhemilev-Reaktion | |||||
| U. M. Dzhemilev | 1985 | Alkene, Ethylmagnesiumbromid, Zirconocendichlorid | Addition | Alkylmagnesiumbromide | [43] |
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ Henry Drysdale Dakin. The oxidation of hydroxy derivates of benzaldehyde, acetophenone and related substances. In: American Chemical Journal. 1909, 42, S. 477-498 (Volltext).
- ↑ H. D. Dakin, Randolph West: Some aromatic derivates of substituted acetylaminoacetones. In: J. Biol. Chem. 1928 78, S. 757-764 (Volltext).
- ↑ Rick L. Danheiser, Stephen K. Gee: A regiocontrolled annulation approach to highly substituted aromatic compounds. In: The Journal of Organic Chemistry. 49, 1984, S. 1672–1674, doi:10.1021/jo00183a043.
- ↑ Rick L. Danheiser, David J. Carini, Ajoy Basak: (Trimethylsilyl)cyclopentene annulation: a regiocontrolled approach to the synthesis of five-membered rings. In: Journal of the American Chemical Society. 103, 1981, S. 1604–1606, doi:10.1021/ja00396a071.
- ↑ August Darapsky, Dietrich Hillers: Über das Hydrazid der Cyanessigsäure, Isonitrosocyanessigsäure und Nitrocyanessigsäure. In: Journal für Praktische Chemie. 92, 1915, S. 297, doi:10.1002/prac.19150920117.
- ↑ Georges Darzens: Méthode générale de synthèse des aldéhydes à l'laide des acides glycidiques substitués. In: Compt. Rend. Acad. Sci. 1904, 139, S. 1214-1217 (Volltext).
- ↑ Georges Darzens: Nouvelle methode d'etherification des alcools par les hydracides. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1911, 152, S. 1314–1317 (Digitalisat auf Gallica).
- ↑ G. Darzens: In: Compt. Rend. 1910, 150, S. 707
- ↑ Costin D. Nenitzescu, Jon P. Cantuniari: Durch Aluminiumchlorid katalysierte Reaktionen. IX. Mitteilung. Über den Mechanismus der Ketonbildung aus Cycloparaffinen und Acetylchlorid in Gegenwart von Aluminiumchlorid. In: Justus Liebigs Annalen der Chemie. 510, 1934, S. 269, doi:10.1002/jlac.19345100118.
- ↑ Georges Darzens: Nouvelle methode générale de synthèse de carbures tétrahydronaphthaléniques et naphthaléniques. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1926, 183, S. 748 (Digitalisat auf Gallica).
- ↑ David Davidson, Marvin Weiss, Murray Jelling: The action of ammonia on benzoin. In: The Journal of Organic Chemistry. 2, 1937, S. 328–334, doi:10.1021/jo01227a005.
- ↑ Serge David, Annie Thieffry: Selective phenylation in mild conditions of one hydroxy group in glycols with triphenylbismuth diacetate: A new specific glycol reaction. In: Tetrahedron Letters. 22, 1981, S. 5063, doi:10.1016/S0040-4039(01)92420-7.
- ↑ Franklin A. Davis, Robert Jenkins, Steven G. Yocklovich: 2-Arenesulfonyl-3-aryloxaziridines: A new class of aprotic oxidizing agents (oxidation of organic sulfur compounds). In: Tetrahedron Letters. 19, 1978, S. 5171, doi:10.1016/S0040-4039(01)85841-X.
- ↑ P. G. Cookson, Glen B. Deacon: The formation of mercury-carbon bonds by sulphur trioxide elimination. In: Journal of organometallic chemistry. 1971, Band 27, Nummer 1, S. C9–C10 doi:10.1016/S0022-328X(00)82978-2.
- ↑ N. De Kimpe, R. Verhé, L. De Buyck, N. Schamp: A Facile Synthesis of 1,2-Disubstituted Aziridines. In: Synthetic Communications. 5, 2006, S. 269, doi:10.1080/00397917508064120.
- ↑ Norbert De Kimpe, Roland Verhe, Laurent De Buyck, Jan Chys, Niceas Schamp: A new and facile synthesis of trialkylketenimines. In: The Journal of Organic Chemistry. 43, 1978, S. 2670, doi:10.1021/jo00407a024.
- ↑ Stéphane Marcel Delépine: Sur l' hexamèthylène-amine; sels d' ammonium; actions des acides; production d' amines primaires. In: Comptes rendus. 1895, 120, S. 501-502 (Volltext).
- ↑ Marcel Delépine, Pierre Bonnet: Sur l'oxydation des aldéhydes par l'oxyde d'argent. In: Bulletin de la Société chimique de France. Mémoires. 1909, 5, S. 879-884 (Digitalisat auf Gallica).
- ↑ Nikolai Jakowlewitsch Demjanow: Products of the action of nitrous acid on tetramethylenylmethylamine. In: J. Russ. Phys. Chem. 1903, 35, S. 26-42.
- ↑ P. de Mayo, H. Takeshita, A. B. M. A Sattar: The Photochemical Synthesis of 1,5-Diketones and their Cyclisation. A New Annulation Process. In: Proceedings of the Chemical Society. 1962, S. 119, doi:10.1039/PS9620000097.
- ↑ Scott E. Denmark, Christopher R. Butler: Vinylation of Aryl Bromides Using an Inexpensive Vinylpolysiloxane. In: Organic letters. 2005, Band 8, Nummer 1, S. 63–66 doi:10.1021/ol052517r.
- ↑ D. B. Dess, J. C. Martin: Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones. In: J. Org. Chem. 1983, 48, 22, S. 4155–4156, doi:10.1021/jo00170a070.
- ↑ W. Dieckmann: Zur Kenntniss der Ringbildung aus Kohlenstoffketten. In: Berichte der deutschen chemischen Gesellschaft. 1894, 27, 1, S. 102-103, doi:10.1002/cber.18940270126.
- ↑ Otto Diels, Kurt Alder: Synthesen in der hydroaromatischen Reihe. In: Justus Liebigs Annalen der Chemie. 1928, 460, S. 98-122, doi:10.1002/jlac.19284600106.
- ↑ Otto Diels, Johannes Reese: Synthesen in der hydroaromatischen Reihe. XX. Über die Anlagerung von Acetylen-dicarbonsäureester an Hydrazobenzol. In: Justus Liebig's Annalen der Chemie. 511, 1934, S. 168, doi:10.1002/jlac.19345110114.
- ↑ Otto Dimroth: Ueber intramolekulare Umlagerungen. Umlagerungen in der Reihe des 1, 2, 3-Triazols. In: Justus Liebig's Annalen der Chemie. 364, 1909, S. 183, doi:10.1002/jlac.19093640204.
- ↑ Carl Djerassi, Robert R. Engle: Oxidations with Ruthenium Tetroxide. In: Journal of the American Chemical Society. 75, 1953, S. 3838, doi:10.1021/ja01111a507.
- ↑ Lewis M. Berkowitz, Paul N. Rylander: Use of Ruthenium Tetroxide as a Multi-purpose Oxidant. In: Journal of the American Chemical Society. 80, 1958, S. 6682, doi:10.1021/ja01557a053.
- ↑ O. Doebner, W. v. Miller: Ueber eine dem Chinolin homologe Base. In: Berichte der deutschen chemischen Gesellschaft. 14, 1881, S. 2812, doi:10.1002/cber.188101402258.
- ↑ Oscar Gustav Doebner: Ueber α-Alkylcinchoninsäuren und α-Alkylchinoline. In: Justus Liebigs Annalen der Chemie. 1887, 242, 3, S. 265-289, doi:10.1002/jlac.18872420302.
- ↑ a b W. von E. Doering, P.M. LaFlamme: A two-step of synthesis of allenes from olefins. In: Tetrahedron. 2, 1958, S. 75, doi:10.1016/0040-4020(58)88025-4.
- ↑ William Moore, Harold Ward: Communications- Reactions of gem-Dibromocyclopropanes with Alkyllithium Reagents. Formation of Allenes, Spiropentanes, and a Derivative of Bicyclopropylidene. In: The Journal of Organic Chemistry. 25, 1960, S. 2073, doi:10.1021/jo01081a054.
- ↑ Lars Skatteböl: Allenes from gem-dihalocyclopropane derivatives and alkyllithium. In: Tetrahedron Letters. 2, 1961, S. 167, doi:10.1016/S0040-4039(01)84059-4.
- ↑ Alessandro Dondoni, Giancarlo Fantin, Marco Fogagnolo, Alessandro Medici: Synthese langkettiger Zucker durch iterative, diastereoselektive Homologisierung von 2,3-O-Isopropyliden-D-glycerinaldehyd mit 2-Trimethylsilylthiazol. In: Angewandte Chemie. 98, 1986, S. 822, doi:10.1002/ange.19860980917.
- ↑ Alfred Dornow, Gerhard Wiehler: Über die Umsetzung von Aldehyden mit Nitroessigester. Über aliphatische Nitroverbindungen; III. In: Justus Liebigs Annalen der Chemie. 1952, Band 578, Nummer 1, S. 113–121 doi:10.1002/jlac.19525780114.
- ↑ Karl Heinz Dötz: Aufbau des Naphtholgerüsts aus Pentacarbonyl-[methoxy(phenyl)carben]chrom (0) und Tolan. In: Angewandte Chemie. 1975, 87, 18, S. 672-673, doi:10.1002/ange.1975087181.
- ↑ Paul Dowd, Soo Chang Choi: A new tributyltin hydride-based rearrangement of bromomethyl .beta.-keto esters. A synthetically useful ring expansion to .gamma.-keto esters. In: J. Am. Chem. Soc. 1987, 109, 11, S. 3493–3494, doi:10.1021/ja00245a069; Athelstan L. J. Beckwith, Dennis M. O'Shea, Sendaba Gerba, Steven W. Westwood: Cyano or acyl group migration by consecutive homolytic addition and β-fission. In: J. Chem. Soc., Chem. Commun. 1987, 9, S. 666-667, doi:10.1039/C39870000666.
- ↑ Wolfgang Kirmse, Manfred Kapps: Reaktionen des Diazomethans mit Diallylsulfid und Allyläthern unter Kupfersalz-Katalyse. In: Chemische Berichte. 101, 1968, S. 994, doi:10.1002/cber.19681010333.
- ↑ Michael P. Doyle, William H. Tamblyn, Vahid Bagheri: Highly effective catalytic methods for ylide generation from diazo compounds. Mechanism of the rhodium- and copper-catalyzed reactions with allylic compounds. In: The Journal of Organic Chemistry. 46, 1981, S. 5094, doi:10.1021/jo00338a008.
- ↑ Warren W Kaeding: Oxidation of Aromatic Acids. In: The Journal of Organic Chemistry. 26, 1961, S. 3144, doi:10.1021/jo01067a026.
- ↑ J. C. Duff, E. J. Bills: 273. Reactions between hexamethylenetetramine and phenolic compounds. Part I. A new method for the preparation of 3- and 5-aldehydosalicylic acids. In: Journal of the Chemical Society (Resumed). 1932, S. 1987, doi:10.1039/JR9320001987.
- ↑ Pavitra Kumar Dutt, Hugh Robinson Whitehead, Arthur Wormall: CCXLI.?The action of diazo-salts on aromatic sulphonamides. Part I. In: Journal of the Chemical Society, Transactions. 119, 1921, S. 2088, doi:10.1039/CT9211902088.
- ↑ У. М. Джемилев, О. С. Вострикова: Some novelties in olefin carbometallation assisted by alkyl-magnesium and -aluminium derivatives and catalyzed by zirconium and titanium complexes. In: Journal of organometallic chemistry. 1985, Band 285, Nummer 1-3, S. 43–51 doi:10.1016/0022-328X(85)87355-1.