Benutzer:Orci/Namensreaktionen/C
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Cacchi-Kupplung | |||||
| Sandro Cacchi | 1986 | Vinyltriflate, terminale Alkine, Kupfer(I)-Salz, Palladium(0)-Komplex | Kupplung | C-C-Bindung zwischen Alken und Alkin | [1] |
| Cadiot-Chodkiewicz-Kupplung | |||||
| Paul Cadiot, Wladyslaw Chodkiewicz | 1955 | terminales Alkin, Halogenalkin, Kupferbromid, Stickstoffbase | Kupplung unter Kupferkatalyse | Dialkine | [2] |
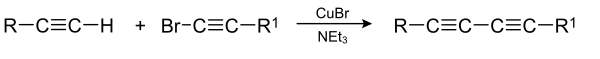
| |||||
| Cadogan-Sundberg-Indolsynthese | |||||
| John I. G. Cadogan, Richard J. Sundberg | 1962 | o-Nitrostyrole/o-Nitrostilbene, Trialkylphosphite | Desoxygenierung, Ringschluss | Indole | [3][4] |
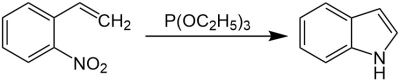
| |||||
| Caglioti-Reaktion | |||||
| Luciano Caglioti | 1963 | Ketone, Tosylhydrazon, Hydrid | Reduktion | Alkane | [5] |
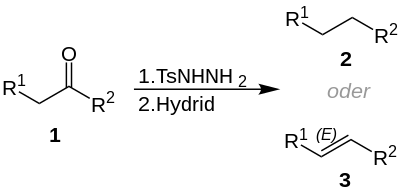
| |||||
| Cahours-Hofmann-Reaktion | |||||
| Auguste Cahours, August Wilhelm von Hofmann | 1857 | Quartäre Phosphoniumhydroxide, Base | Zersetzung | Kohlenwasserstoffe, tertiäre Phosphine | [6] |

| |||||
| Camps-Chinolinsynthese | |||||
| Rudolf Camps | 1899 | N-Acyl-ortho-acylaniline, Base | intramolekulare Kondensation | Hydroxychinoline | [7] |
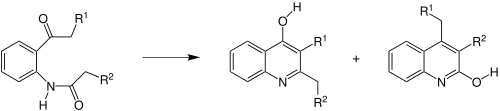
| |||||
| Cannizzaro-Reaktion | |||||
| Stanislao Cannizzaro | 1853 | Aldehyde, Base | Disproportionierung | Carbonsäure, Alkohol | [8] |
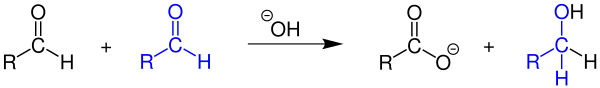
| |||||
| Carboni-Lindsey-Reaktion | |||||
| R. A. Carboni, R. V. Lindsey | 1959 | Tetrazine, ungesättigte Verbindungen | Diels-Alder-Reaktion mit Stickstoff- und Wasserstoffabspaltung | Pyridazine | [9] |
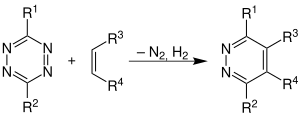
| |||||
| Cargill-Umlagerung | |||||
| Robert L. Cargill | 1967 | Bicyclo[4,2,0]octenone, Säure | Umlagerung | Bicyclo[3,2,1]octenone | [10] |
| Carroll-Umlagerung | |||||
| Michael Francis Carroll | 1940 | β-Keto-Allylester, Tetrakis(triphenylphosphin)palladium(0) | palladium-katalysierte Umlagerung unter CO2-Abspaltung | γ,δ-Allylketone | [11] |
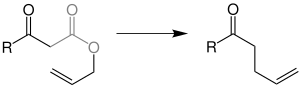
| |||||
| Castro-Indolsynthese | |||||
| Charles E. Castro | 1966 | O‐Haloaniline, Kupferacetylide | metallkatalysierte Cyclisierung | Indole | [12] |

| |||||
| Castro-Stephens-Kupplung | |||||
| Charles E. Castro, Robert D. Stephens | 1963 | Arylhalogenide, Kupferacetylid | Kupplungsreaktion | aromatische Alkine | [13] |
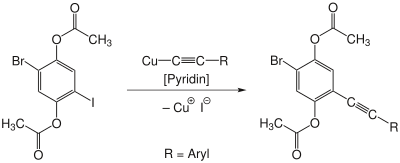
| |||||
| Chan-Alkinreduktion | |||||
| Ka-Kong Chan | 1976 | Alkinalkohole, Red-Al oder Lithiumaluminiumhydrid | stereoselektive Reduktion | E-Allylalkohole | [14] |
| Chan-Lam-Kupplung | |||||
| Dominic M. T. Chan, Patrick Y. S. Lam | 1998 | Amine, Arylboronsäuren, Kupfer(II)-acetat (Katalysator) | Kupplung | N-Arylamine | [15] |

| |||||
| Chan-Umlagerung | |||||
| Tak-Hang Chan | 1984 | Acyloxacetat, Lithiumdiisopropylamid | Umlagerung | 2-Hydroxy-3-ketoester | [16] |
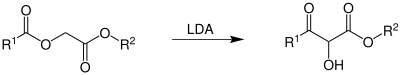
| |||||
| Chapman-Umlagerung | |||||
| Arthur William Chapman | 1925 | ortho-Aryliminoether | Umlagerung | Amide | [17] |
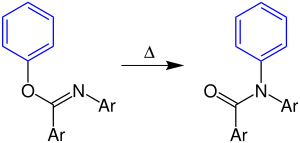
| |||||
| Chrétien-Longi-Reaktion | |||||
| André Chrétien, Yves Longi | 1945 | Alkohole, Natriumnitrit, Aluminiumsulfat | Salpetrigsäureester | [18] | |
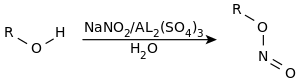
| |||||
| Ciamician-Dennstedt-Umlagerung | |||||
| Giacomo Luigi Ciamician, Max Dennstedt | 1881 | Pyrrole, Chloroform, Base | Umlagerung | 3-Chlorpyridine | [19] |

| |||||
| Ciamician-Kupplung | |||||
| Giacomo Ciamician | 1908 | Alkene | photolytische [2+2]-Cycloaddition | Bildung von zwei neuen C-C-Bindungen | [20] |
| Claisen-Ireland-Umlagerung | |||||
| Ludwig Claisen, Robert E. Ireland | 1972 | Carbonsäureallylester | Silylierung, Umlagerung | γ,δ-ungesättigte Carbonsäuren | [21] |
| Claisen-Isoxazolsynthese | |||||
| Ludwig Claisen | 1891 | β-Ketoester, Hydroxylamin | Cyclisierung | 3-Hydroxyisoxazole | [22] |
| Claisen-Kondensation | |||||
| Ludwig Claisen | 1887 | Ester, Base | Kondensation | β-Ketoester | [23] |
| Claisen-Umlagerung | |||||
| Ludwig Claisen | 1912 | Allyl-Vinyl-Ether/Allyl-Aryl-Ether | [3+3]-sigmatrope Umlagerung | γ,δ-ungesättigte Carbonylverbindungen/o-Allylphenole | [24] |

| |||||
| Claisen-Schmidt-Kondensation | |||||
| Ludwig Claisen, J. Gustav Schmidt | 1881 | aromat. Aldehyde, aliphat Aldehyde/Ketone, Basen | Kondensation | α,β-ungesättigte Aldehyde/Ketone | [25] |
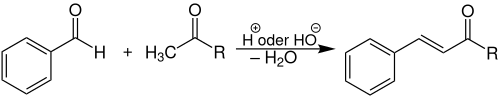
| |||||
| Claisen-Tischtschenko-Reaktion | |||||
| siehe Tischtschenko-Reaktion | |||||
| Clauson-Kaas-Reaktion | |||||
| Niels Clauson-Kaas | 1952 | primäre Amine, alkoxysubstituiertes Tetrahydrfuran, Säure | Protonierung, Ringöfffnung, Anlagerung des Amins unter Methanolabspaltung, Ringschluss | Pyrrole | [26] |

| |||||
| Clay-Kinnear-Perren-Kondensation | |||||
| John Clay, A.M. Kinnear, E.A. Perren | 1951 | Chloralkane, Phosphortrichlorid, Aluminiumtrichlorid (Katalysator), Aluminium | Bildung eines Alkyltrichlorophosphoniumsalzes, Reduktion | Alkylphosphonyldichloride und -ester | [27][28] |
| Clayton-Jensen Chlorophosphorisierung | |||||
| J. O. Clayton, W. L. Jensen | 1948 | Alkane, Sauerstoff, Phosphortrichlorid | radikalische Chlorphosphorisierung | Alkylphosphorylchloride | [29] |
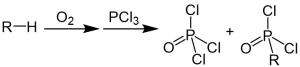
| |||||
| Clemmensen-Reduktion | |||||
| Erik Christian Clemmensen | 1913 | Aldehyde/Ketone, amalgamiertes Zink, Salzsäure | Reduktion | Alkane | [30] |
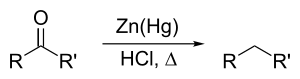
| |||||
| Cloke-Wilson-Umlagerung | |||||
| John B. Cloke, Christopher L. Wilson | 1929/1947 | Cyclopropylimine/-aldehyde/-ketone | Umlagerung | Dihydropyrrole/-furane | [31][32] |
| Cohen-reduktive-Lithiierung | |||||
| Theodore Cohen | 1978 | Phenylthioether, Lithiumnaphthalid | reduktive Lithiierung | Organolithiumverbindungen | [33] |
| Collins-Oxidation | |||||
| J.C.Collins | 1968 | primäre Alkohole, Collins-Reagenz | Oxidation | Aldehyde | [34] |
| Collman-Carbonylierung | |||||
| James P. Collman | 1970 | Alkylhalogenide/-tosylate, Collmans Reagenz, CO | Oxidation | Aldehyde/Ketone | [35][36] |
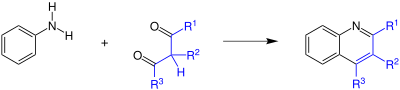
| Combes-Chinolinsynthese | |||||
| Alphonse-Edmond Combes | 1888 | Aniline, β-Diketone, Säure | säurekatalysierte Kondensation | Chinoline | [37] |
| |||||
| Conia-En-Reaktion (Conia-Cyclisierung) | |||||
| Jean-Marie Conia | 1975 | Enolisierbare Carbonylverbindungen mit Alkenyl- oder Alkinylgruppe | intramolekulate En-Reaktion | Cycloalkane/-alkene | [38] |
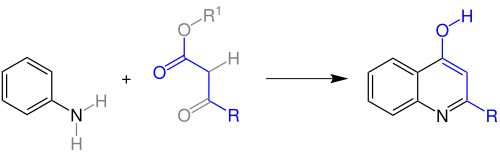
| Conrad-Limpach-Reaktion | |||||
| Max Conrad, Leonhard Limpach | 1887 | Aniline, β-Ketoester | thermische oder säurekatalysierte Kondensation | Chinolin-4-one | [39] |
| |||||
| Cooper-Finkbeiner-Hydromagnesierung | |||||
| Cope-Eliminierung | |||||
| Arthur C. Cope | 1949 | N-Oxide | thermische Eliminerung | Olefine, N-Hydroxy-Amine | [40] |
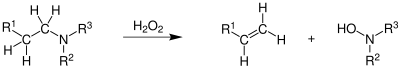
| |||||
| Cope-Mamloc-Wolfenstein-Olefinsynthese | |||||
| Cope-Umlagerung | |||||
| Arthur C. Cope | 1940 | 1,5-Hexadiene | [3,3]-sigmatrope Umlagerung | 1,5-Hexadiene | [41] |
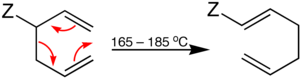
| |||||
| Corey-Bakshi-Shibata-Reduktion | |||||
| Elias James Corey Jr., Raman K. Bakshi, Saizo Shibata | 1987 | Ketone, Boran, Oxazaborolidine (Kat.) | enantioselektive Reduktion | Alkohole | [42] |
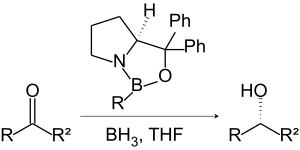
| |||||
| Corey-Chaykovsky-Epoxidierung | |||||
| Elias James Corey, Michael Chaykovsky | 1962 | Dimethylsulfoxonium-Methylid/Dimethylsulfonium-Methylid, Carbonylverb./Alkene/Imine | Epoxide/Cyclopropane/Aziridine | [43] | |
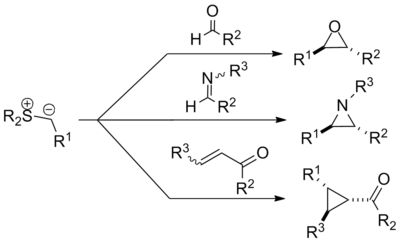
| |||||
| Corey-Fuchs-Reaktion | |||||
| Elias James Corey, Philip L. Fuchs | 1972 | Aldehyde, Tetrabrommethan, Triphenylphosphin, Zink, Butyllithium | Bildung eines Dibrommethyl-Triphenylphosphin-Adduktes, Wittig-Reaktion, Eliminierung | terminale Alkine | [44] |

| |||||
| Corey-House-Posner-Whitesides-Reaktion | |||||
| Elias J. Corey, Herbert O. House, Gary Posner, George M. Whitesides | 1966/67 | Halogen-/Tosylalkane, Alkylcuprate | Kupplung | Alkane | [45][46] |
| Corey-Gilman-Ganem-Oxidation | |||||
| Elias J. Corey, Norman W. Gilman, B. E. Ganem | 1968 | Aldehyde oder Allylaldehyde, Mangandioxid, Kaliumcyanid, Alkohole | Oxidation | Allylester | [47] |
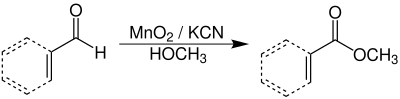
| |||||
| Corey-Kim-Oxidation | |||||
| Elias James Corey, Choung U. Kim | 1972 | Alkohole, N-Chlorsuccinimid, Dimethylsulfid, Triethylamin | Oxidation | Ketone/Aldehyde | [48] |
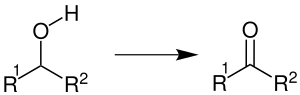
| |||||
| Corey-Kwiatkowski-Reaktion | |||||
| Elias James Corey, George T. Kwiatkowski | 1966 | Aldehyde/Ketone, Lithiumalkylphosphondiamid | nukleophile Addition, Cyclisierung, Abspaltung von Phosphorsäurediamid | Alkene | [49] |
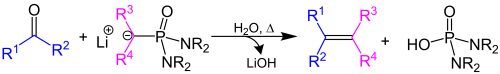
| |||||
| Corey-Link-Reaktion | |||||
| Elias James Corey, John O. Link | 1992 | Trichlormethylketone, 1,3,2-Benzodioxaborol, (R)- oder (S)-Oxazaborolidin, Base, Natriumazid, Wasserstoff/Palladium | enantioselektive Reduktion zum Alkohol, Diazotierung, Hydrierung | α-Aminosäuren | [50] |
| Corey-Nicolaou-Macrolactonisierung | |||||
| Elias James Corey, Kyriacos C. Nicolaou | 1974 | ω-Hydroxy-Carbonsäuren, 2,2’-Dipyridyl-disulfid, Triphenylphosphin | Lactone | [51] | |
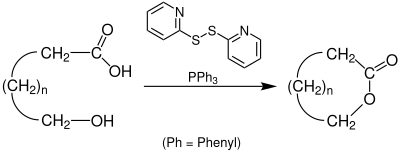
| |||||
| Corey-Schmidt-Oxidation | |||||
| Elias J. Corey, Greg Schmidt | 1979 | Alkohole, Cornforth-Reagenz | Oxidation | Aldehyde/Ketone oder Carbonsäureester (abhängig vom Lösungsmittel) | [52] |

| |||||
| Corey-Seebach-Reaktion | |||||
| Elias James Corey Jr., Dieter Seebach | 1965 | Carbonylverbindungen, Propan-1,3-dithiol, Butyllithium | Umpolung: Bildung eines Thioacetals, Deprotonierung, anschließend nukleoph. Substitutionen möglich | [53] | |
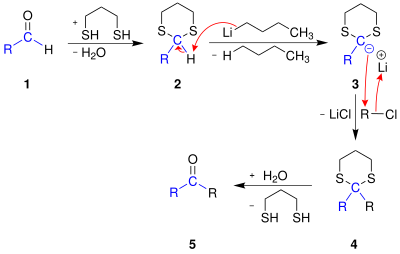
| |||||
| Corey-Suggs-Oxidation | |||||
| Elias J. Corey, J. William Suggs | 1975 | Alkohole, Pydidiniumchlorochromat | Oxidation | Aldehyde/Ketone | [54] |
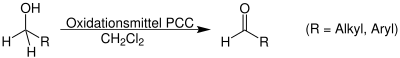
| |||||
| Corey-Winter-Eliminierung | |||||
| Elias James Corey, Roland A. E. Winter | 1963 | vicinale Diole, 1,1’-Thiocarbonyldiimidazol, Trimethylphosphit | reduktive Eliminierung | Alkene | [55] |

| |||||
| Cornforth-Umlagerung | |||||
| John W. Cornforth | 1949 | 4-Carbonyl-substituierte Oxazole | Umlagerung über ein Dicarbonyl-Nitril | isomere Oxazole | [56] |
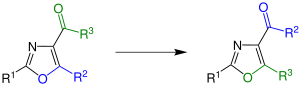
| |||||
| Craig-2-Bromopyridin-Synthese | |||||
| Lyman C. Craig | 1934 | 2-Aminopyridin, Natriumnitrit, Bromwasserstoffsäure | Diazotierung, nukleophile Substitution | 2-Bromopyridin | [57] |
| Criegee-Glycolspaltung | |||||
| Rudolf Criegee | 1931 | vicinale Diole, Blei(IV)-acetat | Carbonylverbindungen | [58] | |

| |||||
| Criegee-Ozonolyse | |||||
| Rudolf Criegee | 1949 | Alkene, Ozon | 1,3-Dipolare Cycloaddition | je nach Aufarbeitung Carbonsäuren, Alkohole, Carbonylverbindungen | [59] |
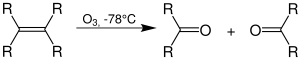
| |||||
| Criegee-Umlagerung | |||||
| Rudolf Criegee | 1945 | tertiäre Alkohole, Persäure | Umlagerung | Ketone/Carbonsäureester/Kohlensäureester (abhängig vom Mengenverhältnis der Edukte) | [60] |

| |||||
| Crum Brown-Walker-Elektrolyse | |||||
| Alexander Crum Brown, James Walker | 1891 | Carbonsäurehalbester | Kolbe-Elektrolyse | Carbonsäurediester mit doppelter Kettenlänge | [61] |
| Curtius-Reaktion | |||||
| Theodor Curtius | 1890 | Carbonsäureazide | Umlagerung zum Isocyanat, Dacarboxylierung | Amine | [62] |
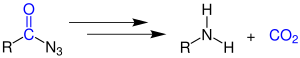
| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Sandro Cacchi, Enrico Morera, Giorgio Ortar: Palladium-Catalyzed Reaction of Enol Triflates with 1-Alkynes. A New Route to Conjugated Enynes. In: Synthesis. 1986, 1986, S. 320–322, doi:10.1055/s-1986-31599.
- ↑ Paul Cadiot, Wladyslav Chodkiewicz: Nouvelle Synthèse de composés polyacétyléniques conjugués symétriques et dissymétriques. In: Comptes Rendus de l'Académie des sciences. 1955, 241, S. 1055-1057 (Digitalisat auf Gallica).
- ↑ J.I.G. Cadogan, M. Cameron-Wood: Synthesis of new substituted carbazole derivatives. In: Proceedings of the Chemical Society. 1962, S. 361, doi:10.1039/PS9620000349.
- ↑ R. J. Sundberg: Deoxygenation of Nitro Groups by Trivalent Phosphorus. Indoles from o-Nitrostyrenes. In: The Journal of Organic Chemistry. 30, 1965, S. 3604, doi:10.1021/jo01022a006.
- ↑ L. Caglioti, M. Magi: The reaction of tosylhydrazones with lithium aluminium hydride. In: Tetrahedron. 19, 1963, S. 1127, doi:10.1016/S0040-4020(01)98571-0.
- ↑ A. Cahours, A. W. Hofmann: Untersuchungen über die Phosphorbasen. In: Annalen der Chemie und Pharmacie. 104, 1857, S. 1, doi:10.1002/jlac.18571040102.
- ↑ R. Camps: Synthese von α- und γ-Oxychinolinen. In: Berichte der deutschen chemischen Gesellschaft. 32, 1899, S. 3228, doi:10.1002/cber.18990320389.
- ↑ S. Cannizzaro: Ueber den der Benzoësäure entsprechenden Alkohol. In: Justus Liebigs Annalen der Chemie. 1853, 88, 1,S. 129-130, doi:10.1002/jlac.18530880114.
- ↑ R. A. Carboni, R. V. Lindsey: Reactions of Tetrazines with Unsaturated Compounds. A New Synthesis of Pyridazines. In: Journal of the American Chemical Society. 81, 1959, S. 4342, doi:10.1021/ja01525a060.
- ↑ Robert L. Cargill, James W. Crawford: Synthesis and rearrangement of tricyclo[4.3.2.01,6]undec-10-en-2-one. In: Tetrahedron Letters. 8, 1967, S. 169, doi:10.1016/S0040-4039(00)90510-0.
- ↑ M. F. Carroll: 131. Addition of β-unsaturated alcohols to the active methylene group. Part I. The action of ethyl acetoacetate on linalool and geraniol. In: Journal of the Chemical Society (Resumed). 1940, S. 704, doi:10.1039/JR9400000704.
- ↑ C. E. Castro, E. J. Gaughan, D. C. Owsley: Indoles, Benzofurans, Phthalides, and Tolanes via Copper(I) Acetylides. In: The Journal of Organic Chemistry. 31, 1966, S. 4071, doi:10.1021/jo01350a045.
- ↑ R. D. Stephens, C. E. Castro: The Substitution of Aryl Iodides with Cuprous Acetylides. A Synthesis of Tolanes and Heterocyclics . In: The Journal of Organic Chemistry. 28, 1963, S. 3313, doi:10.1021/jo01047a008.
- ↑ Ka-Kong. Chan, Noal. Cohen, James P. De Noble, Anthony C. Specian, Gabriel. Saucy: Synthetic studies on (2R,4'R,8'R)-.alpha.-tocopherol. Facile syntheses of optically active, saturated, acyclic isoprenoids via stereospecific [3,3] sigmatropic rearrangements. In: The Journal of Organic Chemistry. 41, 1976, S. 3497–3505, doi:10.1021/jo00884a001.
- ↑ Dominic M. T. Chan, Kevin L. Monaco, Ru-Ping Wang, Michael P. Winters: New N- and O-arylations with phenylboronic acids and cupric acetate. In: Tetrahedron Letters. 1998, 39, 19, S. 2933-2936, doi:10.1016/S0040-4039(98)00503-6; Patrick Y. S. Lam, Charles G. Clark, Simon Saubern, Jessica Adams, Michael P. Winters, Dominic M. T. Chan, Andrew Combs: New aryl/heteroaryl C---N bond cross-coupling reactions via arylboronic acid/cupric acetate arylation. In: Tetrahedron Letters. 1998, 39, 19, S. 2941-2944, doi:10.1016/S0040-4039(98)00504-8.
- ↑ S.D. Lee, T.H. Chan, K.S. Kwon: Rearrangement of α-acyloxyacetates into 2-hydroxy-3-ketoesters. In: Tetrahedron Letters. 25, 1984, S. 3399, doi:10.1016/S0040-4039(01)91030-5.
- ↑ Arthur William Chapman: Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether. In: J. Chem. Soc., Trans. 1925, 127, S. 1992-1998, doi:10.1039/CT9252701992.
- ↑ André Chrétien, Yves Longi: Sur la préparation des azotites organiques au moyen de l'hydrolyse de l'azotite d'aluminium. In: Comptes Rendus de l'Académie des sciences. 1945, 220, S. 746 (Digitalisat auf Gallica).
- ↑ G. L. Ciamician, M. Dennstedt: Ueber die Einwirkung des Chloroforms auf die Kaliumverbindung Pyrrols. In: Berichte der deutschen chemischen Gesellschaft. 1881, 14, 1, S. 1153–1163, doi:10.1002/cber.188101401240.
- ↑ Giacomo Ciamician, P. Silber: Chemische Lichtwirkungen. In: Berichte der deutschen chemischen Gesellschaft. 41, 1908, S. 1928, doi:10.1002/cber.19080410272.
- ↑ Robert E. Ireland, Richard H. Mueller: Claisen rearrangement of allyl esters. In: Journal of the American Chemical Society. 94, 1972, S. 5897, doi:10.1021/ja00771a062.
- ↑ L. Claisen, W. Zedel: Ueber Phenylisoxazolon. In: Berichte der deutschen chemischen Gesellschaft. 24, 1891, S. 140, doi:10.1002/cber.18910240124.
- ↑ L. Claisen, O. Lowman: Ueber eine neue Bildungsweise des Benzoylessigäthers. In: Berichte der deutschen chemischen Gesellschaft. 1887, 20, S. 651-654, doi:10.1002/cber.188702001149.
- ↑ L. Claisen: Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole. In: Berichte der deutschen chemischen Gesellschaft. 1912, 45, 3, S. 3157-3166, doi:10.1002/cber.19120450348.
- ↑ J. Gustav Schmidt: Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl bei Gegenwart von Alkalilauge. In: Berichte der deutschen chemischen Gesellschaft. 1881, 14, 1, S. 1459-1461, doi:10.1002/cber.188101401306; L. Claisen, A. Claparède: Condensationen von Ketonen mit Aldehyden. In: Berichte der deutschen chemischen Gesellschaft. 1881, 14, 2, S. 2460-2468, doi:10.1002/cber.188101402192.
- ↑ Niels Clauson-Kaas, Zdenĕk Tyle: Preparation of Cis- and Trans 2,5-Dimethoxy-2-(acetamidomethyl)-2,5-dihydrofuran, of Cis- and Trans 2,5-Dimethoxy-2-(acetamidomethyl)-tetrahydrofuran and of 1-Phenyl-2-(acetamidomethyl)-pyrrole. In: Acta Chemica Scandinavica. 6, 1952, S. 667−670, doi:10.3891/acta.chem.scand.06-0667.
- ↑ John P. Clay: A new method for the preparation of alkane phosphonyl dichlorides. In: The Journal of Organic Chemistry. 16, 1951, S. 892, doi:10.1021/jo01146a010.
- ↑ A. M. Kinnear, E. A. Perren: 661. Formation of organo-phosphorus compounds by the reaction of alkyl chlorides with phosphorus trichloride in the presence of aluminium chloride. In: Journal of the Chemical Society. 1952, S. 3437, doi:10.1039/JR9520003437.
- ↑ J. O. Clayton, W. L. Jensen: Reaction of Paraffin Hydrocarbons with Phosphorus Trichloride and Oxygen to Produce Alkanephosphonyl Chlorides. In: Journal of the American Chemical Society. 70, 1948, S. 3880, doi:10.1021/ja01191a103.
- ↑ Erik Clemmensen: Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure. In: Berichte der deutschen chemischen Gesellschaft. 1913, 46, 2, S. 1837-1846, doi:10.1002/cber.19130460292.
- ↑ John B. Cloke: The formation of pyrrolines from gama-chloropropyl and cyclopropyl ketimines. In: Journal of the American Chemical Society. 51, 1929, S. 1174, doi:10.1021/ja01379a028.
- ↑ Christopher L. Wilson: Reactions of Furan Compounds. VII. Thermal Interconversion of 2,3-Dihydrofuran and Cyclopropane Aldehyde . In: Journal of the American Chemical Society. 69, 1947, S. 3002, doi:10.1021/ja01204a020.
- ↑ Theodore Cohen, Wlodzimierz M. Daniewsici, Robert B. Weisenfeld: A simple preparation of sulfur-stabilized cyclopropyl anions via reductive lithiation of cyclopropanone dithioketals. In: Tetrahedron letters. 1978, Band 19, Nummer 47, S. 4665–4668 doi:10.1016/S0040-4039(01)85699-9.
- ↑ J.C. Collins, W.W. Hess, F.J. Frank: Dipyridine-chromium(VI) oxide oxidation of alcohols in dichloromethane. In: Tetrahedron Letters. 9, 1968, S. 3363, doi:10.1016/S0040-4039(00)89494-0.
- ↑ Manning P. Cooke: Facile conversion of alkyl bromides into aldehydes using sodium tetracarbonylferrate(-II). In: Journal of the American Chemical Society. 92, 1970, S. 6080, doi:10.1021/ja00723a056.
- ↑ James P. Collman, Stanley R. Winter, Dennis R. Clark: Selective syntheses of aliphatic ketones using sodium tetracarbonylferrate(-II). In: Journal of the American Chemical Society. 94, 1972, S. 1788, doi:10.1021/ja00760a084.
- ↑ Alphonse-Edmond Combes. In: Bull. Soc. Chim. Fr. 1888, 49, S. 89.
- ↑ J. M. Conia, P. Le Perchec: The Thermal Cyclisation of Unsaturated Carbonyl Compounds. In: Synthesis. 1975, Band 1975, Nummer 01, S. 1–19 doi:10.1055/s-1975-23652.
- ↑ M. Conrad, L. Limpach: Synthesen von Chinolinderivaten mittelst Acetessigester. In: Berichte der deutschen chemischen Gesellschaft. 1887, 20, 1, S. 944-948, doi:10.1002/cber.188702001215.
- ↑ Arthur C. Cope, Theodore T. Foster, Philip H. Towle: Thermal Decomposition of Amine Oxides to Olefins and Dialkylhydroxylamines. In: J. Am. Chem. Soc. 1949, 71, 12, S. 3929–3934, doi:10.1021/ja01180a014.
- ↑ Arthur C. Cope, Elizabeth M. Hardy: The Introduction of Substituted Vinyl Groups. V. A Rearrangement Involving the Migration of an Allyl Group in a Three-Carbon System. In: J. Am. Chem. Soc. 1940, 62, 2, S. 441–444, doi:10.1021/ja01859a055.
- ↑ E. J. Corey, Raman K. Bakshi, Saizo Shibata: Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications. In: J. Am. Chem. Soc. 1987, 109, 18, S. 5551–5553, doi:10.1021/ja00252a056.
- ↑ E. J. Corey, Michael Chaykovsky: Dimethylsulfoxonium Methylide. In: J. Am. Chem. Soc. 1962, 84, 5, S. 867–868, doi:10.1021/ja00864a040.
- ↑ E. J. Corey, P. L. Fuchs: A synthetic method for formyl→ethynyl conversion (RCHO→RC≡CH or RC≡CR′). In: Tetrahedron Letters. 1972, 13, 36, S. 3769-3772, doi:10.1016/S0040-4039(01)94157-7.
- ↑ E. J. Corey, Gary H. Posner: Selective formation of carbon-carbon bonds between unlike groups using organocopper reagents. In: Journal of the American Chemical Society. 1967, Band 89, Nummer 15, S. 3911–3912 doi:10.1021/ja00991a049.
- ↑ Herbert O. House, William L. Respess, George M. Whitesides: The Chemistry of Carbanions. XII. The Role of Copper in the Conjugate Addition of Organometallic Reagents1. In: Journal of organic chemistry. 1966, Band 31, Nummer 10, S. 3128–3141 doi:10.1021/jo01348a012.
- ↑ Elias J. Corey, Norman W. Gilman, B. E. Ganem: New methods for the oxidation of aldehydes to carboxylic acids and esters. In: Journal of the American Chemical Society. 90, 1968, S. 5616, doi:10.1021/ja01022a059.
- ↑ E. J. Corey, C. U. Kim: New and highly effective method for the oxidation of primary and secondary alcohols to carbonyl compounds. In: J. Am. Chem. Soc. 1972, 94, 21, S. 7586–7587, doi:10.1021/ja00776a056.
- ↑ E. J. Corey, G. T. Kwiatkowski: The Synthesis of Olefins from Carbonyl Compounds and Phosphonic Acid Bisamides. In: Journal of the American Chemical Society. 1966, Band 88, Nummer 23, S. 5652–5653 doi:10.1021/ja00975a055.
- ↑ E. J. Corey, John O. Link: A general, catalytic, and enantioselective synthesis of .alpha.-amino acids. In: Journal of the American Chemical Society. 1992, Band 114, Nummer 5, S. 1906–1908 doi:10.1021/ja00031a069.
- ↑ E. J. Corey, Kyriacos C. Nicolaou: Efficient and mild lactonization method for the synthesis of macrolides. In: J. Am. Chem. Soc. 1974, 96, 17, S. 5614–5616, doi:10.1021/ja00824a073.
- ↑ E.J. Corey, Greg Schmidt: Useful procedures for the oxidation of alcohols involving pyridinium dichromate in aprotic media. In: Tetrahedron Letters. 20, 1979, S. 399, doi:10.1016/S0040-4039(01)93515-4.
- ↑ E. J. Corey, D. Seebach: Carbanionen der 1,3-Dithiane, Reagentien zur C–C-Verknüpfung durch nucleophile Substitution oder Carbonyl-Addition. In: Angewandte Chemie. 1965, 77, 24, S. 1134-1135, doi:10.1002/ange.19650772405.
- ↑ E.J. Corey, J.William Suggs: Pyridinium chlorochromate. An efficient reagent for oxidation of primary and secondary alcohols to carbonyl compounds. In: Tetrahedron Letters. 16, 1975, S. 2647, doi:10.1016/S0040-4039(00)75204-X.
- ↑ E. J. Corey, Roland A. E. Winter: A New, Stereospecific Olefin Synthesis from 1,2-Diols. In: J. Am. Chem. Soc. 1963, 85, 17, S. 2677–2678, doi:10.1021/ja00900a043.
- ↑ John W. Cornforth In: Hans T. Clarke: The Chemistry of Penicillin. Princeton University Press, New Jersey 1949, ISBN 0-691-07922-6, S. 700.
- ↑ Lyman C. Craig: A Study of the Preparation of Alpha-Pyridyl Halides from Alpha-Aminopyridine by the Diazo Reaction. In: Journal of the American Chemical Society. 1934, Band 56, Nummer 1, S. 231–232 doi:10.1021/ja01316a072.
- ↑ Rudolf Criegee: Eine oxydative Spaltung von Glykolen (II. Mitteil. über Oxydationen mit Blei(IV)-salzen). In: Berichte der deutschen chemischen Gesellschaft. 1931, 64, 2, S. 260-266, doi:10.1002/cber.19310640212.
- ↑ Rudolf Criegee, Gotthilf Wenner: Die Ozonisierung des 9,10-Oktalins. In: Justus Liebigs Annalen der Chemie. 1949, 564, 1, S. 9-15, doi:10.1002/jlac.19495640103.
- ↑ Rudolf Criegee: Ein neuer Weg in die Cyclodecanreihe. In: Berichte der deutschen chemischen Gesellschaft. 77, 1945, S. 722, doi:10.1002/cber.19450770912.
- ↑ Alex. Crum Brown, James Walker: Elektrolytische Synthese zweibasischer Säuren. In: Justus Liebigs Annalen der Chemie. 1891, Band 261, Nummer 1, S. 107–128 doi:10.1002/jlac.18912610106.
- ↑ Theodor Curtius: Ueber Stickstoffwasserstoffsäure (Azoimid) N3H. In: Berichte der deutschen chemischen Gesellschaft. 1890, 23, 2, S. 3023-3033, doi:10.1002/cber.189002302232.
