Benutzer:Orci/Namensreaktionen/R
Zur Navigation springen
Zur Suche springen
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Radziszewski-Synthese | |||||
| Bronisław Leonard Radziszewski | 1882 | Diketone, Ammoniak, Aldehyde | Bildung eines Diimins, Reaktion mit Carbonylgruppe | Imidazole | [1][2] |

| |||||
| Ramberg-Bäcklund-Reaktion | |||||
| Ludwig Ramberg, Birger Bäcklund | 1940 | α-Halogen-Sulfone, Base | nukleophile Substitution, Abspaltung von SO2 | Alkene | [3] |
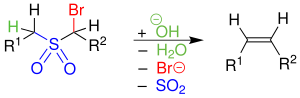
| |||||
| Rauhut-Currier-Reaktion | |||||
| Michael M Rauhut, Helen Currier | 1963 | elektronenarme Alkene wie Enone, Organophosphorverbindungen | Baylis-Hillman-Reaktion | Bildung einer C-C-Bindung zum Dimer | [4] |
| Reed-Reaktion | |||||
| Cortes F. Reed | 1933 | Alkane, Schwefeldioxid, Chlor | photochemische, radikalische Sulfochlorierung | Alkylsulfonylchloride | [5] |
| Reformatzki-Reaktion | |||||
| Sergei Nikolajewitsch Reformatski | 1887 | Aldehyde/Ketone, Zink, α-halogenierte Carbonsäureester | Bildung des Reformatzki-Reagenzes, nukleophile Addition, wässrige Aufarbeitung | β-Hydroxycarbonsäureester | [6] |

| |||||
| Regitz-Diazotransfer | |||||
| Otto Dimroth, Manfred Regitz | 1910/1964 | Diazo-Donoren (z.B. Azide), C-H-acide Verbindungen, Base | Deprotonierung, Übertragung einer Azogruppe | Diazoverbindungen | [7][8] |
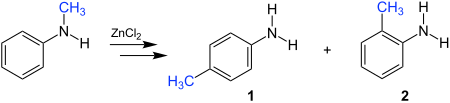
| Reilly-Hickinbottom-Umlagerung | |||||
| Joseph Reilly, Wilfred John Hickinbottom | 1920 | N-Alkylaniline, Lewis-Säure | Umlagerung | alkylsubstituierte Aniline | [9] |
| |||||
| Reimer-Tiemann-Reaktion | |||||
| Karl Ludwig Reimer, Friedrich Tiemann | 1876 | Phenole, Chloroform, Base | Bildung von Dichlorcarben, Anlagerung an Phenolat in ortho-Position, Rearomatisierung unter Chloridabspaltung, Hydrolyse | ortho-formylierte Phenole | [10] |

| |||||
| Reissert-Aldehydsynthese | |||||
| siehe Grosheintz-Fischer-Reissert-Aldehyd-Synthese | |||||
| Reissert-Indol-Synthese | |||||
| Arnold Reissert | 1897 | Nitrotoluole, Oxalsäuredimethylester, Base, Zinn(II)-chlorid | Deprotonierung, Addition/Eliminierung, Reduktion, Ringschluss, Abspaltung von Methanol, Wasser, CO2 | Indole | [11] |

| |||||
| Reissert-Reaktion | |||||
| Arnold Reissert | 1905 | Pyridine/Chinoline, Säurechloride, Kaliumcyanid | Acylierung des Stickstoffs, Nucleophile aromatische Substitution | funktionalisierte Pyridine/Chinoline | [12] |

| |||||
| Reppe-Alkin-Cyclotrimerisierung | |||||
| Walter Reppe | 1948 | Alkine, Nickel(II)-/Palladium/Rhodium-Komplexe | [2+2+2]-Cyclotrimerisation | Benzolderivate | [13] |

| |||||
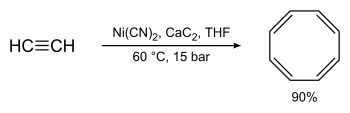
| Reppe-Cyclisierung | |||||
| Walter Reppe | 1948 | Alkine, Nickel(II)-Komplex | [2+2+2+2]-Cyclotetramerisation | Cyclooctatetraene | [14] |
| |||||
| Reppe-Carbonylierung | |||||
| Walter Reppe | 1953 | Alkene/Alkine, Kohlenstoffmonoxid, Wasser/Alkohole/Carbonsäuren, Palladium- oder Cobalt-Komplexe | Dreikomponentenreaktion | α,β-ungesättigte Carbonsäuren/Ester/Anhydride | [15] |

| |||||
| Reppe-Vinylierung | |||||
| Walter Reppe | 1933 | Ethin, Alkohole/Thiole/Amine/Carbonsäuren, Base | nucleophile Addition | Vinylether/Vinylsulfide/Enamine/Vinylester | [16] |
| Reverdin-Reaktion | |||||
| Frédéric Reverdin | 1896 | 4-Iodanisol, Salpetersäure | aromatische Nitrierung mit Umlagerung | 2-Iod-4-nitroanisol | [17] |

| |||||
| Riehm-Chinolinsynthese | |||||
| P. Riehm | 1885 | Arylaminhydrochloride, Ketone, Aluminiumtrichlorid | aromatische Cyclisierung mit Methanabspaltung | Chinoline | [18] |
| Riemschneider-Thiocarbamatsynthese | |||||
| Randolph Riemschneider | 1951 | Thiocyanate, Schwefelsäure, Wasser/Alkohole | Protonierung, Bildung eines Carbokations, innermolekulare Umlagerung | Thiocarbamate | [19] |

| |||||
| Riley-Oxidation | |||||
| Harry Lister Riley | 1932 | Ketone/Alkene, Selendioxid | Oxidation in α-Position | Aldehyde/Ketone/Alkene | [20] |
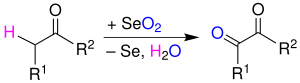
| |||||
| Ritter-Reaktion | |||||
| John Joseph Ritter | 1948 | Nitrile, Alkohole/Alkene, Säure | Bildung eines Carbeniumions, Nukleophiler Angriff, Hydrolyse, Protonenumlagerung | N-Alkylamide | [21] |

| |||||
| Robinson-Anellierung | |||||
| Robert Robinson | 1935 | Ketone, α,β-ungesättigte Ketone, Base | Michael-Reaktion, Aldolreaktion | Bildung von Sechsringen | [22] |

| |||||
| Robinson-Gabriel-Synthese | |||||
| Robert Robinson, Siegmund Gabriel | 1909 | N-Acyl-α-aminoketone, schweflige Säure | Protonierung, intermolekulare Kondensation, Dehydrierung | Oxazole | [23][24] |

| |||||
| Robinson-Schöpf-Reaktion | |||||
| Robert Robinson, Clemens Schöpf | 1917/1935 | Methylamin, Acetondicarbonsäure, Aldehyde | doppelte Mannich-Reaktion | Tropan-Alkaloide | [25][26] |

| |||||
| Rosenmund-Reduktion | |||||
| Karl Wilhelm Rosenmund | 1918 | Carbonsäurechloride, Wasserstoff, Palladium (Katalysator) | Reduktion | Aldehyde | [27] |

| |||||
| Rosenmund-von-Braun-Synthese | |||||
| Karl Wilhelm Rosenmund, Julius von Braun | 1919/1931 | Arylhalogenide, Kupfer(I)-cyanid | nukleophile aromatische Substitution | Arylnitrile | [28][29] |

| |||||
| Rothemund-Reaktion | |||||
| Paul Rothemund | 1935 | Pyrrol, Aldehyde, Säure | Bildung eines Dipyrromethans, Ringschluss, Oxidation | Porphyrine | [30] |

| |||||
| Roush-Reaktion | |||||
| William R. Roush | 1985 | Aldehyde, Crotonboronate, Base | asymetrische Allylierung | chirale Homoallylalkohole | [31] |

| |||||
| Rowe-Umlagerung | |||||
| Frederick Maurice Rowe | 1926 | Phthalazin-1-one, Säure | Umlagerung | Phthalazinone | [32] |

| |||||
| Rubottom-Oxidation | |||||
| George M. Rubottom | 1974 | Aldehyde/Ketone, meta-Chlorperbenzoesäure, Triethylsilyltriflat, Triethylamin | Oxidation | α-Hydroxy-Ketone/-Aldehyde | [33] |
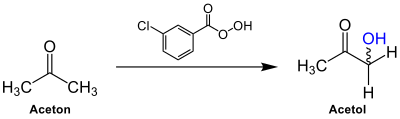
| |||||
| Ruff-Abbau (Ruff-Fenton-Abbau) | |||||
| Otto Ruff | 1898 | Aldosen, Bromlösung, Wasserstoffperoxid, Eisen(III)-salze | oxidative Decarboxylierung | um ein C-Atom verkürzte Aldosen | [34] |

| |||||
| Rupe-Umlagerung | |||||
| Hans Rupe | 1926 | tertiäre Propargylalkohole, Säure | Abspaltung von Wasser, Bildung einer Enin-Zwischenstufe, Reaktion mit Wasser | α,β-ungesättigte Ketone | [35] |
| Ružička-Ringsynthese | |||||
| Leopold Ružička | 1926 | α,ω-Dicarbonsäuren, Thoriumdioxid | Cyclisierung | cyclische Ketone | [36] |
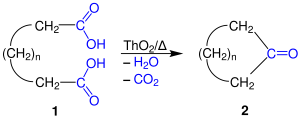
| |||||
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ Br. Radziszewski: Ueber die Constitution des Lophins und verwandter Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 15, 1882, S. 1493, doi:10.1002/cber.18820150207.
- ↑ Br. Radzisewski: Ueber Glyoxalin und seine Homologe. In: Berichte der deutschen chemischen Gesellschaft. 15, 1882, S. 2706, doi:10.1002/cber.188201502245.
- ↑ L. Ramberg, B. Bäcklund: Ark. Chim., Mineral Geol. 1940, 27, 13A, S. 1- 50.
- ↑ Patent US3074999A: Preparation of dialkyl 2-methyleneglutarates. Angemeldet am 31. Dezember 1958, veröffentlicht am 22. Januar 1963, Anmelder: American Cyanamid Co, Erfinder: Michael M Rauhut, Helen Currier.
- ↑ Patent US2046090: Method of halogenating compounds and product resulting therefrom. Angemeldet am 29. Dezember 1933, veröffentlicht am 30. Juni 1936, Erfinder: Cortes F. Reed.
- ↑ Sergius Reformatsky: Neue Synthese zweiatomiger einbasischer Säuren aus den Ketonen. In: Berichte der deutschen chemischen Gesellschaft. 20, 1887, S. 1210, doi:10.1002/cber.188702001268.
- ↑ Otto Dimroth: Über intramolekulare Umlagerungen. In: Justus Liebig's Annalen der Chemie. 373, 1910, S. 336, doi:10.1002/jlac.19103730306.
- ↑ Manfred Regitz: Reaktionen aktiver Methylenverbindungen mit Aziden, I. Eine neue Synthese für α-Diazo-β-dicarbonylverbindungen aus Benzolsulfonylaziden und β-Diketonen. In: Justus Liebigs Annalen der Chemie. 676, 1964, S. 101, doi:10.1002/jlac.19646760112.
- ↑ Joseph Reilly, Wilfred John Hickinbottom: XV.—Intramolecular rearrangement of the alkylarylamines: formation of 4-amino-n-butylbenzene. In: J. Chem. Soc., Trans.. 117, 1920, S. 103, doi:10.1039/CT9201700103.
- ↑ K. Reimer, F. Tiemann: Ueber die Einwirkung von Chloroform auf alkalische Phenolate. In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 1, 1876, S. 824–828, (Digitalisat). – K. Reimer, F. Tiemann: Ueber die Einwirkung von Chloroform auf alkalische Phenole und besonders aromatische Oxysäuren in alkalischer Lösung. In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 2, 1876, S. 1268–1278, (Digitalisat). – K. Reimer, F. Tiemann: Ueber die Einwirkung von Tetrachlorkohlenstoff auf Phenol in alkalischer Lösung (Bildung von Salicylsäure und Paroxybenzooesäure). In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 2, 1876, S. 1285–1287, (Digitalisat).
- ↑ Arnold Reissert: Einwirkung von Oxalester und Natriumäthylat auf Nitrotoluole. Synthese nitrirter Phenylbrenztraubensäuren. In: Berichte der deutschen chemischen Gesellschaft. 30, 1897, S. 1030, doi:10.1002/cber.189703001200.
- ↑ Arnold Reissert: Ueber die Einführung der Benzoyl-gruppe in tertiäre cyclische Basen. In: Berichte der deutschen chemischen Gesellschaft. 38, 1905, S. 1603, doi:10.1002/cber.19050380260.
- ↑ Walter Reppe, Walter Schweckendiek: Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen. In: Justus Liebigs Annalen der Chemie. 1948, Band 560, Nummer 1, S. 104–116 doi:10.1002/jlac.19485600104.
- ↑ Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel: Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen. In: Justus Liebigs Annalen der Chemie. 1948, Band 560, Nummer 1, S. 1–92 doi:10.1002/jlac.19485600102.
- ↑ Walter Reppe: Carbonylierung I. Über die Umsetzung von Acetylen mit Kohlenoxyd und Verbindungen mit reaktionsfähigen Wasserstoffatomen Synthesen α,β‐ungesättigter Carbonsäuren und ihrer Derivate. In: Justus Liebigs Annalen der Chemie. 1953, Band 582, Nummer 1, S. 1–37 doi:10.1002/jlac.19535820102.
- ↑ Patent DE584840: Verfahren zur Darstellung von Vinylaethern. Veröffentlicht am 25. September 1933, Erfinder: Walter Reppe.
- ↑ Frédéric Reverdin: Ueber einige Jodderivate des Anisols und über einen Wanderungsfall des Jod-Atoms. In: Berichte der deutschen chemischen Gesellschaft. 29, 1896, S. 997, doi:10.1002/cber.189602901190.
- ↑ C. Engler, P. Riehm: Ueber die Einwirkung von Aceton auf Anilin. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 2245, doi:10.1002/cber.18850180288.
- ↑ R. Riemschneider, F. Wojahn, G. Orlick: Thiocarbamates. III. Aryl Thiocarbamates from Aryl Thiocyanates. In: Journal of the American Chemical Society. 73, 1951, S. 5905, doi:10.1021/ja01156a552.
- ↑ Harry Lister Riley, John Frederick Morley, Norman Alfred Child Friend: 255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones. In: Journal of the Chemical Society. 1932, S. 1875, doi:10.1039/jr9320001875.
- ↑ John J. Ritter, P. Paul Minieri: A New Reaction of Nitriles. I. Amides from Alkenes and Mononitriles. In: Journal of the American Chemical Society. 70, 1948, S. 4045, doi:10.1021/ja01192a022.
- ↑ William Sage Rapson, Robert Robinson: 307. Experiments on the synthesis of substances related to the sterols. Part II. A new general method for the synthesis of substituted cyclohexenones. In: Journal of the Chemical Society. 1935, S. 1285, doi:10.1039/JR9350001285.
- ↑ Robert Robinson: CCXXXII.—A new synthesis of oxazole derivatives. In: J. Chem. Soc., Trans.. 95, 1909, S. 2167, doi:10.1039/ct9099502167.
- ↑ S. Gabriel: Eine Synthese von Oxazolen und Thiazolen. I. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 134, doi:10.1002/cber.19100430117.
- ↑ Robert Robinson: LXIII.—A synthesis of tropinone. In: J. Chem. Soc., Trans.. 111, 1917, S. 762, doi:10.1039/CT9171100762.
- ↑ Clemens Schöpf, Gerhard Lehmann: Die Synthese des Tropinons, Pseudopelletierins, Lobelanins und verwandter Alkaloide unter physiologischen Bedingungen. In: Justus Liebig's Annalen der Chemie. 518, 1935, S. 1, doi:10.1002/jlac.19355180102.
- ↑ Karl W. Rosenmund: Über eine neue Methode zur Darstellung von Aldehyden. 1. Mitteilung. In: Berichte der deutschen chemischen Gesellschaft. 51, 1918, S. 585, doi:10.1002/cber.19180510170.
- ↑ Karl W. Rosenmund, Erich Struck: Das am Ringkohlenstoff gebundene Halogen und sein Ersatz durch andere Substituenten. I. Mitteilung: Ersatz des Halogens durch die Carboxylgruppe. In: Berichte der deutschen chemischen Gesellschaft. 52, 1919, S. 1749, doi:10.1002/cber.19190520840.
- ↑ Julius v. Braun, Gottfried Manz: Fluoranthen und seine Derivate. III. Mitteilung. In: Justus Liebig's Annalen der Chemie. 488, 1931, S. 111, doi:10.1002/jlac.19314880107.
- ↑ Paul Rothemund: Formation of porphyrins from pyrrole and aldehydes. In: Journal of the American Chemical Society. 57, 1935, S. 2010, doi:10.1021/ja01313a510.
- ↑ William R. Roush, Alan E. Walts, Lee K. Hoong: Diastereo- and enantioselective aldehyde addition reactions of 2-allyl-1,3,2-dioxaborolane-4,5-dicarboxylic esters, a useful class of tartrate ester modified allylboronates. In: Journal of the American Chemical Society. 107, 1985, S. 8186, doi:10.1021/ja00312a062.
- ↑ Frederick Maurice Rowe, Esther Levin, Alan Chamley Burns, John Stanley Herbert Davies, Wolfe Tepper: XCVI.—A new reaction of certain diazosulphonates derived from β-naphthol-1-sulphonic acid. Part I. Preparation of phthalazine, phthalazone, and phthalimidine derivatives from 4′-nitrobenzene-2-naphthol-1-diazosulphonate. In: J. Chem. Soc.. 129, 1926, S. 690, doi:10.1039/JR9262900690.
- ↑ G.M. Rubottom, M.A. Vazquez, D.R. Pelegrina: Peracid oxidation of trimethylsilyl enol ethers: A facile α-hydroxylation procedure. In: Tetrahedron Letters. 15, 1974, S. 4319, doi:10.1016/S0040-4039(01)92153-7.
- ↑ Otto Ruff: Ueber die Verwandlung derd-Gluconsäure ind-Arabinose. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 1573, doi:10.1002/cber.18980310250.
- ↑ H. Rupe, E. Kambli: Ungesättigte Aldehyde aus Acetylen-alkoholen. In: Helvetica Chimica Acta. 9, 1926, S. 672, doi:10.1002/hlca.19260090185.
- ↑ L. Ruzicka, M. Stoll, H. Schinz: Zur Kenntnis des Kohlenstoffringes II. Synthese der carbocyclischen Ketone vom Zehner- bis zum Achtzehnerring. In: Helvetica Chimica Acta. 9, 1926, S. 249, doi:10.1002/hlca.19260090130.