Dimethyldisulfid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
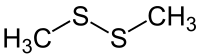
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethyldisulfid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H6S2 | ||||||||||||||||||
| Kurzbeschreibung |
leichtentzündliche, flüchtige, farblose bis gelbliche Flüssigkeit mit unangenehmem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 94,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,06 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−85 °C[1] | ||||||||||||||||||
| Siedepunkt |
110 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer in Wasser (2,5 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,5289 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−62,6 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Dimethyldisulfid ist eine chemische Verbindung aus der Gruppe der organischen Disulfide.
Vorkommen[Bearbeiten | Quelltext bearbeiten]

Dimethyldisulfid ist einer der Geruchstoffe von Stinkmorcheln.[6][7][8] Es ist als Abbauprodukt von Methional eine der Ursachen des Lichtgeschmacks von Milch.[9] Es kommt als Aromastoff in einer Vielzahl von Lebensmitteln, wie z. B. Kohl- und Lauch-Arten, Wein, Käse und Bier vor.[10]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Dimethyldisulfid kann durch Reaktion von Methanthiol mit elementarem Schwefel gewonnen werden.
Zusammen mit dem Monosulfid und dem Trisulfid entsteht Dimethyldisulfid z. B. thermisch aus schwefelhaltigen Aminosäuren wie Methionin.[10]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Dimethyldisulfid ist eine brennbare, farblose bis gelbliche Flüssigkeit mit unangenehmem Geruch. Die Geruchsschwelle liegt bei 7–12 ppb.[11]
Die Dämpfe von Dimethyldisulfid können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 10 °C, Zündtemperatur 370 °C) bilden.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Dimethyldisulfid dient in Ölraffinerien als Sulfidierungsmittel und in der petrochemischen Industrie als Hilfsstoff beim Cracken von Erdöl.[12]
In den USA ersetzt es zunehmend Methylbromid als Begasungsmittel.[13]
Dimethyldisulfid kann auch als Indikator für mikrobielle Kontamination dienen.[10] So gilt die Verbindung neben Dimethylsulfid als Indikator für Schimmelbefall und für Bakterienbefall in Abwasserleitungen.[14][15]
Analytik[Bearbeiten | Quelltext bearbeiten]
Die quantitative Bestimmung von Dimethylsulfid erfolgt nach geeigneter Probenvorbereitung durch gaschromatographische Dampfraumanalyse mit einem schwefelsensitiven Detektor (Sulfur Chemiluminescence Detector, SCD).[10]
Risikobewertung[Bearbeiten | Quelltext bearbeiten]
Dimethyldisulfid wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Dimethyldisulfid waren die Besorgnisse bezüglich Umweltexposition und hoher (aggregierter) Tonnage. Die Neubewertung fand ab 2014 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[16][17]
Verwandte Verbindungen[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Eintrag zu Dimethyl disulfide in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu Dimethyldisulfid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-198.
- ↑ Eintrag zu Dimethyl disulphide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Dimethyldisulfid bei Sigma-Aldrich, abgerufen am 24. Februar 2022 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ Geruchs- und Farbstoffe der Rutenpilze.
- ↑ Bernhard Freund: Die Geruchstoffe der Stinkmorchel Phallus impudicus L. 1967 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anna-Karin Borg-Karlson, Finn Englund, C. Rikard Unelius: Dimethyl oligosulphides, major volatiles released from Sauromatum guttatum and Phallus impudicus. In: Phytochemistry. 1994, Band 35, Nummer 2, S. 321–323 doi:10.1016/S0031-9422(00)94756-3.
- ↑ Alfred Töpel: Chemie und Physik der Milch. Behr’s Verlag DE, 2015, ISBN 978-3-95468-360-4, S. 706 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d Eintrag zu Dimethyldisulfid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Februar 2017.
- ↑ EPA Pesticide Fact Sheet Dimethyl Disulfide vom 9. Juli 2010, S. 7, abgerufen am 13. Oktober 2014.
- ↑ Arkema: Dimethyl Disulfide, abgerufen am 28. Februar 2017.
- ↑ DMDS for agricultural soil fumigation
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen. Springer-Verlag, 2015, ISBN 978-3-658-07310-7, S. 83 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Karl Höll: Wasser Nutzung im Kreislauf: Hygiene, Analyse und Bewertung. Walter de Gruyter, 2011, ISBN 978-3-11-022678-2, S. 509 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Dimethyl disulphide, abgerufen am 26. März 2019.
- CoRAP-Stoff
- Feuergefährlicher Stoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 40
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Einatmen
- Sensibilisierender Stoff
- Augenreizender Stoff
- Betäubender Stoff
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Organisches Disulfid
- Aromastoff (EU)
- Begasungsmittel
- Futtermittelzusatzstoff (EU)




