Theorie des Übergangszustandes
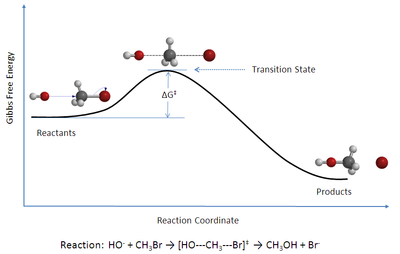
Die Theorie des Übergangszustandes[1][2][3] (englisch Transition state theory, TST), auch Eyring-Theorie genannt (nach Henry Eyring,[4] 1901–1981), ist eine molekulare Theorie zur Reaktionskinetik. Sie wurde hergeleitet unter Berücksichtigung molekularer Größen, der Zustandssummen, und ermöglicht die Bestimmung der absoluten Geschwindigkeitskonstanten einer chemischen Reaktion. Diese Reaktionsrate kann dann in einer Ratengleichung verwendet werden. Zu den Begründern der Theorie zählen neben Eyring in Princeton Eugene Paul Wigner[5] sowie Michael Polanyi und Meredith Gwynne Evans[6] in England. Die TST erklärt unter anderem den Mechanismus der Katalyse: durch eine Erniedrigung der Potentialbarriere wird die Geschwindigkeitskonstante erhöht.
Grundprinzip[Bearbeiten | Quelltext bearbeiten]
Die Edukte sind von den Produkten durch einen Potentialwall (Aktivierungsbarriere) getrennt, der einen Sattelpunkt auf der Potentialhyperfläche darstellt. Nach David Chandler handelt es sich um die Potentialhyperfläche eines thermodynamischen Potentials wie der Helmholtz-Energie.[7] Die Reaktion der Edukte über den Übergangszustand zu den Produkten verläuft entlang einer Trajektorie (siehe dazu auch Phasenraumanalyse) der Reaktionskoordinate (Weg zwischen den Edukten und Produkten mit jeweils minimaler Änderung der potentiellen Energie). Der Punkt höchster potentieller Energie auf dieser Reaktionskoordinate ist der Übergangszustand. Der Begriff Aktivierter Komplex bezeichnet die Anordnung der Teilchen im Übergangszustand (es handelt sich nicht um einen Komplex im Sinne des Artikels Komplexchemie)[8]. Kramers Theorie zur Reaktionskinetik erweitert die TST.
Die wichtigsten Annahmen, die der TST zugrunde liegen, sind:
- Separation von Kern- und Elektronenbewegung, analog zur Born-Oppenheimer-Näherung
- Die Wahrscheinlichkeitsdichte der Energiezustände der Edukte lässt sich durch eine Boltzmann-Verteilung beschreiben.
- Im Übergangszustand kann die Bewegung entlang der Reaktionskoordinate von anderen Bewegungen separiert und klassisch als Translation behandelt werden.
- Der Übergangszustand steht mit den Edukten in einem Gleichgewicht. (Quasi-Gleichgewichts-Hypothese)
- Nur Edukte reagieren zu Produkten, nicht umgekehrt (Einbahnstraßenverkehr).
Eyring-Gleichung[Bearbeiten | Quelltext bearbeiten]
Als Ergebnis der TST ergibt sich die Eyring-Gleichung. Diese postuliert, dass bei einer gegebenen Temperatur die Geschwindigkeitskonstante einer betrachteten chemischen Reaktion proportional zu einer Gleichgewichtskonstante ist, die ein durch die TST postuliertes Gleichgewicht zwischen den Ausgangsstoffen und dem aktivierten Komplex charakterisiert:
Der Proportionalitätsfaktor enthält neben der Boltzmann-Konstante und der Planck-Konstante einen sogenannten Transmissionskoeffizient . Dieser steht in keinem Zusammenhang mit der optischen Größe Transmission, sondern repräsentiert die Wahrscheinlichkeit, dass nach der Überwindung der Potentialbarriere aus dem aktivierten Komplex die Reaktionsprodukte entstehen (in der Terminologie der Originalveröffentlichungen transmittieren Ausgangsstoffe die Potentialbarriere oder werden an dieser reflektiert). Der Transmissionskoeffizient wird häufig gleich eins gesetzt. Der Wert von würde kleiner eins sein, wenn das reagierende System nach dem Überwinden der Potentialbarriere, die Ausgangsstoffe und Produkte trennt, wieder die Ausgangsstoffe bildet. Derartige Reaktionsereignisse würden jedoch die Annahme verletzen, dass zwischen Ausgangsstoffen und aktiviertem Komplex ein Gleichgewicht besteht. Werte von größer eins würden implizieren, dass der Potentialwall, der Ausgangsstoffe und Produkte trennt, auf anderen Wegen als über den aktivierten Komplex überwunden oder untertunnelt werden kann.[9][10]
Der Zusammenhang zwischen der thermodynamischen Gleichgewichtskonstante und der molaren freien Reaktionsenthalpie einer betrachteten Reaktion ist mit als molarer Gaskonstante
beziehungsweise
.
Die TST-Theorie postuliert einen analogen Zusammenhang zwischen und einer freien Aktivierungsenthalpie (die hier keine molare Größe sein, sondern eine einzelne molekulare Elementarreaktion beschreiben soll). ist die Differenz der freien Enthalpien des Übergangszustandes und des Ausgangszustandes.[2] Man erhält
beziehungsweise
.
Entsprechend ergibt sich der Zusammenhang zwischen der Geschwindigkeitskonstante und :
sollte nicht mit der in der Arrhenius-Gleichung auftretenden Aktivierungsenergie gleichgesetzt werden. Während die Aktivierungsbarriere eines einzelnen molekularen Reaktionsereignisses in Form einer Elementarreaktion beschreibt, ist die phänomenologisch ermittelbare Aktivierungsbarriere von Bruttoreaktionen, die ein komplexes Zusammenspiel mehrerer Elementarreaktion umfassen können.[11]
Herleitung[Bearbeiten | Quelltext bearbeiten]
Die Herleitung erfolgt für eine Beispielreaktion, in der die Edukte und zum Produkt reagieren. Als Zwischenstufe wird der Übergangszustand definiert.
Die Reaktionsgeschwindigkeit wird als Produktbildungsgeschwindigkeit definiert,
wobei die relative Aktivität des Übergangszustandes durch die Gleichgewichtskonstante des vorgelagerten Gleichgewichtes (gemäß dem Reaktionsquotienten)
und die Konzentrationen von A und B ersetzt wird. Es ergibt sich:
Man fasst zusammen und bezieht die Produktbildungsgeschwindigkeit auf die Edukte und
und erhält für die Geschwindigkeitskonstante
Die weitere Herleitung unterscheidet sich je nach Lehrbuch. Es ergibt sich die oben angegebene Eyring-Gleichung.
Die Geschwindigkeitskonstante ergibt sich als
wobei der Transmissionskoeffizient nicht abgeleitet wird, sondern als zusätzlicher Parameter zur Anpassung von experimentellen Ergebnissen an die berechneten eingeführt wird.
Damit gilt also:
- .
mit und der Differenz der Standard Gibbs Energie der Edukte und des Übergangszustandes.
hat bei einen Wert von und wird als Frequenz-Faktor bezeichnet. Er liegt in der Größenordnung von Stoßfrequenzen der Moleküle in Flüssigkeiten.
Somit ergibt sich die endgültige Form:
Thermodynamische Formulierung[Bearbeiten | Quelltext bearbeiten]
Mit der van’t-Hoffschen Reaktionsisobare ergibt sich:
Die Legendre-Transformation der Gibbs-Helmholtz-Gleichung erlaubt eine Darstellung als:
Aus der Arrhenius-Gleichung ergibt sich eine formale Definition für die Aktivierungsenergie :
Analog lässt sich die Eyring-Gleichung unter Berücksichtigung der van’t-Hoffschen Reaktionsisobare umschreiben:
Daraus folgt mit der Definition der Enthalpie (bei konstantem Druck):
Für unimolekulare Reaktionen ist und für Reaktionen in Lösungen und kondensierter Materie näherungsweise Null:
Bei idealen Gasen ergibt sich für den präexponentiellen Faktor:
Kritik[Bearbeiten | Quelltext bearbeiten]
- Die TST basiert auf der klassischen Mechanik. Bei Reaktionen sehr leichter Spezies, zum Beispiel Wasserstoff- oder Deuterium-Atome, treten Tunneleffekte auf, für deren Beschreibung eine quantenmechanische TST nötig wäre. Dieses Problem wurde bisher noch nicht zufriedenstellend gelöst.
- Nur wenn die Bewegung auf der Potentialhyperfläche eine eindimensionale Bewegung entlang der Reaktionskoordinaten ist, ist die Annahme gerechtfertigt, dass die Bewegung entlang der Reaktionskoordinaten separiert werden kann von den anderen Freiheitsgraden. Diese Annahme ist aber für die Herleitung der Eyring-Gleichung nötig.
- Für höhere Temperaturen sind anharmonische Korrekturen des Potentials am Sattelpunkt nötig.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Theorie des Übergangszustands: Betrachtung aus dem Phasenraum ( vom 24. April 2009 im Internet Archive) (Englisch, PDF)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu Transition State Theory. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.T06470 – Version: 2.3.3.
- ↑ a b Keith J. Laidler, M. Christine King: Development of transition-state theory. In: The Journal of Physical Chemistry. Band 87, Nr. 15, 1983, ISSN 0022-3654, S. 2657–2664, doi:10.1021/j100238a002 (acs.org [abgerufen am 7. Mai 2024]).
- ↑ Eli Pollak, Peter Talkner: Reaction rate theory: What it was, where is it today, and where is it going? In: Chaos: An Interdisciplinary Journal of Nonlinear Science. Band 15, Nr. 2, 2005, ISSN 1054-1500, S. 026116, doi:10.1063/1.1858782 (aip.org).
- ↑ Henry Eyring: The Activated Complex in Chemical Reactions. In: The Journal of Chemical Physics. Band 3, Nr. 2, 1935, ISSN 0021-9606, S. 107–115, doi:10.1063/1.1749604 (aip.org [abgerufen am 7. Mai 2024]).
- ↑ E. Wigner: Über das Überschreiten von Potentialschwellen bei chemischen Reaktionen. In: Zeitschrift für Physikalische Chemie. 19B, Nr. 1, 1932, ISSN 2196-7156, S. 203–216, doi:10.1515/zpch-1932-1920 (degruyter.com [abgerufen am 7. Mai 2024]).
- ↑ M. G. Evans, M. Polanyi: Some applications of the transition state method to the calculation of reaction velocities, especially in solution. In: Transactions of the Faraday Society. Band 31, 1935, ISSN 0014-7672, S. 875–894, doi:10.1039/tf9353100875 (rsc.org [abgerufen am 7. Mai 2024]).
- ↑ David Chandler: Statistical mechanics of isomerization dynamics in liquids and the transition state approximation. In: The Journal of Chemical Physics. Band 68, Nr. 6, 1978, ISSN 0021-9606, S. 2959–2970, doi:10.1063/1.436049 (aip.org [abgerufen am 7. Mai 2024]).
- ↑ Eintrag zu Activated Complex. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00092 – Version: 2.3.3.
- ↑ W. F. K. Wynne-Jones, Henry Eyring: The Absolute Rate of Reactions in Condensed Phases. In: The Journal of Chemical Physics. Band 3, Nr. 8, 1935, ISSN 0021-9606, S. 492–502, doi:10.1063/1.1749713 (aip.org [abgerufen am 7. Mai 2024]).
- ↑ Andreas A. Zavitsas: Energy Barriers to Chemical Reactions. Why, How, and How Much? Non-Arrhenius Behavior in Hydrogen Abstractions by Radicals. In: Journal of the American Chemical Society. Band 120, Nr. 26, 1998, ISSN 0002-7863, S. 6578–6586, doi:10.1021/ja973698y.
- ↑ Ian W. M. Smith: The temperature-dependence of elementary reaction rates: beyond Arrhenius. In: Chem. Soc. Rev. Band 37, Nr. 4, 2008, ISSN 0306-0012, S. 812–826, doi:10.1039/B704257B (rsc.org [abgerufen am 7. Mai 2024]).























![{\displaystyle {\frac {\mathrm {d} \mathrm {[P]} }{\mathrm {d} t}}=k^{\ddagger }\cdot \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/abb6d7eacc55bc4cd924648b5ca9f7f115584d00)
![{\displaystyle \mathrm {[C^{\ddagger }]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f99bec1afeb7632554e0efa3914547efa27bbb)
![{\displaystyle K^{\ddagger }=\mathrm {\frac {[C^{\ddagger }]}{[A]\cdot [B]}} =\exp(-\Delta {G^{\ddagger }}^{\circ }/(k_{\mathrm {B} }T))}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2ed15184e66f719025b728d53697445bfea622d)
![{\displaystyle {\frac {\mathrm {d} \mathrm {[P]} }{\mathrm {d} t}}=k^{\ddagger }\cdot K^{\ddagger }\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2edaaf3f76b1b2e3a15df884f954603eca9e8de4)


![{\displaystyle {\frac {\mathrm {d} \mathrm {[P]} }{\mathrm {d} t}}=k\mathrm {\cdot [A]\cdot [B]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7de0656eaf5779f3583dbe5f4965b6ac7a59ccd9)























