„Ibuprofen“ – Versionsunterschied
| [ungesichtete Version] | [ungesichtete Version] |
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 45: | Zeile 45: | ||
}} |
}} |
||
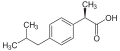
'''Ibuprofen''' ist ein [[ |
'''Ibuprofen''' ist ein [[Arzneistofff]] aus der Gruppe der [[Nichtsteroidales Antirheumatikum|nichtsteroidalen Antirheumatika]], der zur Behandlung von Schmerzen, Entzündungen und Fieber eingesetzt wird. Chemisch gehört es in die Gruppe der Arylpropionsäuren. Der Name leitet sich – mit einer Umstellung – von der Struktur ab: 2-(4-'''I'''so'''bu'''tyl'''phen'''yl) '''pro'''pionsäure. |
||
== Geschichte == |
== Geschichte == |
||
Version vom 19. Juli 2011, 07:55 Uhr
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
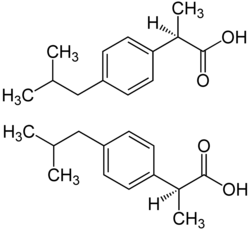
(R)-Form (oben) und (S)-Form (unten) | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ibuprofen | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | C13H18O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Wirkmechanismus |
hemmt nichtselektiv die Cyclooxygenasen I und II | ||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 206,28 g·mol−1 | ||||||||||||
| Aggregatzustand |
Feststoff | ||||||||||||
| Dichte |
1,175 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
154–157 °C (5 hPa)[3] | ||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser: 21 mg·l−1 (25 °C)[5] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Ibuprofen ist ein Arzneistofff aus der Gruppe der nichtsteroidalen Antirheumatika, der zur Behandlung von Schmerzen, Entzündungen und Fieber eingesetzt wird. Chemisch gehört es in die Gruppe der Arylpropionsäuren. Der Name leitet sich – mit einer Umstellung – von der Struktur ab: 2-(4-Isobutylphenyl) propionsäure.
Geschichte
Während der 1950er Jahre forschten Wissenschaftler nach wirksamen, nebenwirkungsarmen Substanzen zur Behandlung der rheumatoiden Arthritis.
Stewart Adams, John Nicholson und Colin Burrows, die zu dieser Zeit in der englischen Stadt Nottingham bei Boots the Chemists – seit 2006 Alliance Boots – arbeiteten, richteten ihr Hauptaugenmerk auf entzündungshemmende Stoffe. Im Jahr 1955 entdeckten sie, dass diese Stoffe eine durch ultraviolette Strahlung hervorgerufene Hautrötung (Erytheme) verringerten. Damit entstand ein leicht durchführbares Verfahren, um neue Verbindungen auf ihre entzündungshemmende Wirkung hin zu testen. Im August 1958 wurde die Bedeutung der Phenoxygruppe für die Entzündungshemmung entdeckt und eine Verbindung mit dem Kodenamen BTS 8402 aus 600 untersuchten Stoffen für die klinische Testung ab 1960 ausgewählt. Es stellte sich jedoch heraus, dass BTS 8402 nicht besser als Acetylsalicylsäure wirkte. Im Jahr darauf fanden sie eine weitere Klasse von Stoffen mit den erhofften Eigenschaften, zu der auch Ibuprofen gehört, worauf noch im selben Jahr ein Patentantrag eingereicht wurde. 1989 wurde zunächst die Dosierung von 200 mg aus der Verschreibungspflicht entlassen.
Pharmakologie
Ibuprofen hemmt nichtselektiv die Cyclooxygenasen I und II, die im Organismus für die Bildung von entzündungsvermittelnden Prostaglandinen verantwortlich sind. Daraus resultieren die Wirkungen von Ibuprofen: Es wirkt schmerzstillend (analgetisch), entzündungshemmend (antiphlogistisch) und fiebersenkend (antipyretisch). Nebenwirkungen, wie Magenblutungen, sind ebenfalls auf eine Hemmung der Prostaglandinsynthese zurückzuführen, da Prostacyclin an der Thrombozytenaggregation beteiligt ist.
Pharmakokinetik
Die Plasmahalbwertszeit beträgt etwa 2–3 Stunden. In geringeren Dosen (200–400 mg für Erwachsene) wirkt Ibuprofen schmerzlindernd und fiebersenkend, in höheren Dosen (bis 800 mg für Erwachsene) zusätzlich entzündungshemmend. Die Ausscheidung erfolgt zu etwa zwei Dritteln über die Niere und etwa einem Drittel über die Leber. Es werden größtenteils inaktive Metabolite ausgeschieden.[7]
Chemische Eigenschaften
Stereochemie
Ibuprofen liegt als Racemat des pharmakologisch wirksamen Enantiomers (S)-(+)-Ibuprofen (Dexibuprofen)[8] und des unwirksamen (R)-(−)-Ibuprofen vor, wobei aber letzteres im Körper durch eine Isomerase (2-Arylpropionyl-CoA-epimerase) in (S)-(+)-Ibuprofen umgewandelt wird.[9]
-
(R)-(−)-Ibuprofen
-
(S)-(+)-Ibuprofen
Anwendungsgebiete
Die Anwendungsgebiete sind:
- allgemein
- rheumatoide Arthritis, juvenile Arthritis, Osteoarthritis
- Schmerzen der Muskeln und des Bewegungsapparates
- akuter Gichtanfall
- Spannungskopfschmerzen, leichte Migräne
- akute Kopfschmerzen (auch bei Höhenkrankheit)
- Zahnschmerzen, Pulpitis, Gingivitis
- akute Angina (Mandelentzündung)
- akute Menstruationsbeschwerden
- akute Mittelohrentzündung
- Opiat-Entzug: Schmerzbekämpfung mit nicht opiathaltigen Arzneimitteln
- Frostbeulen, Erfrierung, Mittel der Wahl zur Schmerzstillung
- Sonnenbrand
- Fieber
- Alzheimer-Krankheit: Bisher bei Menschen nicht weiter erforscht wegen geringer Gewinnerwartung der Industrie (Pat McGeer)[10]
- speziell bei Kindern
- Behandlung eines hämodynamisch wirksamen offenen Ductus arteriosus Botalli bei Frühgeborenen vor der 34. Schwangerschaftswoche.
- Mukoviszidose: Eine Hochdosisbehandlung bessert die Symptome bei Kindern mit leichter Mukoviszidose deutlich. Mögliche erhebliche Nebenwirkungen verhindern jedoch einen breiten Einsatz.[11][12]
Nebenwirkungen
Gelegentlich können gastrointestinale Beschwerden wie Sodbrennen, Übelkeit oder Durchfall auftreten. Diese Nebenwirkungen können durch gleichzeitige Nahrungsaufnahme bei der Einnahme teilweise vermindert werden. Das Auftreten von Magen-Darm-Blutungen, Magengeschwüren oder Magenschleimhautentzündungen (Gastritis) hängt von der Dosis und der Anwendungsdauer ab. Bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) ist Vorsicht geboten, da Ibuprofen schubauslösend wirken kann.[13] Überempfindlichkeitsreaktionen wie Hautausschlag oder Hautjucken (Pruritus) sind möglich.
Der Einfluss von Ibuprofen auf die Blutgerinnung ist vergleichsweise gering, es hemmt die Thrombozytenfunktion und damit die Blutgerinnung (ähnlich wie Acetylsalicylsäure – wenn auch schwächer). Das kann nach Operationen ungünstig sein (beispielsweise nach einer Mandeloperation), da das Risiko von Nachblutungen steigt. In Fällen, bei denen Ibuprofen die Magenschleimhaut entzündlich verändert, kann die durch das Medikament bewirkte Gerinnungshemmung dazu führen, dass aus der Magenwand unkontrolliert über einen längeren Zeitraum Blut sickert.
Weiterhin ist bei Entzündungen oder Vorschädigung der Nieren und/oder der Leber (falls Aszites vorhanden) von der Einnahme von Ibuprofen abzuraten.
Wechselwirkungen mit anderen Arzneimitteln
- Antikoagulantien und Thrombolytika: Ibuprofen bewirkt eine reversible Thrombozytenaggregationshemmung. Die Thrombozyten sind wichtig für die Blutgerinnung (Wundverschluss). Antikoagulantien wirken ebenfalls negativ auf die Blutgerinnung. Thrombolytika lösen Blutgerinnsel auf (beispielsweise in einem verstopften Herzkranzgefäß). Wird Ibuprofen zusammen mit Medikamenten einer dieser Wirkstoffgruppen eingenommen, ist das Blutungsrisiko größer.
- Lithium: Ibuprofen steigert die Plasmakonzentration von Lithium, indem es seine Ausscheidung in der Niere verringert. Es kann dadurch zu einer Lithium-Vergiftung (Intoxikation) beitragen.
- Acetylsalicylsäure: Bei gleichzeitiger Einnahme von Ibuprofen kann die gerinnungshemmende Wirkung von Acetylsalicylsäure verringert werden.[14] Die Wirkung der Acetylsalicylsäure (ASS) auf die Funktion der Thrombozytenaggregation beruht auf der irreversiblen Hemmung eines Enzyms in den Thrombozyten, der Cyclooxygenase-1 (COX-1). Die COX-1 in den Thrombozyten bildet hauptsächlich Thromboxan-A2 (TXA2), das über den Thromboxan-Rezeptor auf der Thrombozytenoberfläche die Thrombozytenaggregation aktiviert. Acetylsalicylsäure acetyliert (unter Abgabe seines Acetyl-Rests) das Zentrum an einem Serin des COX-1-Enzyms unumkehrbar. Wird jedoch gleichzeitig oder zu zeitnah Ibuprofen eingenommen, so konkurrieren beide Moleküle um den Zugang zum Zentrum des COX-1-Enzyms, wobei das Ibuprofen die Oberhand behält. Da Acetylsalicylsäure jedoch rascher inaktiviert wird als Ibuprofen, ist nach Abfluten des Ibuprofen-Blutspiegels keine Acetylsalicylsäure mehr vorhanden. Die übrigbleibende Salicylsäure, ein Abbauprodukt der Acetylsalicylsäure, kann keine Acetylierung durchführen, sodass es in der Folge zu einem zunehmenden Verlust an Thrombozyten-Aggregationshemmung kommt.[15]
Arzneimittelmarkt
Ibuprofen wird in Form von Tabletten, Kapseln, Salben, Zäpfchen, Granulat zum Auflösen in Wasser und Kindersäften vertrieben. Tabletten bis 400 mg (für den Akutgebrauch), Salben, Gele, Zäpfchen und zum Teil Kindersäfte zur Behandlung von Fieber und Schmerzen unterliegen in Deutschland der Apothekenpflicht und können ohne Rezept erworben werden. Höher dosierte Zubereitungen (600 mg und 800 mg) und Präparate zur Behandlung von Entzündungen und rheumatischen Erkrankungen unterliegen der ärztlichen Verschreibungspflicht. In einigen Ländern (beispielsweise in den Vereinigten Staaten, Polen, Niederlanden, Norwegen oder im Vereinigten Königreich) ist für Ibuprofen der Selbstbedienungsverkauf teilweise mit Mengenbeschränkung im Supermarkt zulässig.
Einige Ibuprofenpräparate (beispielsweise Dolormin®, IBU-ratiopharm®Lysinat (D), ratioDolor®akut (A) ) enthalten Ibuprofen-Lysinat, ein Salz aus Ibuprofen und der Aminosäure Lysin. Im Magen ist dieses Salz besser löslich, so dass es schneller vom Körper resorbiert wird und dadurch zu einem schnelleren Wirkungseintritt führen soll.
Zur Behandlung eines persistierenden (d. h. in diesem Falle nach der Geburt weiterbestehenden) Ductus arteriosus ist Ibuprofen mit einer Sonderzulassung als Orphan-Arzneimittel als Injektionslösung unter dem Markennamen Pedea® verfügbar.
Aktren (D, A), Alges-X (CH), Anco (D), Brufen (A, CH), Dismenol (D, CH), Dolgit (D, A), Dolocyl (CH), Dolormin compact (D), Esprenit (D), Eudorlin Extra (D), Grefen (CH), Gyno-Neuralgin (D), Ibuflam (D), Ibumetin (A), Ibutop (D), Irfen (CH), Kontagripp (D), Migränin Ibuprofen (D), Movone (A), Neuralgin extra (D), Nurofen (D, A), Opturem (D), Pedea (D), Saridon (CH), Spedifen (A, CH), Spalt Flüssigkapseln (D), Spidifen (D), Tispol (D), Urem (D) und zahlreiche Generika (D, A, CH)
Tiermedizin
In Deutschland und der Schweiz sind derzeit keine Tierarzneimittel auf Ibuprofenbasis zugelassen. Die Anwendung von Ibuprofen bei lebensmittelliefernden Tieren ist nicht erlaubt, da es in keinem Anhang zur Verordnung (EWG) Nr. 2377/90 über Höchstmengen für Tierarzneimittelrückstände in Nahrungsmitteln aufgeführt ist. Eine Anwendung bei Pferden kann nur erfolgen, wenn sie im Equidenpass eingetragen wird und eine Wartezeit von sechs Monaten bis zu einer Schlachtung eingehalten wird. Gegenüber den für Hunde zugelassenen NSAID treten bei Gabe von Ibuprofen vermehrt gastrointestinale Nebenwirkungen auf.[16]
Literatur
- Murray & Nadel's Textbook of Respiratory Medicine, 4th ed., 2005, ISBN 0-7216-0327-0.
- Karow/Lang: Pharmakologie und Toxikologie. 17. Auflage. 2009, Thomas Karow Verlag, ISBN 978-1-00-002009-0.
Weblinks
Einzelnachweise
- ↑ Shankland, N.; Wilson, C.C.; Florence, A.J.; Cox, P.J.: Acta Crystallographica, Section C: Crystal Structure Communications, 1997, 53, S. 951–954; doi:10.1107/S0108270197003193.
- ↑ a b Romero, A.J.; Rhodes, T.C.: „Stereochemical Aspects of the Molecular Pharmaceutics of Ibuprofen“, in: J. Pharm. Pharmacol., 1993, 45, S. 258–262.
- ↑ Kanebo K.K.; JP 52100438; 1977.
- ↑ Ertel, K. D.; Heasley, R. A.; Koegel, C.; Chakrabarti, A.; Carstensen, J. T.: J. Pharm. Sci., 1990, 79, S. 552; doi:10.1002/jps.2600790620.
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ a b c d e Datenblatt Ibuprofen bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ Open Drug Database: http://ch.oddb.org/de/gcc/resolve/pointer/:!fachinfo,1880
- ↑ A. M. Evans: „Enantioselective pharmacodynamics and pharmacokinetics of chiral non-stereoidal antiinflammatory drugs“, in: European Journal of Clinical Pharmacology, 1992, 42, S. 237–256.
- ↑ Hermann J. Roth, Christa E. Müller und Gerd Folkers: Stereochemie & Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, ISBN 3-8047-1485-4, S. 175–176.
- ↑ Entzündungshemmer scheinen bei Alzheimer zu wirken , siehe dort: „mehr zum Thema“, „Rätsel Alzheimer“
- ↑ Jaffe A, Balfour-Lynn IM: „Treatment of severe small airways disease in children with cystic fibrosis: alternatives to corticosteroids“, in: Paediatr Drugs, 2002, 4 (6), S. 381–389; PMID 12038874.
- ↑ Chmiel JF, Konstan MW: „Anti-inflammatory medications for cystic fibrosis lung disease: selecting the most appropriate agent“, in: Treat Respir Med., 2005, 4 (4), S. 255–273; PMID 16086599.
- ↑ Bundesinstitut für Arzneimittel und Medizinprodukte: Mustertext für Fachinformation Ibuprofen (rheumatologische Indikationen). Abgerufen am 6. Juni 2010.
- ↑ Catella-Lawson F et al: Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med. 2001 Dec 20; 345(25): 1809–1817. PMID 11752357
- ↑ Pharmazeutische Zeitung: Vorsicht bei Ibuprofen mit Acetylsalicylsäure PZ Nr. 28, 2004.
- ↑ Julia Nakagawa et al.: „Nebenwirkungen durch nicht zugelassene nichtsteroidale Entzündungshemmer (NSAID) bei 21 Hunden“, in: Kleintierpraxis, 2010, 55, S. 364–370.