Idebenon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
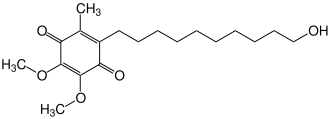
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Idebenon | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C19H30O5 | |||||||||||||||
| Kurzbeschreibung |
gelbes Pulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 338,439 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Idebenon ist ein antioxidativ wirksamer, synthetisch hergestellter Stoff, der strukturell und funktionell dem Ubichinon-10 ähnlich ist. Durch eine Hemmung der Lipidperoxidation vermag es Zellmembranen und Mitochondrien vor Beschädigung durch toxische Sauerstoffformen zu schützen.
Idebenon wird u. a. als Arzneistoff in der Behandlung der Leberschen Optikusatrophie (LHON) eingesetzt, für die es in der EU seit Oktober 2015 zugelassen ist. Idebenon zählt zu den Psychoanaleptika und Nootropika.
Pharmakologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Idebenon ist ein Antioxidans, das auf die Mitochondrien wirkt. LHON-Patienten weisen Mutationen in Genen auf, die Funktionen der Mitochondrien codieren. Es kommt zu Funktionsstörungen in der Energieproduktion, wobei toxische Formen von Sauerstoff (freie Radikale) entstehen, die die Netzhautzellen im Auge schädigen. Idebenon soll helfen, die Energieproduktion durch die Wiederherstellung der Funktion der Mitochondrien zu verbessern, und somit Zellschädigung und Visusverlust vorzubeugen.[3]
Idebenon ist peroral anwendbar. Die Bioverfügbarkeit ist bei gleichzeitiger Einnahme mit fetthaltiger Nahrung verbessert. Studien zur Pharmakodynamik und Pharmakokinetik sind in der Literatur beschrieben.[4][5]
Medizinische Verwendung[Bearbeiten | Quelltext bearbeiten]
Idebenon wurde ursprünglich von Takeda Pharmaceutical entwickelt zur Behandlung der Alzheimer-Krankheit, in der es sich jedoch als nicht ausreichend wirksam zeigte. In einigen europäischen Ländern wird es zur Behandlung von kognitiven Störungen verwendet.
Die Firma Santhera Pharmaceuticals entwickelt Idebenon in weiteren Anwendungsbereichen. Der Arzneistoff ist verschreibungspflichtig.
Lebersche Optikusatrophie[Bearbeiten | Quelltext bearbeiten]
Mit der Handelsbezeichnung: Raxone wurde Idebenon im September 2015 durch die Europäische Kommission zugelassen zur Behandlung von Sehstörungen bei Erwachsenen und Jugendlichen ab 12 Jahren mit Leberscher Optikusatrophie (LHON).[6][3][7] Es ist der erste für diese Indikation genehmigte Wirkstoff in allen 28 Mitgliedstaaten der Europäischen Union (EU), Norwegen, Island und Liechtenstein.[8]
LHON ist eine seltene mitochondriale Erbkrankheit mit einer Häufigkeit von ungefähr 2/100.000 in Europa.[9] Idebenon wurde bereits im Februar 2007 als Orphan Drug (Arzneimittel für seltene Leiden) ausgewiesen.[3] Hartmut Morck, Marburg, spricht in der Pharmazeutischen Zeitung (PZ) in seiner Bewertung von einer „Sprunginnovation“.[10]
In Deutschland wurde 2018 ein Studienprojekt in Form eines Registers für Patienten gestartet, um wichtige Einblicke in die Diagnostik, Prognose und Heilungschancen der seltenen Erkrankung LHON zu erhalten.[11]
Friedreich-Ataxie[Bearbeiten | Quelltext bearbeiten]
Die Friedreich-Ataxie (FA) ist eine fortschreitende degenerative Erkrankung des zentralen Nervensystems. Sie ist gekennzeichnet durch einen genetisch bedingten Mangel des Proteins Frataxin, das bei der Bildung der Mitochondrien eine Rolle spielt. Bei einem Frataxinmangel kommt es zur Bildung toxischer Sauerstoffradikale, die insbesondere Nerven- und Herzmuskelzellen schädigen. Als Mnesis war Idebenon in Schweiz von 2004 bis 2011 zur Therapie der manifesten nicht dilatativen Kardiomyopathie bei FA-Patienten zugelassen,[12] in Kanada von 2008 bis 2013 unter dem Namen Catena.[13] Einen europäischen Zulassungsantrag in dieser Indikation für das Medikament Sovrima wies die EMA 2008 ab.[14]
Potentielle Anwendungen[Bearbeiten | Quelltext bearbeiten]
Idebenon wird auch in anderen Indikationsbereichen untersucht, z. B. in der Duchenne-Muskeldystrophie (DMD),[15] verschiedene andere mitochondriale Erkrankungen, z. B. Kardiomyopathie,[16] Friedreich-Ataxie,[16] Kearns-Sayre-Syndrom,[17] Mitochondrial Encephalopathy Lactic Acidosis & Stroke-like Episodes (MELAS)[18][19] und/oder Thioredoxin-2 Defizienz[20] und der Ophthalmoplegia progressiva externa (CPEO).
Für die Indikation primär progrediente MS (PP-MS) wird in den USA eine Phase-II-Studie durchgeführt.[21]
Unerwünschte Wirkungen[Bearbeiten | Quelltext bearbeiten]
Häufige Nebenwirkungen sind kombinierte Nasen-Rachenentzündungen und Husten. Durchfall und Rückenschmerzen treten ebenfalls öfter auf.
Klinische Studien[Bearbeiten | Quelltext bearbeiten]
- Lebersche Optikusatrophie (LHON)
- Idebenon wurde in der Zulassungsstudie RHODOS, an der 85 Patienten teilnahmen, untersucht, in der es 24 Wochen lang mit Placebo verglichen wurde. Das Hauptaugenmerk für eine Wirksamkeit lag auf einer Visusverbesserung. Hauptsächlich wurden Tests mit Standard-Optotypen durchgeführt, die die Patienten im Rahmen eines Sehtests auf einer Sehprobentafel lesen sollten. Bis zum Ende der Studie konnten die mit Idebenon behandelten Patienten, verglichen mit den Patienten, die Placebos erhielten, im Durchschnitt 3 bis 6 Sehzeichen mehr erkennen. Des Weiteren konnten einige hochgradig geschädigte Patienten nach der Behandlung im Rahmen des Sehtests zumindest eine Zeile lesen, was ebenfalls als klinisch relevant erachtet wurde. 30 % der mit dem Arzneistoff behandelten Patienten (16 von 53) erzielten eine klinisch relevante Verbesserung der Sehkraft auf mindestens einem Auge, verglichen mit 10 % der Patienten (3 von 29) in der Placebogruppe.[3][22] Gestützt werden die Ergebnisse durch die Studie RHODOS-OFU.[23]
- Im Rahmen bisheriger Studien erzielte Raxone bei mindestens 1 von 2 Patienten mit guter Restsehkraft auf mindestens einem Auge eine Stabilisierung der Sehschärfe (Clinically Relevant Stabilization, CRS).[24] Ebenso bewirkte das Arzneimittel bei 1 von 3 Patienten, der bis zu 5 Jahre nach Symptombeginn behandelt wurde, eine klinische relevante Erholung des Sehvermögens (Clinically Relevant Recovery, CRR). Eine CRR war dabei definiert als eine Verbesserung vom off-Chart Bereich (ETDRS-Skala) auf mindestens 5 Buchstaben on-chart (entspricht 1 Zeile) oder eine Verbesserung von mindestens 10 Buchstaben on-chart (entspricht 2 Zeilen).[25]
- Duchenne-Muskeldystrophie (DMD)
Die Studie DELOS untersuchte die Wirksamkeit zur Stabilisierung der Lungenfunktion bei Patienten mit Duchenne-Muskeldystrophie an 17 Zentren in Europa und den USA. Die eingeschlossenen 64 Patienten mit genetisch gesicherter DMD waren zwischen 10 und 18 Jahre alt.[26]
Frühe Nutzenbewertung (AMNOG)[Bearbeiten | Quelltext bearbeiten]
Seit 2011 müssen sich neu zugelassene Medikamente mit neuen Wirkstoffen in Deutschland aufgrund § 35a SGB V (AMNOG) einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterziehen. Dies gilt auch für Idebenon.
Der G-BA hat Raxone im Rahmen des AMNOG-Verfahrens bewertet und das Ausmaß des Zusatznutzens bei LHON-Patienten als „nicht quantifizierbar“ eingeschätzt. Die stark limitierte Evidenzlage zur LHON ist der Seltenheit der Erkrankung geschuldet. Mit einer Prävalenz der LHON zwischen 2,06 und 4,30 pro 100.000 Personen tritt diese Erkrankung in Deutschland äußerst selten auf und erfordert für klinische Studien einen hohen Aufwand zur Rekrutierung von Patienten. Die Europäische Arzneimittel-Agentur (EMA) hat unter Anerkennung der Studien-Situation eine Zulassung unter „außergewöhnlichen Umständen“ erteilt. Das bedeutet, dass es aufgrund der Seltenheit der Erkrankung nicht möglich war, vollständige Informationen zu diesem Arzneimittel zu erhalten. Im Rahmen des Risikomanagement wird die EMA alle neuen Informationen, die verfügbar werden, jährlich bewerten, und falls erforderlich, die Packungsbeilage aktualisieren.[27][28]
Raxone hat inzwischen wie alle neu eingeführten Arzneimittel in Deutschland das AMNOG-Verfahren durchlaufen. Im Rahmen dieses Verfahrens haben der GKV-Spitzenverband und Santhera einem einheitlichen Erstattungsbetrag für Raxone zugestimmt. Im Rahmen der Verhandlungen mit dem GKV-Spitzenverband zum Erstattungsbetrag wurde für die Verordnung von Raxone auch eine Praxisbesonderheit vereinbart.
Fertigarzneimittel[Bearbeiten | Quelltext bearbeiten]
Raxone (EU), Mnesis (IT), Amizal (PT)
Weitere Verwendungen[Bearbeiten | Quelltext bearbeiten]
In den USA wird Idebenon als Nahrungsergänzungsmittel (dietary supplement) vermarktet. Idebenon ist ein synthetischer Stoff, der nicht in der Nahrung vorkommt. 2003 vertrat die FDA die Auffassung, dass Idebenon nicht der Definition eines dietary supplement oder dietary ingredient entspreche.[29] Auch im europäischen Ausland wurde Idebenon als Nahrungsergänzungsmittel vertrieben.
In kosmetischen Produkten kommt die Substanz zur Vorbeugung gegen Hautalterung zum Einsatz.[30]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Beate Leo-Kottler, Bernd Wissinger: Lebersche Optikusneuropathie. In: Ophthalmologe. Band 108, Nr. 12, 2011, S. 1179–1194, doi:10.1007/s00347-011-2482-y, PMID 22130685.
- Piero Barboni et al.: Idebenone treatment in patients with OPA1-mutant dominant optic atrophy. In: Brain. Band 136, Nr. 2, 2013, S. e231–e231, doi:10.1093/brain/aws280, PMID 23388408.
- Chiara La Morgia et al.: Medical Management of Hereditary Optic Neuropathies. In: Frontiers in Neurology. Band 5, 2014, doi:10.3389/fneur.2014.00141, PMID 25132831, PMC 4117178 (freier Volltext).
- Eliška Holzerová et al.: Human thioredoxin 2 deficiency impairs mitochondrial redox homeostasis and causes early-onset neurodegeneration. In: Brain. Band 139, Nr. 2, 2015, S. 346–354, doi:10.1093/brain/awv350, PMID 26626369.
- Werner J.H. Koopman et al.: Mitochondrial disorders in children: toward development of small‐molecule treatment strategies. In: EMBO Molecular Medicine. Band 8, Nr. 4, 2016, S. 311–327, doi:10.15252/emmm.201506131, PMID 26951622, PMC 4818752 (freier Volltext).
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu HYDROXYDECYL UBIQUINONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. August 2020.
- ↑ a b c d e Datenblatt Idebenone, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 21. November 2015 (PDF).
- ↑ a b c d Zusammenfassung des EPAR für die Öffentlichkeit. (PDF) EMA (deutsch); abgerufen am 18. November 2015.
- ↑ Roman H. Haefeli et al.: NQO1-Dependent Redox Cycling of Idebenone: Effects on Cellular Redox Potential and Energy Levels. In: PLOS ONE. Band 6, Nr. 3, 2011, S. e17963–e17963, doi:10.1371/journal.pone.0017963, PMID 21483849, PMC 3069029 (freier Volltext).
- ↑ Michael Erb et al.: Features of Idebenone and Related Short-Chain Quinones that Rescue ATP Levels under Conditions of Impaired Mitochondrial Complex I. In: PLOS ONE. Band 7, Nr. 4, 2012, S. e36153–e36153, doi:10.1371/journal.pone.0036153, PMID 22558363, PMC 3338594 (freier Volltext).
- ↑ Summary of the European public assessment report (EPAR) for Raxone. EMA.europa.eu (englisch); abgerufen am 18. November 2015.
- ↑ Santhera bringt Raxone® im ersten EU-Land auf den Markt. Santhera, Pressemitteilung, 1. Oktober 2015; abgerufen am 18. November 2015.
- ↑ Santhera erhält europäische Marktzulassung für Raxone® bei Leber Hereditärer Optikusneuropathie (LHON). PM Santhera, Pressemitteilung, 9. September 2015; abgerufen am 18. November 2015.
- ↑ B. Mascialino, Mika Leinonen, Thomas Meier: Meta-analysis of the prevalence of Leber hereditary optic neuropathy mtDNA mutations in Europe. In: European Journal of Ophthalmology. Band 22, Nr. 3, 2011, S. 461–465, doi:10.5301/ejo.5000055, PMID 21928272.
- ↑ Eine Handvoll neuer Wirkstoffe. In: Pharmazeutische Zeitung, 45/2015; abgerufen am 3. Februar 2016.
- ↑ Lebersche Hereditäre Optikus-Neuropathie – Pro Retina initiiert erstes deutsches Patientenregister. ( vom 5. September 2018 im Internet Archive) Pro Retina Deutschland e. V., Pressemitteilung, 5. September 2018; abgerufen am 5. September 2018.
- ↑ Mnesis® (Idebenon) – keine Verlängerung der befristeten Zulassung; abgerufen am 4. August 2020.
- ↑ Idebenone - Voluntary withdrawal from the Canadian market (PDF; 400 kB) WHO Pharmaceuticals Newsletter No. 2 2013.
- ↑ Sovrima auf der Website der europäischen Arzneimittelagentur; abgerufen am 4. August 2020.
- ↑ Idebenon. ( vom 27. Juni 2018 im Internet Archive) DMD, Website des Herstellers, abgerufen am 27. Juni 2018.
- ↑ a b Leitlinien Mitochondriale Erkrankungen. Website der DGN; abgerufen am 27. Juni 2018.
- ↑ Kearns-Sayre-Syndrom, auf Symptomat.de, abgerufen am 27. Juni 2018.
- ↑ Study of Idebenone in the Treatment of Mitochondrial Encephalopathy Lactic Acidosis & Stroke-like Episodes (MELAS), ClinicalTrials.gov, abgerufen am 27. Juni 2018.
- ↑ Werner J.H. Koopman et al.: Mitochondrial disorders in children: toward development of small‐molecule treatment strategies. In: EMBO Molecular Medicine. Band 8, Nr. 4, 2016, S. 311–327, doi:10.15252/emmm.201506131, PMID 26951622, PMC 4818752 (freier Volltext).
- ↑ Eliška Holzerová et al.: Human thioredoxin 2 deficiency impairs mitochondrial redox homeostasis and causes early-onset neurodegeneration. In: Brain. Band 139, Nr. 2, 2015, S. 346–354, doi:10.1093/brain/awv350, PMID 26626369.
- ↑ Primary Progressive Multiple Sclerosis auf der Website des Herstellers, abgerufen am 18. November 2015.
- ↑ Thomas Klopstock et al.: A randomized placebo-controlled trial of idebenone in Leber’s hereditary optic neuropathy. In: Brain. Band 134, Nr. 9, September 2011, S. 2677–2686, doi:10.1093/brain/awr170.
- ↑ Thomas Klopstock et al.: Persistence of the treatment effect of idebenone in Leber’s hereditary optic neuropathy. In: Brain. Band 136, Nr. 2, Februar 2013, S. e230–e230, doi:10.1093/brain/aws279.
- ↑ T Klopstock et al. In: Brain, 134, S. 2677–2686, 2011. G Metz et al.: „EUNOS“, Ljubljana 2015.
- ↑ Hasham et al.: ARVO. Seattle 2016.
- ↑ Gunnar M Buyse et al.: Efficacy of idebenone on respiratory function in patients with Duchenne muscular dystrophy not using glucocorticoids (DELOS): a double-blind randomised placebo-controlled phase 3 trial. In: The Lancet. Band 385, Nr. 9979, Mai 2015, S. 1748–1757, doi:10.1016/S0140-6736(15)60025-3.
- ↑ Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Idebenon (PDF; 785 kB) Beschluss des G-BA vom 17. März 2016, abgerufen am 7. September 2017.
- ↑ Summary of the risk management plan (RMP) for Raxone (idebenone). (PDF; 304 kB) Risikomanagementplan der EMA (englisch).
- ↑ FDA Memorandum, 2. März 2003 (PDF)
- ↑ D. H. McDaniel et al.: Clinical efficacy assessment in photodamaged skin of 0.5% and 1.0% idebenone. In: Journal of Cosmetic Dermatology. Band 4, Nr. 3, 2005, S. 167–173, doi:10.1111/j.1473-2165.2005.00305.x, PMID 17129261.