Protocatechusäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Protocatechusäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H6O4 | |||||||||||||||||||||
| Kurzbeschreibung |
hellbrauner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 154,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
4,48 (COOH; 25 °C)[3] | |||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (20 g·l−1 bei 20 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Protocatechusäure (3,4-Dihydroxybenzoesäure) ist eine aromatische Verbindung, die sich sowohl von der Benzoesäure als auch vom Brenzcatechin (1,2-Dihydroxybenzol) ableitet. Die Struktur besteht aus einem Benzolring mit einer angefügten Carboxygruppe (–COOH) und zwei Hydroxygruppen (–OH) als Substituenten. Sie gehört zur Gruppe der Dihydroxybenzoesäuren, ist in freier Form in den Früchten des Japanischen Sternanis' (Illicium religiosum) enthalten und entsteht bei der Alkalischmelze zahlreicher Naturstoffe, z. B. aus Catechinen, aus verschiedenen Harzen, dem Farbstoff Maklurin und mehreren Anthocyanen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Protocatechusäure kommt in essbarem Gemüse, Obst und Nüssen vor, beispielsweise in Oliven,[5][6] Naturreis[5] und Pekannüssen[5][6]. Sie kommt auch in der Borstigen Taigawurzel,[6] Ginkgo,[6] Aprikosen,[6] Mönchspfeffer,[6] den Blättern des Gewürznelkenbaum,[6] und Brennnesseln[7] vor.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Chemische Synthese
[Bearbeiten | Quelltext bearbeiten]Synthetisch stellt man Protocatechusäure aus p-Hydroxybenzoesäure dar; man führt diese in m-Chlor-p-hydroxybenzoesäure über und erhitzt letztere mit Ätzkali unter Druck.

Die Carboxylierung mit einer Kolbe-Schmitt-Reaktion durch Erhitzen von Brenzcatechin mit Ammoniumcarbonat im geschlossenen Rohr liefert nur schlechte Ausbeuten, in wässriger Lösung findet keine Reaktion statt.[8]
Eine weitere Synthese geht vom Vanillin aus und führt über die Demethylierung der Vanillinsäure bzw. ihres Kaliumsalzes zur Protocatechusäure:[9]

Beim Erhitzen von Piperonylsäure mit Salzsäure oder Iodwasserstoffsäure entsteht ebenfalls Protocatechusäure.[10][11] Als Nebenprodukt werden äquimolare Mengen Formaldehyd abgespalten.

Biosynthese
[Bearbeiten | Quelltext bearbeiten]Protocatechualdehyd kann enzymatisch zur Protocatechusäure oxidiert werden.[12]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Protocatechusäure und schmilzt bei etwa 202–204 °C[2] und zersetzt sich dabei durch Decarboxylierung zu Brenzcatechin und Kohlenstoffdioxid. Ihre wässrige Lösung wird nach Zusatz von Eisenchlorid blaugrün. Diese Farbe schlägt nach Zugabe von wenig Soda oder Ammoniak erst nach violett, dann nach rot um. Protocatechusäure wirkt stark reduzierend.
Reaktionen
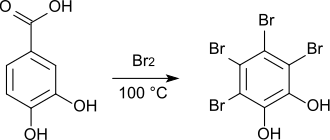
[Bearbeiten | Quelltext bearbeiten]Mit elementarem Brom bildet sich bei Raumtemperatur 5-Bromprotocatechusäure[13], die beim Schmelzen mit Kaliumcarbonat zur Gallussäure umgewandelt wird.[14]

Wird die Bromierung bei 100 °C durchgeführt, entsteht unter Abspaltung von Kohlendioxid Tetrabrombrenzcatechin.[13]
Analytik
[Bearbeiten | Quelltext bearbeiten]Zur qualitativen und quantitativen Bestimmung kann nach adäquater Probenvorbereitung die Kopplung der UPLC mit der Massenspektrometrie und auch die HPTLC eingesetzt werden.[15][16][17]
Physiologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Die Wirkung von Protocatechusäure auf lebende Zellen ist momentan Gegenstand der Forschung und wird noch kontrovers diskutiert. So wurde gezeigt, dass es ein potentes Antioxidationsmittel mit einer etwa 10-mal stärkeren Wirkung als α-Tocopherol ist.[18] In hohen Dosen jedoch, bei beispielsweise 10 mM, kann es aber auch oxidativen Stress in Zellkulturen induzieren.[19]
Gegenüber Krebszellen zeigt Protocatechusäure verschiedene Effekte. In menschlichen Magenkrebszellen (Zellen eines Magenadenokarzinoms) und andere Tumorzellen des Verdauungstraktes induziert es die Apoptose und wirkt daher im Sinne eines Krebsmittels.[5] Es liegen aber auch Studiendaten vor, die auf einen gegenteiligen Effekt von Protocatechusäure hinweisen. So induziert es die Zellteilung in neuralen Stammzellen und blockiert dort die Apoptose.[20] Auch in Hautkrebszellen der Maus wurde dies beobachtet. Wenn dort chemisch durch 12-O-Tetradecanoylphorbol-13-acetat Krebszellen induziert wurden, konnte Protocatechusäure die Tumorbildung sogar noch verstärken.[18] Wenn man in vitro maligne Zelllinien der menschlichen Unterkieferspeicheldrüse erzeugt, konnte Protocatechusäure diese Krebszellen nicht abtöten.[19]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Paul Karrer: Lehrbuch der organischen Chemie. 10. Auflage. Georg Thieme, Stuttgart 1948, S. 569.
- Deutsche Chemische Gesellschaft: Beilsteins Handbuch der Organischen Chemie. Bd. 10, 4. Auflage, Springer, 1927: (Syst.Nr. 1105) H 389, EI 187, EII 260
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- Untersuchung der antiviralen Aktivität (PDF-Datei; 527 kB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu 3,4-DIHYDROXYBENZOIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. Mai 2020.
- ↑ a b c d Datenblatt Protocatechusäure bei Merck, abgerufen am 3. Juni 2007.
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker. 3. Auflage. Band 1, Springer, Berlin/Göttingen/Heidelberg 1967, ISBN 978-3-540-03756-9. (ChemieOnline – pKb- und pKs-Werte ( vom 19. Juli 2012 im Internet Archive)).
- ↑ a b Datenblatt 3,4-Dihydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ a b c d H. H. Lin, J. H. Chen, C. C. Huang, C. J. Wang: Apoptotic effect of 3,4-dihydroxybenzoic acid on human gastric carcinoma cells involving JNK/p38 MAPK signaling activation. In: Int J Cancer. Band 120, Nr. 11, Juni 2007, S. 2306–2316, doi:10.1002/ijc.22571, PMID 17304508.
- ↑ a b c d e f g 3,4-DIHYDROXYBENZOIC-ACID (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 24. August 2024.
- ↑ Quantitative determination of plant phenolics in Urtica dioica extracts by high-performance liquid chromatography coupled with tandem mass spectrometric detection. In: Food Chemistry. Band 143, 15. Januar 2014, S. 48–53, doi:10.1016/j.foodchem.2013.07.097.
- ↑ S. v. Kostanecki: Zur Einführung der Carboxylgruppe in die Phenole. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 3202–3206 (Digitalisat auf Gallica).
- ↑ Irwin A. Pearl: Protocatechuic acid In: Organic Syntheses. 29, 1949, S. 85, doi:10.15227/orgsyn.029.0085; Coll. Vol. 3, 1955, S. 745 (PDF).
- ↑ A. H. Parijs: The opening of the dihydroxymethylene ring. In: Recueil des Travaux Chimiques des Pays-Bas. 49, Nr. 1, 1930, S. 33–44, doi:10.1002/recl.19300490104
- ↑ R. Fittig, I. Remsen: Untersuchungen über die Constitution des Piperins und seiner Spaltungsproducte Piperinsäure und Piperidin. In: Justus Liebigs Annalen der Chemie. Band 168, Nr. 1, 1873, S. 93–98, doi:10.1002/jlac.18731680110
- ↑ Georgios I. Panoutsopoulos, Christine Beedham: Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices. In: Cell Physiol Biochem. Band 15, Nr. 1–4, 2005, S. 89–98. PMID 15665519; (PDF)
- ↑ a b J. Stenhouse: Action of Bromine on Protocatechuic Acid, Gallic Acid and Tannion. In: The chemical news. Band 29, 1874, S. 95 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Textbook of Chemistry (Volltext)
- ↑ F. Ma, X. Gong, X. Zhou, Y. Zhao, M. Li: An UHPLC-MS/MS method for simultaneous quantification of gallic acid and protocatechuic acid in rat plasma after oral administration of Polygonum capitatum extract and its application to pharmacokinetics. In: J Ethnopharmacol. Band 162, 13. Mar 2015, S. 377–383. PMID 25557034.
- ↑ Y. Tao, X. Xu, J. Yan, B. Cai: A sensitive UPLC-MS/MS method for simultaneous determination of polyphenols in rat plasma: Application to a pharmacokinetic study of dispensing granules and standard decoction of Cinnamomum cassia twigs. In: Biomed Chromatogr. Band 33, Nr. 7, Jul 2019, S. e4534. PMID 30874318.
- ↑ A. Balkrishna, M. Tomer, M. Joshi, S. Gujral, R. Kumar Mishra, J. Srivastava, A. Varshney: Standardization and validation of phytometabolites by UHPLC and high-performance thin layer chromatography for rapid quality assessment of ancient ayurvedic medicine. In: Mahayograj Guggul. J Sep Sci. Band 45, Nr. 10, Mai 2022, S. 1616–1635. PMID 35152549.
- ↑ a b Y. Nakamura et al.: A simple phenolic antioxidant protocatechuic acid enhances tumor promotion and oxidative stress in female ICR mouse skin: dose-and timing-dependent enhancement and involvement of bioactivation by tyrosinase. In: Carcinogenesis. Band 21, Nr. 10, Oktober 2000, S. 1899–1907, doi:10.1093/carcin/21.10.1899, PMID 11023549.
- ↑ a b H. Babich, A. Sedletcaia, B. Kenigsberg: In vitro cytotoxicity of protocatechuic acid to cultured human cells from oral tissue: involvement in oxidative stress. In: Pharmacol Toxicol. Band 91, Nr. 5, November 2002, S. 245–253, doi:10.1034/j.1600-0773.2002.910505.x, PMID 12570031.
- ↑ S. Guan et al.: Protocatechuic acid promotes cell proliferation and reduces basal apoptosis in cultured neural stem cells. In: Toxicology in Vitro. Band 23, Nr. 2, März 2009, S. 201–208, doi:10.1016/j.tiv.2008.11.008, PMID 19095056.
