„Malignes Melanom“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K →Diagnose: neue Rechtschreibung |
ref formatiert, -doppelte PMID-Links |
||
| Zeile 8: | Zeile 8: | ||
Das '''maligne Melanom''' (von [[Altgriechische Sprache|gr.]] μέλας „schwarz“), auch kurz '''Melanom''', '''Melano(zyto)blastom''' oder '''schwarzer Hautkrebs''' ([[Englische Sprache|engl]].: ''[malignant] melanoma'') genannt, ist ein hochgradig [[Malignität|bösartiger]] [[Tumor]] der [[Melanozyt|Pigmentzellen]] (Melanozyten). Er neigt dazu, früh [[Metastase]]n über [[Lymphatisches System|Lymph-]] und [[Blutgefäß|Blutbahnen]] zu streuen, und ist die am häufigsten tödlich verlaufende [[Hautkrankheit]] mit weltweit stark steigender [[Inzidenz (Medizin)|Anzahl an Neuerkrankungen]]. |
Das '''maligne Melanom''' (von [[Altgriechische Sprache|gr.]] μέλας „schwarz“), auch kurz '''Melanom''', '''Melano(zyto)blastom''' oder '''schwarzer Hautkrebs''' ([[Englische Sprache|engl]].: ''[malignant] melanoma'') genannt, ist ein hochgradig [[Malignität|bösartiger]] [[Tumor]] der [[Melanozyt|Pigmentzellen]] (Melanozyten). Er neigt dazu, früh [[Metastase]]n über [[Lymphatisches System|Lymph-]] und [[Blutgefäß|Blutbahnen]] zu streuen, und ist die am häufigsten tödlich verlaufende [[Hautkrankheit]] mit weltweit stark steigender [[Inzidenz (Medizin)|Anzahl an Neuerkrankungen]]. |
||
Neben dem hier behandelten malignen Melanom der [[Haut]] (kutanes Melanom) gibt es auch maligne Melanome der [[Schleimhaut|Schleimhäute]], des [[Auge]]s (Bindehautmelanom, [[Aderhautmelanom]]), des [[Zentralnervensystem]]s, der [[Inneres Organ|inneren Organe]] und des [[Anus]] ([[anorektales Melanom]]). Diese Gruppe der malignen Melanome wird als [[Mukosales Melanom|mukosale Melanome]] (von Mucosa = Schleimhaut) bezeichnet.<ref>{{Literatur|Autor=B. M. Helmke, H. F. Otto|Titel=Das anorektale Melanom|TitelErg=(Anorectal melanoma. A rare and highly malignant tumor entity of the anal canal)|Sammelwerk=Der Pathologe|Band=25|Nummer=3|Verlag=|Jahr=2004|Monat=05|Seiten=171–177 |
Neben dem hier behandelten malignen Melanom der [[Haut]] (kutanes Melanom) gibt es auch maligne Melanome der [[Schleimhaut|Schleimhäute]], des [[Auge]]s (Bindehautmelanom, [[Aderhautmelanom]]), des [[Zentralnervensystem]]s, der [[Inneres Organ|inneren Organe]] und des [[Anus]] ([[anorektales Melanom]]). Diese Gruppe der malignen Melanome wird als [[Mukosales Melanom|mukosale Melanome]] (von Mucosa = Schleimhaut) bezeichnet.<ref>{{Literatur|Autor=B. M. Helmke, H. F. Otto|Titel=Das anorektale Melanom|TitelErg=(Anorectal melanoma. A rare and highly malignant tumor entity of the anal canal)|Sammelwerk=Der Pathologe|Band=25|Nummer=3|Verlag=|Jahr=2004|Monat=05|Seiten=171–177|DOI=10.1007/s00292-003-0640-y|PMID=15138698|Kommentar=Review}}</ref> Im Vergleich zum kutanen Melanom sind die mukosalen Melanome wesentlich seltener. |
||
== Häufigkeit == |
== Häufigkeit == |
||
| Zeile 20: | Zeile 20: | ||
Als Todesursache hat das maligne Melanom für beide Geschlechter einen Anteil von 1,3 Prozent an allen Krebstodesursachen in Deutschland.<ref>[http://www.dkfz.de/de/krebsatlas/gesamt/organ.html ''Die 20 häufigsten Krebstodesursachen in Deutschland im Jahr 2007''.] In: ''Krebsatlas'', Deutsches Krebsforschungszentrum, 6. Mai 2009, abgerufen am 27. März 2010.</ref> Aufklärungsprogramme hielten – trotz deutlicher Zunahme der Erkrankungszahlen – die Sterberate bisher weitgehend konstant.<ref name="MfM">Medikamente für Menschen: [http://www.medicinesformankind.eu/upload/pdf/D_melano.pdf ''Melanom.''] (PDF; 143 kB) Europäischer Verband der Pharmazeutischen Industrien und Verbände (Herausgeber)</ref> |
Als Todesursache hat das maligne Melanom für beide Geschlechter einen Anteil von 1,3 Prozent an allen Krebstodesursachen in Deutschland.<ref>[http://www.dkfz.de/de/krebsatlas/gesamt/organ.html ''Die 20 häufigsten Krebstodesursachen in Deutschland im Jahr 2007''.] In: ''Krebsatlas'', Deutsches Krebsforschungszentrum, 6. Mai 2009, abgerufen am 27. März 2010.</ref> Aufklärungsprogramme hielten – trotz deutlicher Zunahme der Erkrankungszahlen – die Sterberate bisher weitgehend konstant.<ref name="MfM">Medikamente für Menschen: [http://www.medicinesformankind.eu/upload/pdf/D_melano.pdf ''Melanom.''] (PDF; 143 kB) Europäischer Verband der Pharmazeutischen Industrien und Verbände (Herausgeber)</ref> |
||
Die Häufigkeit des malignen Melanoms der Haut ist regional sehr unterschiedlich. In einigen Staaten ist es eine ausgesprochen seltene Erkrankung, während bei der hellhäutigen Bevölkerung [[Australien]]s das Lebenszeitrisiko – im Vergleich zu Europäern – etwa vierfach erhöht ist und bei ungefähr vier Prozent liegt. In Nordamerika in der Altersgruppe von 25 bis 34 Jahren ist das Melanom bei Männern die vierthäufigste und bei Frauen die zweithäufigste Krebsart.<ref name="Roetzer">S. Rötzer: ''Lebensqualität bei Melanom- Patienten unter adjuvanter Interferon-alpha 2a-Therapie.'' Dissertation, Charité Berlin, 2008.</ref><ref>{{Literatur|Autor=Renee A. Desmond, Seng-jaw Soong|Titel=Epidemiology of malignant melanoma|Sammelwerk=The Surgical Clinics of North America|Band=83|Nummer=1|Verlag=|Jahr=2003|Monat=02|Seiten=1–29 |
Die Häufigkeit des malignen Melanoms der Haut ist regional sehr unterschiedlich. In einigen Staaten ist es eine ausgesprochen seltene Erkrankung, während bei der hellhäutigen Bevölkerung [[Australien]]s das Lebenszeitrisiko – im Vergleich zu Europäern – etwa vierfach erhöht ist und bei ungefähr vier Prozent liegt. In Nordamerika in der Altersgruppe von 25 bis 34 Jahren ist das Melanom bei Männern die vierthäufigste und bei Frauen die zweithäufigste Krebsart.<ref name="Roetzer">S. Rötzer: ''Lebensqualität bei Melanom- Patienten unter adjuvanter Interferon-alpha 2a-Therapie.'' Dissertation, Charité Berlin, 2008.</ref><ref>{{Literatur|Autor=Renee A. Desmond, Seng-jaw Soong|Titel=Epidemiology of malignant melanoma|Sammelwerk=The Surgical Clinics of North America|Band=83|Nummer=1|Verlag=|Jahr=2003|Monat=02|Seiten=1–29|PMID=12691448}}</ref> Der weltweit höchste Wert wird in [[Auckland]] ([[Neuseeland]]) erreicht.<ref>[http://www.teara.govt.nz/en/natural-environment/3 ''Climate''.] In: ''Te Ara: The Encyclopedia of New Zealand''.</ref> [[Afroamerikaner]] haben ein um den Faktor 20 niedrigeres Risiko, am malignen Melanom der Haut zu erkranken, als Menschen mit heller Haut.<ref name="MfM" /> |
||
<gallery widths="300"> |
<gallery widths="300"> |
||
| Zeile 54: | Zeile 54: | ||
=== Einfluss von Sonnencreme === |
=== Einfluss von Sonnencreme === |
||
Die Schutzwirkung von [[Sonnencreme]]s wird sehr kontrovers diskutiert. Über die Verhinderung der Entstehung von Hautkrebs gibt es sehr widersprüchliche Studien. In einigen Studien wurden eher negative Auswirkungen bei der Anwendung von Sonnencremes festgestellt,<ref>{{Literatur|Autor=D. Hill|Titel=Efficacy of sunscreens in protection against skin cancer|Sammelwerk=Lancet|Band=354|Nummer=9180|Verlag=|Jahr=1999|Monat=08|Tag=28|Seiten=699–700 |
Die Schutzwirkung von [[Sonnencreme]]s wird sehr kontrovers diskutiert. Über die Verhinderung der Entstehung von Hautkrebs gibt es sehr widersprüchliche Studien. In einigen Studien wurden eher negative Auswirkungen bei der Anwendung von Sonnencremes festgestellt,<ref>{{Literatur|Autor=D. Hill|Titel=Efficacy of sunscreens in protection against skin cancer|Sammelwerk=Lancet|Band=354|Nummer=9180|Verlag=|Jahr=1999|Monat=08|Tag=28|Seiten=699–700|DOI=10.1016/S0140-6736(99)00192-0|PMID=10475178}} oder {{Literatur|Autor=Ken Landow|Titel=Do sunscreens prevent skin cancer?|Sammelwerk=Postgraduate Medicine|Band=116|Nummer=1|Verlag=|Jahr=2004|Monat=07|Seiten=6|PMID=15274282}}</ref> während in anderen Veröffentlichungen und Studien das Gegenteil behauptet wird.<ref>{{Literatur|Autor=Marianne Berwick|Titel=Counterpoint: sunscreen use is a safe and effective approach to skin cancer prevention|Sammelwerk=[[Cancer Epidemiology, Biomarkers & Prevention]]: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology|Band=16|Nummer=10|Verlag=|Jahr=2007|Monat=10|Seiten=1923–1924|DOI=10.1158/1055-9965.EPI-07-0391|PMID=17932338}} oder {{Literatur|Autor=Adèle C. Green, Gail M. Williams|Titel=Point: sunscreen use is a safe and effective approach to skin cancer prevention|Sammelwerk=Cancer Epidemiology, Biomarkers & Prevention|Band=16|Nummer=10|Verlag=|Jahr=2007|Monat=10|Seiten=1921–1922|DOI=10.1158/1055-9965.EPI-07-0477|PMID=17932337}}</ref> Im Tiermodell wurde zwar eine eindeutige Wirkung von Sonnencreme zur Verhinderung der Ausbildung eines [[Spinaliom]]s der Haut (ein [[Plattenepithelkarzinom]]) festgestellt, jedoch ist dies beim malignen Melanom und beim [[Basaliom]] nicht der Fall.<ref>{{Literatur|Autor=P. Wolf|Titel=Lichtschutzmittel|TitelErg=(Sunscreens. Protection against skin cancers and photoaging)|Sammelwerk=Der Hautarzt; Zeitschrift Für Dermatologie, Venerologie, Und Verwandte Gebiete|Band=54|Nummer=9|Verlag=|Jahr=2003|Monat=09|Seiten=839–844|DOI=10.1007/s00105-003-0590-6|PMID=12955261}}</ref> |
||
In einer 2003 erschienenen [[Metaanalyse|Metastudie]] wurde jedoch kein Zusammenhang zwischen der Verwendung von Sonnencreme und der Zunahme von Erkrankungen an malignen Melanomen beim Menschen festgestellt. Die Studie kommt zu dem Schluss, dass in früheren Studien offensichtlich Fehler bei der Berücksichtigung von [[Konfundierungseffekt]]en gemacht wurden und sie deshalb eine positive Korrelation zwischen der Benutzung von Sonnencreme und dem Auftreten von malignen Melanomen feststellten. Von Konfundierungseffekten spricht man, wenn das zu untersuchende Phänomen (hier die Zunahme an malignen Melanomen) von zwei oder mehr Bedingungen gleichzeitig beeinflusst wird. In den vorhergehenden Studien seien zudem neuere Sonnencremes mit einem Schutzfaktor größer als 15, einem Schutz gegen UV-A-Strahlung und Wasserfestigkeit überhaupt nicht berücksichtigt worden. Die Autoren gehen davon aus, dass es [[Jahrzehnt]]e dauern kann, um einen positiven Effekt zwischen dem Gebrauch von neueren Rezepturen von Sonnencremes und malignen Melanomen zu ermitteln.<ref>{{Literatur|Autor=Leslie K. Dennis, Laura E. Beane Freeman, Marta J. VanBeek|Titel=Sunscreen use and the risk for melanoma: a quantitative review|Sammelwerk=Annals of Internal Medicine|Band=139|Nummer=12|Verlag=|Jahr=2003|Monat=12|Tag=16|Seiten=966–978 |
In einer 2003 erschienenen [[Metaanalyse|Metastudie]] wurde jedoch kein Zusammenhang zwischen der Verwendung von Sonnencreme und der Zunahme von Erkrankungen an malignen Melanomen beim Menschen festgestellt. Die Studie kommt zu dem Schluss, dass in früheren Studien offensichtlich Fehler bei der Berücksichtigung von [[Konfundierungseffekt]]en gemacht wurden und sie deshalb eine positive Korrelation zwischen der Benutzung von Sonnencreme und dem Auftreten von malignen Melanomen feststellten. Von Konfundierungseffekten spricht man, wenn das zu untersuchende Phänomen (hier die Zunahme an malignen Melanomen) von zwei oder mehr Bedingungen gleichzeitig beeinflusst wird. In den vorhergehenden Studien seien zudem neuere Sonnencremes mit einem Schutzfaktor größer als 15, einem Schutz gegen UV-A-Strahlung und Wasserfestigkeit überhaupt nicht berücksichtigt worden. Die Autoren gehen davon aus, dass es [[Jahrzehnt]]e dauern kann, um einen positiven Effekt zwischen dem Gebrauch von neueren Rezepturen von Sonnencremes und malignen Melanomen zu ermitteln.<ref>{{Literatur|Autor=Leslie K. Dennis, Laura E. Beane Freeman, Marta J. VanBeek|Titel=Sunscreen use and the risk for melanoma: a quantitative review|Sammelwerk=Annals of Internal Medicine|Band=139|Nummer=12|Verlag=|Jahr=2003|Monat=12|Tag=16|Seiten=966–978|Online=[http://annals.org/article.aspx?articleid=716987 online, PDF]|PMID=14678916}}</ref> |
||
Eine 2014 in ''[[Nature]]'' veröffentlichte Studie deutet darauf hin, dass Sonnencreme keinen ausreichenden Schutz vor malignen Melanomen bietet. In der Studie wurde der rasierte Rücken von Mäusen, in denen künstlich eine bestimmte [[Raf (Protein)#BRAF-Protein und Hautkrebs|Mutation im Wachstumsgen ''BRAF'']] herbeigeführt wurde, wiederholt einer Dosis an ultravioletter Strahlung ausgesetzt, welche beim Menschen einem leichten Sonnenbrand entspräche. Gänzlich ungeschützte Hautbereiche entwickelten so innerhalb von sieben Monaten Melanome, mit Sonnenschutzfaktor 50 behandelte Hautstellen blieben bis zu 17 Monate ohne Melanome, und mit einem Tuch abgedeckte Stellen blieben zu circa 20 Prozent noch mindestens zwei Jahre melanomfrei.<ref>''Nature'', zitiert nach: {{Internetquelle|url=http://www.mz-web.de/gesundheit/wie-uv-strahlung-schwarzen-hautkrebs-foerdert,20643030,27465296,view,asTicker.html|titel=Wie UV-Strahlung schwarzen Hautkrebs fördert|werk=Mitteldeutsche Zeitung|datum=2014-06-14|zugriff=2014-06-12}}</ref> |
Eine 2014 in ''[[Nature]]'' veröffentlichte Studie deutet darauf hin, dass Sonnencreme keinen ausreichenden Schutz vor malignen Melanomen bietet. In der Studie wurde der rasierte Rücken von Mäusen, in denen künstlich eine bestimmte [[Raf (Protein)#BRAF-Protein und Hautkrebs|Mutation im Wachstumsgen ''BRAF'']] herbeigeführt wurde, wiederholt einer Dosis an ultravioletter Strahlung ausgesetzt, welche beim Menschen einem leichten Sonnenbrand entspräche. Gänzlich ungeschützte Hautbereiche entwickelten so innerhalb von sieben Monaten Melanome, mit Sonnenschutzfaktor 50 behandelte Hautstellen blieben bis zu 17 Monate ohne Melanome, und mit einem Tuch abgedeckte Stellen blieben zu circa 20 Prozent noch mindestens zwei Jahre melanomfrei.<ref>''Nature'', zitiert nach: {{Internetquelle|url=http://www.mz-web.de/gesundheit/wie-uv-strahlung-schwarzen-hautkrebs-foerdert,20643030,27465296,view,asTicker.html|titel=Wie UV-Strahlung schwarzen Hautkrebs fördert|werk=Mitteldeutsche Zeitung|datum=2014-06-14|zugriff=2014-06-12}}</ref> |
||
| Zeile 87: | Zeile 87: | ||
Ein Arzt mit entsprechender Erfahrung kann meist durch Sichtung der verdächtigen Hautpartie feststellen, ob es sich um ein malignes Melanom handelt oder nicht. Im Zweifelsfall wird das verdächtige Hautareal im Ganzen ([[in toto]]) mit einem entsprechenden Sicherheitsabstand entnommen und unter dem Mikroskop untersucht. Kleinere Gewebeproben sollte man nicht entnehmen, da zur feingeweblichen Diagnosestellung bzw. zur Tumordickenbestimmung die gesamte Läsion beurteilt werden sollte. Daneben wird kontrovers diskutiert, ob durch die Entnahme von nur einem kleinen Anteil des Tumors die Gefahr einer Streuung ([[Metastasierung]]) über die Blutbahn oder die Lymphe zu groß wäre. |
Ein Arzt mit entsprechender Erfahrung kann meist durch Sichtung der verdächtigen Hautpartie feststellen, ob es sich um ein malignes Melanom handelt oder nicht. Im Zweifelsfall wird das verdächtige Hautareal im Ganzen ([[in toto]]) mit einem entsprechenden Sicherheitsabstand entnommen und unter dem Mikroskop untersucht. Kleinere Gewebeproben sollte man nicht entnehmen, da zur feingeweblichen Diagnosestellung bzw. zur Tumordickenbestimmung die gesamte Läsion beurteilt werden sollte. Daneben wird kontrovers diskutiert, ob durch die Entnahme von nur einem kleinen Anteil des Tumors die Gefahr einer Streuung ([[Metastasierung]]) über die Blutbahn oder die Lymphe zu groß wäre. |
||
In einer 2014 veröffentlichten Pivotstudie konnte nachgewiesen werden, dass sich das am Stockholmer Karolinska-Institut entwickelte Verfahren der elektrischen Impedanzspektroskopie (EIS) mit einer Sensitivität von 97 % als Hilfsmittel zur Früherkennung von Melanomen eignet.<ref>{{Literatur|Autor=J. Malvehy, A. Hauschild, C. Curiel-Lewandrowski, P. Mohr, R. Hofmann-Wellenhof, R. Motley, C. Berking, D. Grossman, J. Paoli, C. Loquai, J. Olah, U. Reinhold, H. Wenger, T. Dirschka, S. Davis, C. Henderson, H. Rabinovitz, J. Welzel, D. Schadendorf, U. Birgersson|Titel=Clinical performance of the Nevisense system in cutaneous melanoma detection: an international, multicentre, prospective and blinded clinical trial on efficacy and safety|Sammelwerk=The British Journal of Dermatology|Band=171|Nummer=5|Verlag=|Jahr=2014|Monat=11|Seiten=1099–1107|ISSN=1365-2133 |
In einer 2014 veröffentlichten Pivotstudie konnte nachgewiesen werden, dass sich das am Stockholmer Karolinska-Institut entwickelte Verfahren der elektrischen Impedanzspektroskopie (EIS) mit einer Sensitivität von 97 % als Hilfsmittel zur Früherkennung von Melanomen eignet.<ref>{{Literatur|Autor=J. Malvehy, A. Hauschild, C. Curiel-Lewandrowski, P. Mohr, R. Hofmann-Wellenhof, R. Motley, C. Berking, D. Grossman, J. Paoli, C. Loquai, J. Olah, U. Reinhold, H. Wenger, T. Dirschka, S. Davis, C. Henderson, H. Rabinovitz, J. Welzel, D. Schadendorf, U. Birgersson|Titel=Clinical performance of the Nevisense system in cutaneous melanoma detection: an international, multicentre, prospective and blinded clinical trial on efficacy and safety|Sammelwerk=The British Journal of Dermatology|Band=171|Nummer=5|Verlag=|Jahr=2014|Monat=11|Seiten=1099–1107|ISSN=1365-2133|DOI=10.1111/bjd.13121|PMID=24841846}}</ref> Das EIS-Verfahren ermöglicht eine schmerzfreie und nicht-invasive Untersuchung verdächtiger Hautareale bis zu einer Tiefe von 2,5 mm. EIS eignet sich auch zum Ausschluss eines Melanomverdachtes bei klinisch auffälligen Läsionen, so dass es zur Vermeidung unnötiger Exzisionen beitragen kann.<ref>P. Mohr, U. Birgersson u. a.: ''Electrical impedance spectroscopy as a potential adjunct diagnostic tool for cutaneous melanoma''. In: ''Skin Research and Technology.'' Mai 2013, Band 19, Nummer 2, S. 75–83, [[doi:10.1111/srt.12008]]</ref> |
||
Die [[Positronen-Emissions-Tomographie]] (PET) eignet sich sehr gut für Diagnose, [[Stadienbestimmung (Onkologie)|Staging]] und Re-Staging des malignen Melanoms. |
Die [[Positronen-Emissions-Tomographie]] (PET) eignet sich sehr gut für Diagnose, [[Stadienbestimmung (Onkologie)|Staging]] und Re-Staging des malignen Melanoms. |
||
| Zeile 184: | Zeile 184: | ||
Eine Reihe von Forschern schlägt vor, den [[Wächterlymphknoten]] zu identifizieren und histologisch zu untersuchen, da dadurch in einem Teil der Fälle das generelle Entfernen von Lymphknoten überflüssig werde,<ref>Donald L. Morton u. a.: [http://content.nejm.org/cgi/content/full/355/13/1307 ''Sentinel-Node Biopsy or Nodal Observation in Melanoma''.] In: ''The New England Journal of Medicine'' Bd. 355, 28. September 2006, S. 1307–1317.</ref> die Studie auf die sich diese Meinung stützt wurde jedoch in Ihrer statistischen Analyse kritisiert.<ref>J Meirion Thomas: [http://www.nature.com/nrclinonc/journal/v5/n1/full/ncponc1014.html ''Prognostic false-positivity of the sentinel node in melanoma''.] In: ''Nature Clinical Practice Oncology'' Bd. 5, 13. September 2007, S. 18–23.</ref> |
Eine Reihe von Forschern schlägt vor, den [[Wächterlymphknoten]] zu identifizieren und histologisch zu untersuchen, da dadurch in einem Teil der Fälle das generelle Entfernen von Lymphknoten überflüssig werde,<ref>Donald L. Morton u. a.: [http://content.nejm.org/cgi/content/full/355/13/1307 ''Sentinel-Node Biopsy or Nodal Observation in Melanoma''.] In: ''The New England Journal of Medicine'' Bd. 355, 28. September 2006, S. 1307–1317.</ref> die Studie auf die sich diese Meinung stützt wurde jedoch in Ihrer statistischen Analyse kritisiert.<ref>J Meirion Thomas: [http://www.nature.com/nrclinonc/journal/v5/n1/full/ncponc1014.html ''Prognostic false-positivity of the sentinel node in melanoma''.] In: ''Nature Clinical Practice Oncology'' Bd. 5, 13. September 2007, S. 18–23.</ref> |
||
In späteren Stadien, wenn der Tumor bereits [[Metastase]]n in Haut, [[Lymphknoten]] und [[Innere Organe|inneren Organen]] gebildet hat, ist die Chance auf eine Heilung gering. Hier werden eine ganze Reihe von Therapiealternativen angewendet und erprobt, die in der Regel nur eine zeitweilige Besserung bieten, jedoch meist keine Aussicht auf Heilung haben. Hierzu gehören die [[Chemotherapie]] mit [[DTIC]] oder [[Fotemustin]], eine Immuntherapie mit [[Interferon]], eine Impftherapie mit antigenpräsentierenden Zellen, chirurgische Eingriffe zur Verringerung der Tumormasse oder eine [[Strahlentherapie]]. Neue Therapieansätze beruhen auf der Blockade molekularer Prozesse in der [[Signaltransduktion]] der [[Zelle (Biologie)|Zelle]]: Es gibt erfolgversprechende Studien über eine Kombination eines klassischen Chemotherapeutikums mit b-raf-Kinase-Inhibitoren wie [[Sorafenib]]. Auch eine vom Wirkmechanismus ähnliche Substanz [[Vemurafenib]] erhielt 2012 eine positive Empfehlung der europäischen Zulassungsbehörde. Allerdings ist eine Therapie mit b-raf-Inhibitoren nur für Melanompatienten mit einer BRAF<sup>V600E</sup>-Mutation sinnvoll (ca. 50 % der Patienten) und die Wirkung des Medikaments ist fast immer transient.<ref> |
In späteren Stadien, wenn der Tumor bereits [[Metastase]]n in Haut, [[Lymphknoten]] und [[Innere Organe|inneren Organen]] gebildet hat, ist die Chance auf eine Heilung gering. Hier werden eine ganze Reihe von Therapiealternativen angewendet und erprobt, die in der Regel nur eine zeitweilige Besserung bieten, jedoch meist keine Aussicht auf Heilung haben. Hierzu gehören die [[Chemotherapie]] mit [[DTIC]] oder [[Fotemustin]], eine Immuntherapie mit [[Interferon]], eine Impftherapie mit antigenpräsentierenden Zellen, chirurgische Eingriffe zur Verringerung der Tumormasse oder eine [[Strahlentherapie]]. Neue Therapieansätze beruhen auf der Blockade molekularer Prozesse in der [[Signaltransduktion]] der [[Zelle (Biologie)|Zelle]]: Es gibt erfolgversprechende Studien über eine Kombination eines klassischen Chemotherapeutikums mit b-raf-Kinase-Inhibitoren wie [[Sorafenib]]. Auch eine vom Wirkmechanismus ähnliche Substanz [[Vemurafenib]] erhielt 2012 eine positive Empfehlung der europäischen Zulassungsbehörde. Allerdings ist eine Therapie mit b-raf-Inhibitoren nur für Melanompatienten mit einer BRAF<sup>V600E</sup>-Mutation sinnvoll (ca. 50 % der Patienten) und die Wirkung des Medikaments ist fast immer transient.<ref>Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano, Lorenza Pastorino, Virginia Picasso, Elena Tornari, Vincenzo Ottaviano, Paola Queirolo: ''BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies.'' In: ''OncoTargets and Therapy.'' S. 157–168, {{DOI|10.2147/OTT.S39096}}.</ref> In der Regel tritt nach einer Behandlung mit b-raf-Inhibitoren nach etwa sieben Monaten eine Regression des Tumors und seiner Metastasen auf.<ref>Gerald Falchook, Radhika Kainthla, Kevin Kim: ''Dabrafenib for treatment of BRAF-mutant melanoma.'' In: ''Pharmacogenomics and Personalized Medicine.'' S. 21, {{DOI|10.2147/PGPM.S37220}}.</ref> Eine weitere therapeutische Möglichkeit zielt darauf ab, das Immunsystem zu stimulieren ([[Krebsimmuntherapie]]). Hierfür ist seit 2011 der Wirkstoff [[Ipilimumab]]<ref>{{Literatur|Autor=Benjamin Scheier, Rodabe Amaria, Karl Lewis, Rene Gonzalez|Titel=Novel therapies in melanoma|Sammelwerk=Immunotherapy|Band=3|Nummer=12|Verlag=|Jahr=2011|Monat=12|Seiten=1461–1469|DOI=10.2217/imt.11.136|PMID=22091682|Kommentar=Review}}</ref> in der EU zugelassen.<ref>{{Internetquelle | url=http://www3.apoverlag.at/pdf/files/OAZ/OAZ-2012/OAZ-2012-05.pdf | titel=Melanom – Neue Therapieoptionen|seiten= 42 | autor=Christoph Baumgärtel| datum=2012-02-27 |zugriff=2012-02-27 | format=PDF; 20,5 MB }}</ref>. Auf ähnliche Weise wirkt der inhibitorische Antikörper gegen den Immuncheckpoint-Hemmer PD-1, der in ersten klinischen Studien vielversprechende Ergebnisse erzielte.<ref name="DOI10.1200/JCO.2013.53.0105">S. L. Topalian, M. Sznol u. a.: ''Survival, Durable Tumor Remission, and Long-Term Safety in Patients With Advanced Melanoma Receiving Nivolumab.'' In: ''Journal of Clinical Oncology.'' 32, 2014, S. 1020, {{DOI|10.1200/JCO.2013.53.0105}}.</ref> |
||
Patienten, die zuvor einmal an einem malignen Melanom erkrankt waren, werden regelmäßige Nachuntersuchungen empfohlen. |
Patienten, die zuvor einmal an einem malignen Melanom erkrankt waren, werden regelmäßige Nachuntersuchungen empfohlen. |
||
| Zeile 191: | Zeile 191: | ||
== Literatur == |
== Literatur == |
||
* {{Literatur|Autor=Giuseppe Palmieri, Mariaelena Capone, Maria Libera Ascierto, Giusy Gentilcore, David F. Stroncek, Milena Casula, Maria Cristina Sini, Marco Palla, Nicola Mozzillo, Paolo A. Ascierto|Titel=Main roads to melanoma|Sammelwerk=Journal of Translational Medicine|Band=7|Verlag=|Jahr=2009|Seiten=86|ISSN=1479-5876 |
* {{Literatur|Autor=Giuseppe Palmieri, Mariaelena Capone, Maria Libera Ascierto, Giusy Gentilcore, David F. Stroncek, Milena Casula, Maria Cristina Sini, Marco Palla, Nicola Mozzillo, Paolo A. Ascierto|Titel=Main roads to melanoma|Sammelwerk=Journal of Translational Medicine|Band=7|Verlag=|Jahr=2009|Seiten=86|ISSN=1479-5876|DOI=10.1186/1479-5876-7-86|PMID=19828018}} {{PMC|2770476}} |
||
* Y. M. Chang u. a.: ''Sun exposure and melanoma risk at different latitudes: a pooled analysis of 5700 cases and 7216 controls.'' In: ''International journal of epidemiology.'' Band 38, Nummer 3, Juni 2009, S. 814–830, {{ISSN|1464-3685}}. [[doi:10.1093/ije/dyp166]]. PMID 19359257. {{PMC|2689397}}. |
* Y. M. Chang u. a.: ''Sun exposure and melanoma risk at different latitudes: a pooled analysis of 5700 cases and 7216 controls.'' In: ''International journal of epidemiology.'' Band 38, Nummer 3, Juni 2009, S. 814–830, {{ISSN|1464-3685}}. [[doi:10.1093/ije/dyp166]]. PMID 19359257. {{PMC|2689397}}. |
||
* Claus Garbe: ''Management des Melanoms.'' Verlag Springer, Heidelberg 2006, ISBN 3-540-28987-9 {{Google Buch|BuchID=jAKdC1qkUo8C}} |
* Claus Garbe: ''Management des Melanoms.'' Verlag Springer, Heidelberg 2006, ISBN 3-540-28987-9 {{Google Buch|BuchID=jAKdC1qkUo8C}} |
||
Version vom 18. Juli 2015, 22:17 Uhr
| Klassifikation nach ICD-10 | |
|---|---|
| C43 | Bösartiges Melanom der Haut |
| ICD-10 online (WHO-Version 2019) | |


Das maligne Melanom (von gr. μέλας „schwarz“), auch kurz Melanom, Melano(zyto)blastom oder schwarzer Hautkrebs (engl.: [malignant] melanoma) genannt, ist ein hochgradig bösartiger Tumor der Pigmentzellen (Melanozyten). Er neigt dazu, früh Metastasen über Lymph- und Blutbahnen zu streuen, und ist die am häufigsten tödlich verlaufende Hautkrankheit mit weltweit stark steigender Anzahl an Neuerkrankungen.
Neben dem hier behandelten malignen Melanom der Haut (kutanes Melanom) gibt es auch maligne Melanome der Schleimhäute, des Auges (Bindehautmelanom, Aderhautmelanom), des Zentralnervensystems, der inneren Organe und des Anus (anorektales Melanom). Diese Gruppe der malignen Melanome wird als mukosale Melanome (von Mucosa = Schleimhaut) bezeichnet.[1] Im Vergleich zum kutanen Melanom sind die mukosalen Melanome wesentlich seltener.
Häufigkeit



Die Häufigkeit der Neuerkrankung (Inzidenz) beträgt bei der hellhäutigen Bevölkerung in Europa und Nordamerika etwa 13 bis 15 Neuerkrankungen pro Jahr auf 100.000 Einwohner. Daraus ergibt sich ein Lebenszeitrisiko von etwas mehr als ein Prozent. Zum Vergleich liegt das Lebenszeitrisiko für ein kolorektales Karzinom bei 4 bis 6 Prozent.[2] Die Inzidenz dieser Erkrankung ist in den letzten 50 Jahren dramatisch gestiegen. 1960 lag das Lebenszeitrisiko noch bei 1:600, während es gegenwärtig im Bereich von 1:75 bis 1:100 liegt. Diese Werte machen das maligne Melanom zum Tumor mit der am schnellsten ansteigenden Inzidenz.[3]
2010 erkrankten in Deutschland 19.220 Menschen (9.640 Männer und 9.580 Frauen) an einem malignen Melanom der Haut. Im selben Jahr verstarben 2.711 Deutsche (1.568 Männer und 1.143 Frauen) an den Folgen dieser Krankheit. Für das Jahr 2014 wurden 19.700 Neuerkrankungen prognostiziert. Das mittlere Erkrankungsalter von Frauen liegt bei 58 und bei Männern bei 66 Jahren. Sowohl die Erkrankungsrate als auch die Sterberate ist bei Männern etwas höher als bei Frauen.[4]
Als Todesursache hat das maligne Melanom für beide Geschlechter einen Anteil von 1,3 Prozent an allen Krebstodesursachen in Deutschland.[5] Aufklärungsprogramme hielten – trotz deutlicher Zunahme der Erkrankungszahlen – die Sterberate bisher weitgehend konstant.[6]
Die Häufigkeit des malignen Melanoms der Haut ist regional sehr unterschiedlich. In einigen Staaten ist es eine ausgesprochen seltene Erkrankung, während bei der hellhäutigen Bevölkerung Australiens das Lebenszeitrisiko – im Vergleich zu Europäern – etwa vierfach erhöht ist und bei ungefähr vier Prozent liegt. In Nordamerika in der Altersgruppe von 25 bis 34 Jahren ist das Melanom bei Männern die vierthäufigste und bei Frauen die zweithäufigste Krebsart.[7][8] Der weltweit höchste Wert wird in Auckland (Neuseeland) erreicht.[9] Afroamerikaner haben ein um den Faktor 20 niedrigeres Risiko, am malignen Melanom der Haut zu erkranken, als Menschen mit heller Haut.[6]
-
Der prozentuale Anteil ausgewählter Tumorlokalisationen an allen Krebsneuerkrankungen in Deutschland im Jahr 2006.
-
Die Verteilung der Krebserkrankungen auf die einzelnen Organe bei Mann und Frau in Deutschland im Jahr 2007.
Auf der x-Achse die altersstandardisierte Mortalitätsrate (erster Zahlenwert) und der prozentuale Anteil an den Krebserkrankungen (zweiter Zahlenwert in der Klammer).
Risikofaktoren
Tabellarische Zusammenfassung
Quelle: H. Hamm, P.H. Höger: Hauttumoren im Kindesalter.[10]
- frühere maligne Erkrankung
- Hellhäutigkeit, rote und blonde Haare, helle Augenfarbe
- hohe Zahl gewöhnlicher melanozytärer Nävi (Muttermale)
- Immunsuppression
- Intermittierende intensive Exposition gegenüber UV-Licht
- kongenitaler melanozytärer Naevus, insbesondere ein riesiger
- mehrere atypische melanozytäre Nävi
- Melanome in der Familie
- Neigung zu Sonnenbränden bei Exposition gegenüber UV-Licht
- Sommersprossen, aktinische Lentigines
- Störungen der DNA-Reparatur, insbesondere Xeroderma pigmentosum
UV-Strahlung und Sonnenbrand

Etwa alle sieben Jahre verdoppelt sich die Zahl der an einem Melanom erkrankten Patienten. Dies wurde früher in erster Linie auf Veränderungen der Freizeitgewohnheiten zurückgeführt. UV-Strahlung gilt als die wichtigste umweltbedingte Melanomursache.[11] Der Zusammenhang von Sonnenstrahlung und Krebshäufigkeit wurde erstmals von Eleanor Josephine Macdonald auf Basis des von ihr in den USA errichteten Krebsregisters nachgewiesen.
„Trotz vieler Aufklärungskampagnen“ in den letzten zwei Jahrzehnten konnte das Schönheitsideal „braun sein = gesund sein“ allerdings „noch nicht ausreichend korrigiert werden“, so dass trotz gestiegenen Gesundheitsbewusstseins „die Zahl der Neuerkrankungen jedes Jahr weiter“ ansteige.[12]
Das Deutsche Krebsforschungszentrum sieht als wesentlichen Umweltrisikofaktor die exzessive Exposition gegenüber Sonnenlicht an. Daneben spiele der Hauttyp als endogener Faktor eine entscheidende Rolle. Rothaarige, die eine gegenüber UV-Strahlung besonders empfindliche Haut haben, erkranken statistisch gesehen 4,7× häufiger an einem malignen Melanom als Schwarzhaarige.[3]
Die Suche nach möglichen beruflichen Risikofaktoren lieferte – wie auch ernährungsepidemiologische Studien – widersprüchliche Resultate.[13]
Einfluss von Sonnencreme
Die Schutzwirkung von Sonnencremes wird sehr kontrovers diskutiert. Über die Verhinderung der Entstehung von Hautkrebs gibt es sehr widersprüchliche Studien. In einigen Studien wurden eher negative Auswirkungen bei der Anwendung von Sonnencremes festgestellt,[14] während in anderen Veröffentlichungen und Studien das Gegenteil behauptet wird.[15] Im Tiermodell wurde zwar eine eindeutige Wirkung von Sonnencreme zur Verhinderung der Ausbildung eines Spinalioms der Haut (ein Plattenepithelkarzinom) festgestellt, jedoch ist dies beim malignen Melanom und beim Basaliom nicht der Fall.[16]
In einer 2003 erschienenen Metastudie wurde jedoch kein Zusammenhang zwischen der Verwendung von Sonnencreme und der Zunahme von Erkrankungen an malignen Melanomen beim Menschen festgestellt. Die Studie kommt zu dem Schluss, dass in früheren Studien offensichtlich Fehler bei der Berücksichtigung von Konfundierungseffekten gemacht wurden und sie deshalb eine positive Korrelation zwischen der Benutzung von Sonnencreme und dem Auftreten von malignen Melanomen feststellten. Von Konfundierungseffekten spricht man, wenn das zu untersuchende Phänomen (hier die Zunahme an malignen Melanomen) von zwei oder mehr Bedingungen gleichzeitig beeinflusst wird. In den vorhergehenden Studien seien zudem neuere Sonnencremes mit einem Schutzfaktor größer als 15, einem Schutz gegen UV-A-Strahlung und Wasserfestigkeit überhaupt nicht berücksichtigt worden. Die Autoren gehen davon aus, dass es Jahrzehnte dauern kann, um einen positiven Effekt zwischen dem Gebrauch von neueren Rezepturen von Sonnencremes und malignen Melanomen zu ermitteln.[17]
Eine 2014 in Nature veröffentlichte Studie deutet darauf hin, dass Sonnencreme keinen ausreichenden Schutz vor malignen Melanomen bietet. In der Studie wurde der rasierte Rücken von Mäusen, in denen künstlich eine bestimmte Mutation im Wachstumsgen BRAF herbeigeführt wurde, wiederholt einer Dosis an ultravioletter Strahlung ausgesetzt, welche beim Menschen einem leichten Sonnenbrand entspräche. Gänzlich ungeschützte Hautbereiche entwickelten so innerhalb von sieben Monaten Melanome, mit Sonnenschutzfaktor 50 behandelte Hautstellen blieben bis zu 17 Monate ohne Melanome, und mit einem Tuch abgedeckte Stellen blieben zu circa 20 Prozent noch mindestens zwei Jahre melanomfrei.[18]
Pigmentnävus
In 60 % der Fälle entsteht ein Melanom aus einem seit Jahren bestehenden Nävuszellnävus, meist vom epidermalen oder junktionalen Typ.[19] Auch gibt es keine Belege dafür, dass die Schädigung eines Nävus, beispielsweise durch eine Verletzung, die Entwicklung eines malignen Melanoms bewirken kann. Im Durchschnitt hat ein Mensch etwa 20 Nävi auf seiner gesamten Haut. Menschen mit über 50 Nävi haben ein um den Faktor 4,8 höheres Risiko, als Menschen mit weniger als 10 Nävi auf ihrer Haut, im Laufe ihres Lebens ein malignes Melanom zu bekommen. Die Anzahl der melanozytären Nävi ist daher ein wichtiger Risikofaktor für maligne Melanome. Bei 30 bis 40 Prozent der Fälle besteht eine Assoziation zwischen melanozytären Nävi und malignem Melanom.[3] Menschen, die eine hohe Anzahl von Nävuszellnävi aufweisen und Träger von dysplastischen Nävuszellnävi sind, haben ein erhöhtes Risiko im Lauf ihres Lebens an einem malignen Melanom zu erkranken.[20]
Etwa fünf bis zehn Prozent aller malignen Melanome treten familiär gehäuft auf.[21] Hier wird ein polygener Erbgang vermutet.
Diagnostik
Warnsymptome des malignen Melanoms können die Vergrößerung, die Farbänderung sowie das Jucken von Leberflecken (von Leberflecken gehen 40 % der Erkrankungen aus) oder Veränderungen von Hautpartien sein, die pigmentiert sind (dunkler erscheinen). Bei dunkelhäutigen Menschen hingegen geht die Erkrankung meistens von Stellen aus, die weniger dunkel sind, zum Beispiel von den Schleimhäuten oder den Handflächen.
Früherkennung
Jeder Verdacht sollte so schnell wie möglich durch einen Hautarzt abgeklärt werden, um gegebenenfalls das Melanom früh – vor der Metastasierung – entfernen zu können. In Deutschland bieten die Krankenkassen der GKV deshalb durch den Beschluss des Gemeinen Bundesausschusses vom 15. November 2007 seit dem 1. Juli 2008 eine Hautkrebsvorsorgeuntersuchung ohne Auflichtmikroskopie an, und zwar ab dem 35. Lebensjahr alle zwei Jahre.[22] Die Deutsche Dermatologische Gesellschaft empfiehlt jedoch, die Haut, bei auffälligen Leberflecken, einmal im Jahr mit Auflichtmikroskop vom Hautarzt untersuchen zu lassen. Diese aussagekräftigere Untersuchung wird nicht von einer Krankenkasse übernommen, sodass sie privat nach GOÄ abgerechnet wird. Regelmäßige Selbstuntersuchungen auf Veränderungen von Muttermalen helfen, Melanome frühzeitig zu entdecken. Dies ist insbesondere für Personen mit an Melanom erkrankten Verwandten oder mit einer Vielzahl von Nävuszellnävi wichtig.
Beurteilung nach der „ABCDE-Regel“


Treffen zwei der folgenden fünf Kriterien auf einen verdächtigen Pigmentfleck zu, wird in der Regel zu einer vorsorglichen Entfernung des Flecks geraten:
- A – Asymmetry (Asymmetrie): nicht symmetrisch, beispielsweise nicht rund oder oval
- B – Border (Begrenzung): unregelmäßig oder unscharf
- C – Colour (Farbe): unterschiedlich starke Pigmentierung, Mehrfarbigkeit
- D – Diameter (Durchmesser): größer als 5 mm
- E – Evolution (Erhabenheit/Entwicklung): neu und in kurzer Zeit entstanden auf sonst flachem Grund
Diagnose

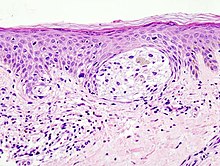
Ein Arzt mit entsprechender Erfahrung kann meist durch Sichtung der verdächtigen Hautpartie feststellen, ob es sich um ein malignes Melanom handelt oder nicht. Im Zweifelsfall wird das verdächtige Hautareal im Ganzen (in toto) mit einem entsprechenden Sicherheitsabstand entnommen und unter dem Mikroskop untersucht. Kleinere Gewebeproben sollte man nicht entnehmen, da zur feingeweblichen Diagnosestellung bzw. zur Tumordickenbestimmung die gesamte Läsion beurteilt werden sollte. Daneben wird kontrovers diskutiert, ob durch die Entnahme von nur einem kleinen Anteil des Tumors die Gefahr einer Streuung (Metastasierung) über die Blutbahn oder die Lymphe zu groß wäre.
In einer 2014 veröffentlichten Pivotstudie konnte nachgewiesen werden, dass sich das am Stockholmer Karolinska-Institut entwickelte Verfahren der elektrischen Impedanzspektroskopie (EIS) mit einer Sensitivität von 97 % als Hilfsmittel zur Früherkennung von Melanomen eignet.[23] Das EIS-Verfahren ermöglicht eine schmerzfreie und nicht-invasive Untersuchung verdächtiger Hautareale bis zu einer Tiefe von 2,5 mm. EIS eignet sich auch zum Ausschluss eines Melanomverdachtes bei klinisch auffälligen Läsionen, so dass es zur Vermeidung unnötiger Exzisionen beitragen kann.[24]
Die Positronen-Emissions-Tomographie (PET) eignet sich sehr gut für Diagnose, Staging und Re-Staging des malignen Melanoms.
Mit Hilfe der Autofluoreszenz der Haut ist es möglich, die klinische Diagnose in einem frühen Stadium in vivo zu überprüfen. Dazu wird die Haut mit infrarotem Laserlicht in kurzen Impulsen bestrahlt. Das Melanin-Molekül absorbiert zwei der Photonen und fluoresziert im roten oder blau-grünen Spektralbereich. Anhand der Farbe kann eine Entscheidung über die Bösartigkeit des untersuchten Pigmentflecks getroffen werden.[25] Erste Studien zeigen, dass diese Fluoreszenmethode eine sichere Melanom-Erkennung an kleinsten Läsionen gewährleistet. Ebenso sicher kann mit ihr andererseits der Befund „benigner Naevus“ erhoben werden. Damit könnte zukünftig die Vielzahl der vorsorglichen Gewebeentnahmen bei der klinischen Diagnose „atypischer/dysplastischer Naevus“ vermieden werden.[26][27] Die einfache Möglichkeit von in vivo-Verlaufskontrollen bietet eine zusätzliche Sicherheit für Arzt und Patient.
Subtypen des malignen Melanoms
| Subtyp | Abkürzung | prozentualer Anteil |
medianes Erkrankungsalter |
| superfiziell spreitendes Melanom | SSM | 57,4 % | 51 Jahre |
| noduläres malignes Melanom | NMM | 21,4 % | 56 Jahre |
| Lentigo-maligna-Melanom | LMM | 8,8 % | 68 Jahre |
| akral-lentiginöses Melanom | ALM | 4,0 % | 63 Jahre |
| nicht klassifizierbares Melanom | UCM | 3,5 % | 54 Jahre |
| Sonstige | 4,9 % | 54 Jahre |
Eine weitere Unterart, das amelanotische Melanom (AMM), ist eine sehr seltene Variante und wird in obiger Tabelle zu »Sonstige« gerechnet.
Diese Subtypen unterscheiden sich durch ihr Aussehen, die Art des Wachstums und ihrer Neigung zur Metastasierung. Sie haben eine unterschiedliche Prognose. Da die Einteilung beim bloßen Betrachten nicht unbedingt eindeutig ist, wird in den meisten Fällen nach der operativen Entfernung des Tumors eine histologische Untersuchung durchgeführt.
Das maligne Melanom metastasiert besonders aggressiv. Es wurde von Fällen berichtet, bei denen das maligne Melanom in andere bösartige Tumore metastasiert ist. Wegen dieser starken Metastasierungsneigung verbietet es sich auch, eine Gewebeprobe zu nehmen (Biopsie). Stattdessen muss die Veränderung vollständig und mit einem ausreichenden Sicherheitsabstand entfernt werden.
Superfiziell spreitendes Melanom (SSM)
Die häufigste Form des malignen Melanoms, das superfiziell (oberflächlich) spreitende Melanom, wächst langsam, meist über einen Zeitraum von zwei bis vier Jahren, horizontal in der Hautebene. Es manifestiert sich als unregelmäßig pigmentierter, unscharf begrenzter Fleck. Mittig können depigmentierte (helle) Inseln entstehen. Im späteren Stadium, nach etwa zwei bis vier Jahren, wächst das SSM auch in vertikaler Richtung, und es bilden sich Erhabenheiten. Bei Frauen findet sich das SSM häufig am Unterschenkel, beim Mann meist am Körperstamm. Es entsteht in der Regel jenseits des 50. Lebensjahrs.[21]
Noduläres malignes Melanom (NMM)
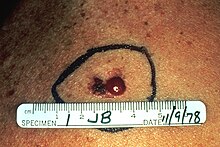
Beim nodulären malignen Melanom handelt sich um die aggressivste Form der malignen Melanome mit der ungünstigsten Prognose. Es tritt gehäuft ab dem 55. Lebensjahr auf. Charakteristisch ist sein relativ schnelles vertikales Wachstum und seine frühzeitige Metastasierung über Lymphe und Blut. Es hat eine braune bis tiefschwarze Farbe mit glatter oder ulzerierter Oberfläche, die leicht blutet. Das noduläre Melanom kann aber auch amelanotisch, also nicht mehr in der Lage sein, Melanin herzustellen. Es wird dann wie weiter unten beschrieben amelanotisches Melanom (AMM) genannt. Meistens tritt der Tumor am Rücken, an der Brust oder an den Extremitäten auf. Bei fehlender Melaninsynthese kann es häufig fehldiagnostiziert werden.[21]
Lentigo-maligna-Melanom (LMM)
Dem LMM geht eine Lentigo maligna voraus. Es wächst relativ langsam und zunächst vor allem radial und horizontal. Erst nach bis zu 15 Jahren folgt das vertikale Wachstum, weshalb die Metastasierungsneigung geringer und damit die Prognose günstiger ist. Sein Aussehen ist durch große, teils erhabene, unregelmäßige Flecken gekennzeichnet. Zu 90 % sind die LMM im Gesicht lokalisiert, meist bei älteren Menschen ab dem 65. Lebensjahr.[21]
Akrolentiginöses Melanom (ALM)
Das Aussehen des akrolentiginösen Melanoms ähnelt dem Aussehen des LMM, es wächst aber deutlich schneller und aggressiver. Meist ist dieser Tumor an den Handflächen beziehungsweise Fußsohlen, aber auch unter den Nägeln lokalisiert. Er tendiert zu Blutungen und kann, wenn er sich unter einem Finger- oder Fußnagel befindet, zur Nagelablösung führen. Dieser Melanomtyp trifft bevorzugt dunkelhäutige Menschen. In Afrika und Asien stellt es mit 30 bis 70 Prozent den Hauptanteil an Melanomdiagnosen.[21] Das akrolentiginöse Melanom ist in der Differentialdiagnose besonders anspruchsvoll, da es oft amelanotisch ist und in der Prognose eher ungünstig.[29]
Amelanotisches Melanom (AMM)
Das amelanotische Melanom entspricht in etwa dem NMM, wobei jedoch wegen der Entartung der Zellen kein Pigment mehr gebildet wird. Dies macht es besonders tückisch, weil es oft erst sehr spät entdeckt wird; dann liegen oft schon Metastasen vor. Amelanotische Melanome können sehr untypisch aussehen.
Seltene Melanomvarianten
Polypoides Melanom


Das polypoide Melanom ist sowohl histologisch als auch klinisch betrachtet eine besondere Variante eines malignen Melanoms. Es tritt in gestielter Form auf und hat eine blumenkohlartige Gestalt. Es wächst zum größten Teil über die Oberfläche der Epidermis hinaus (exophytisch) und die Knoten sind in den meisten Fällen amelanotisch. Das polypoide Melanom ist häufig auf dem Rücken lokalisiert.[30]
Prognose (Folgen und Komplikationen)


Kriterien zur Prognose und Therapie liefern die Stadien der TNM-Klassifikation, die Tumordicke (nach Breslow), die Ulzeration des Tumors, die Eindringtiefe (Clark-Level), der Subtyp (beispielsweise LMM hat eine bessere Prognose als AMM), die Tumorlokalisation und das Geschlecht (Männer haben eine schlechtere Prognose). Keinen Einfluss auf die Prognose hat die Dunkelheit oder Helligkeit des Melanoms. Hiervon ausgenommen ist das amelanotische Melanom, das eine schlechte Prognose besitzt.
Bei einer frühen Diagnose und Behandlung steht die Chance einer Heilung gut. Insbesondere bei „In-situ-Melanomen“, also bei Melanomen, die die sogenannte Basalmembran – die Begrenzung zwischen Epidermis (Oberhaut) und Dermis (Lederhaut) – noch nicht durchbrochen haben, liegt das Metastasierungsrisiko bei 0 %. Die meisten Melanome sind in diesem Stadium bereits erkennbar.
Bei dünnen Melanomen (vertikale Tumordicke kleiner als 0,75 mm) liegen die Heilungschancen bei etwa 95 Prozent. Die Fünf-Jahres-Überlebensrate (= Anteil Patienten, die fünf Jahre nach Feststellung der Krankheit noch leben) ist abhängig vom Stadium der Ausbreitung des Krebses:
- Stadium I (Primärtumor ≤ 1,5 mm dick und von Clark-Level ≤ III) > 90 %
- Stadium II (Primärtumor > 1,5 mm dick oder von Clark-Level ≥ IV) 70 %
- Stadium III (Absiedelung in die nächstgelegenen Lymphknoten oder Hautmetastasen in der Umgebung) 40 %
- Stadium IV (Metastasen in weiter entfernten Lymphknoten oder anderen Organen) < 10 %
Das Melanom kann in unterschiedlichste Organe metastasieren, bevorzugte Zielorgane wie bei anderen Tumoren (etwa Kolonkarzinom → Leber) gibt es nicht. Häufig sind Metastasen in der Leber, in der Haut, in der Lunge, im Skelett und im Gehirn. Dabei beeinflussen gerade Leber- und Hirnmetastasen die Prognose ungünstig, während Melanommetastasen in der Lunge erfahrungsgemäß eher langsam an Größe zunehmen. Die Ursache für diese klinische Beobachtung ist noch nicht bekannt. Typischerweise metastasiert das maligne Melanom außerdem häufig in das Herz. Herzmetastasen vom malignen Melanom gehören zu den häufigsten der ansonsten seltenen bösartigen Herztumoren.[31] Etwa 40–60 % der Herzmetastasen haben ihren Ursprung in einem malignen Melanom.[32]
Nur eine frühzeitige und vollständige Entfernung eines Melanoms kann zur Heilung führen. Abwarten, ob aus Nachlässigkeit oder Angst, verschlechtert die Aussichten wesentlich. Deswegen sind Vorsorgeuntersuchungen und Früherkennungsmaßnahmen gerade bei besonders gefährdeten Menschen wichtig.
Behandlung
Die wichtigste Therapieform ist die chirurgische Entfernung des Primärtumors. Hierbei sollte der Tumor stets als Ganzes entfernt werden. Biopsien werden bei Verdacht auf ein malignes Melanom nicht entnommen, um eine Streuung in die Blutbahn und/oder die Lymphflüssigkeit zu vermeiden. Bei der Entfernung sollte auf einen ausreichenden Sicherheitsabstand geachtet werden. Dieser beträgt je nach Tumordicke 1 oder 2 cm; außerdem sollten alle Hautschichten unter dem Tumor bis auf die Muskelfaszie entfernt werden. Bei Melanomen im Gesicht oder an den Akren kann man statt der Einhaltung eines großen Sicherheitsabstandes auch eine Exzision mit mikroskopisch-kontrollierter Chirurgie durchführen, bei der mittels Schnittrandkontrolle unter dem Mikroskop eine vollständige Entfernung im Gesunden sichergestellt wird.
Eine Reihe von Forschern schlägt vor, den Wächterlymphknoten zu identifizieren und histologisch zu untersuchen, da dadurch in einem Teil der Fälle das generelle Entfernen von Lymphknoten überflüssig werde,[33] die Studie auf die sich diese Meinung stützt wurde jedoch in Ihrer statistischen Analyse kritisiert.[34]
In späteren Stadien, wenn der Tumor bereits Metastasen in Haut, Lymphknoten und inneren Organen gebildet hat, ist die Chance auf eine Heilung gering. Hier werden eine ganze Reihe von Therapiealternativen angewendet und erprobt, die in der Regel nur eine zeitweilige Besserung bieten, jedoch meist keine Aussicht auf Heilung haben. Hierzu gehören die Chemotherapie mit DTIC oder Fotemustin, eine Immuntherapie mit Interferon, eine Impftherapie mit antigenpräsentierenden Zellen, chirurgische Eingriffe zur Verringerung der Tumormasse oder eine Strahlentherapie. Neue Therapieansätze beruhen auf der Blockade molekularer Prozesse in der Signaltransduktion der Zelle: Es gibt erfolgversprechende Studien über eine Kombination eines klassischen Chemotherapeutikums mit b-raf-Kinase-Inhibitoren wie Sorafenib. Auch eine vom Wirkmechanismus ähnliche Substanz Vemurafenib erhielt 2012 eine positive Empfehlung der europäischen Zulassungsbehörde. Allerdings ist eine Therapie mit b-raf-Inhibitoren nur für Melanompatienten mit einer BRAFV600E-Mutation sinnvoll (ca. 50 % der Patienten) und die Wirkung des Medikaments ist fast immer transient.[35] In der Regel tritt nach einer Behandlung mit b-raf-Inhibitoren nach etwa sieben Monaten eine Regression des Tumors und seiner Metastasen auf.[36] Eine weitere therapeutische Möglichkeit zielt darauf ab, das Immunsystem zu stimulieren (Krebsimmuntherapie). Hierfür ist seit 2011 der Wirkstoff Ipilimumab[37] in der EU zugelassen.[38]. Auf ähnliche Weise wirkt der inhibitorische Antikörper gegen den Immuncheckpoint-Hemmer PD-1, der in ersten klinischen Studien vielversprechende Ergebnisse erzielte.[39]
Patienten, die zuvor einmal an einem malignen Melanom erkrankt waren, werden regelmäßige Nachuntersuchungen empfohlen.
Spätmetastasen und CUP (Cancer of Unknown Primary, unbekannter Primärkrebs) sind beim malignen Melanom häufig.
Literatur
- Giuseppe Palmieri, Mariaelena Capone, Maria Libera Ascierto, Giusy Gentilcore, David F. Stroncek, Milena Casula, Maria Cristina Sini, Marco Palla, Nicola Mozzillo, Paolo A. Ascierto: Main roads to melanoma. In: Journal of Translational Medicine. Band 7, 2009, ISSN 1479-5876, S. 86, doi:10.1186/1479-5876-7-86, PMID 19828018. PMC 2770476 (freier Volltext)
- Y. M. Chang u. a.: Sun exposure and melanoma risk at different latitudes: a pooled analysis of 5700 cases and 7216 controls. In: International journal of epidemiology. Band 38, Nummer 3, Juni 2009, S. 814–830, ISSN 1464-3685. doi:10.1093/ije/dyp166. PMID 19359257. PMC 2689397 (freier Volltext).
- Claus Garbe: Management des Melanoms. Verlag Springer, Heidelberg 2006, ISBN 3-540-28987-9 eingeschränkte Vorschau in der Google-Buchsuche
- C. Garbe u. a.: Therapie des Melanoms. In: Dtsch Arztebl 105, 2008, S. 845–851. doi:10.3238/arztebl.2008.0845
- J. K. Rivers: Is there more than one road to melanoma? In: Lancet. Band 363, Nummer 9410, Februar 2004, S. 728–730, ISSN 1474-547X. doi:10.1016/S0140-6736(04)15649-3. PMID 15005091. (Review).
- C. Garbe, D. Schadendorf: Malignes Melanom – neue Daten und Konzepte zur Nachsorge. In: Dtsch Arztebl. 100, 2003, S. A-1804/B-1501/C-1409
- J. Bertz: Epidemiologie des malignen Melanoms der Haut. In: Bundesgesundheitsblatt 44, 2001, S. 484–490. ISSN 1436-990.
- S3-Leitlinie Diagnostik, Therapie und Nachsorge des Melanoms der Deutschen Krebsgesellschaft (DKG) und der Deutschen Dermatologische Gesellschaft (DDG). In: AWMF online (Stand 2013)
Weblinks
- PathoPic – Bilddatenbank der Universität Basel: Histologische Bilder von malignen Melanomen
- PathoPic – Bilddatenbank der Universität Basel: Makroskopische Bilder von malignen Melanomen und deren Metastasen
- PathoPic – Bilddatenbank der Universität Basel: Zytologische Bilder von malignen Melanomen und deren Metastasen
- Verbreitung des Malignen Melanoms
- Melanoma Molecular Map Project (in englischer Sprache)
- hautkrebs.de – das Hautkrebs-Infoportal
- Universitätsklinik Bonn: Zusammenfassung von Informationen der US-amerikanischen Krebsdatenbank PDQ zum Melanom, Februar 2002.
- Seite des Dermatologischen Informations-Systems zum Malignen Melanom
- Monika Preuk: Medizinische Raritäten: Spektakuläre Einblicke in den Körper; dazu Bild 3: Leber mit Melanom-Metastasen; Bild aus dem Medizinhistorischen Museum Berlin
Einzelnachweise
- ↑ B. M. Helmke, H. F. Otto: Das anorektale Melanom. (Anorectal melanoma. A rare and highly malignant tumor entity of the anal canal). In: Der Pathologe. Band 25, Nr. 3, Mai 2004, S. 171–177, doi:10.1007/s00292-003-0640-y, PMID 15138698 (Review).
- ↑ E. C. Jehle u. a.:Kolonkarzinom, Rektumkarzinom, Analkarzinom. (PDF; 1,13 MB) August 2003, ISSN 1438-8979, S. 1.
- ↑ a b c M. Volkenandt: Maligne Melanome. In: Dermatologie und Venerologie. O. Braun-Falco u. a. (Herausgeber). Verlag Springer, 2005, ISBN 3-540-40525-9, S. 1313–1324 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Robert-Koch-Institut (Herausgeber): Krebs in Deutschland 2009/2010. 9. Ausgabe, 2013, S. 60ff. (abgerufen am 19. Mai 2014)
- ↑ Die 20 häufigsten Krebstodesursachen in Deutschland im Jahr 2007. In: Krebsatlas, Deutsches Krebsforschungszentrum, 6. Mai 2009, abgerufen am 27. März 2010.
- ↑ a b Medikamente für Menschen: Melanom. (PDF; 143 kB) Europäischer Verband der Pharmazeutischen Industrien und Verbände (Herausgeber)
- ↑ S. Rötzer: Lebensqualität bei Melanom- Patienten unter adjuvanter Interferon-alpha 2a-Therapie. Dissertation, Charité Berlin, 2008.
- ↑ Renee A. Desmond, Seng-jaw Soong: Epidemiology of malignant melanoma. In: The Surgical Clinics of North America. Band 83, Nr. 1, Februar 2003, S. 1–29, PMID 12691448.
- ↑ Climate. In: Te Ara: The Encyclopedia of New Zealand.
- ↑ H. Hamm, P.H. Höger: Hauttumoren im Kindesalter. In: Dt. Aerzteblatt. 108, 20, 2011.
- ↑ U. Beise: Melanom: Sonnenlicht ist nicht die einzige Ursache. In: Ars Medici 15/2004, S. 775f.
- ↑ Malignes Melanom („Schwarzer Hautkrebs“). In: Deutsche Krebsgesellschaft, 7. Juli 2008, abgerufen am 14. Oktober 2008.
- ↑ Melanom / Melanoma (ICD 172). In: Krebsatlas. Deutsches Krebsforschungszentrum, abgerufen am 14. Oktober 2008.
- ↑ D. Hill: Efficacy of sunscreens in protection against skin cancer. In: Lancet. Band 354, Nr. 9180, 28. August 1999, S. 699–700, doi:10.1016/S0140-6736(99)00192-0, PMID 10475178. oder Ken Landow: Do sunscreens prevent skin cancer? In: Postgraduate Medicine. Band 116, Nr. 1, Juli 2004, S. 6, PMID 15274282.
- ↑ Marianne Berwick: Counterpoint: sunscreen use is a safe and effective approach to skin cancer prevention. In: Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology. Band 16, Nr. 10, Oktober 2007, S. 1923–1924, doi:10.1158/1055-9965.EPI-07-0391, PMID 17932338. oder Adèle C. Green, Gail M. Williams: Point: sunscreen use is a safe and effective approach to skin cancer prevention. In: Cancer Epidemiology, Biomarkers & Prevention. Band 16, Nr. 10, Oktober 2007, S. 1921–1922, doi:10.1158/1055-9965.EPI-07-0477, PMID 17932337.
- ↑ P. Wolf: Lichtschutzmittel. (Sunscreens. Protection against skin cancers and photoaging). In: Der Hautarzt; Zeitschrift Für Dermatologie, Venerologie, Und Verwandte Gebiete. Band 54, Nr. 9, September 2003, S. 839–844, doi:10.1007/s00105-003-0590-6, PMID 12955261.
- ↑ Leslie K. Dennis, Laura E. Beane Freeman, Marta J. VanBeek: Sunscreen use and the risk for melanoma: a quantitative review. In: Annals of Internal Medicine. Band 139, Nr. 12, 16. Dezember 2003, S. 966–978, PMID 14678916 (online, PDF).
- ↑ Nature, zitiert nach: Wie UV-Strahlung schwarzen Hautkrebs fördert. In: Mitteldeutsche Zeitung. 14. Juni 2014, abgerufen am 12. Juni 2014.
- ↑ I. Moll: Duale Reihe Dermatologie. ISBN 3-13-126687-2.
- ↑ R. Dummer u. a.: Melanozytäre Nävi und kutanes Melanom. (PDF) In: Schweizer Medizinisches Forum, 10, 2002, S. 224–231.
- ↑ a b c d e R. Dobrowolski: In-vitro- und In-situ-Analyse des Tumorsuppressorgens hp19ARF in malignen Melanomen. Dissertation, RWTH Aachen 2004, S. 8 (PDF).
- ↑ Krebsfrüherkennungsrichtlinie (Banz. Nr. 37, S. 871) vom 6. März 2008 (PDF)
- ↑ J. Malvehy, A. Hauschild, C. Curiel-Lewandrowski, P. Mohr, R. Hofmann-Wellenhof, R. Motley, C. Berking, D. Grossman, J. Paoli, C. Loquai, J. Olah, U. Reinhold, H. Wenger, T. Dirschka, S. Davis, C. Henderson, H. Rabinovitz, J. Welzel, D. Schadendorf, U. Birgersson: Clinical performance of the Nevisense system in cutaneous melanoma detection: an international, multicentre, prospective and blinded clinical trial on efficacy and safety. In: The British Journal of Dermatology. Band 171, Nr. 5, November 2014, ISSN 1365-2133, S. 1099–1107, doi:10.1111/bjd.13121, PMID 24841846.
- ↑ P. Mohr, U. Birgersson u. a.: Electrical impedance spectroscopy as a potential adjunct diagnostic tool for cutaneous melanoma. In: Skin Research and Technology. Mai 2013, Band 19, Nummer 2, S. 75–83, doi:10.1111/srt.12008
- ↑ David Globig: Dem Schwarzen Hautkrebs auf der Spur. Neue Laserlicht-Methode verbessert die Frühdiagnose. Deutschlandfunk, 20. Juni 2007, abgerufen am 14. Oktober 2008.
- ↑ Dieter Leupold: The stepwise two-photon excited melanin fluorescence is a unique diagnostic tool for the detection of malignant transformation in melanocytes. In: Pigment Cell & Melanoma Research, 2. Mai 2011, doi:10.1111/j.1755-148X.2011.00853.x.
- ↑ Matthias Scholz u. a.: En route to a new in vivo diagnostic of malignant pigmented melanoma. In: Pigment Cell & Melanoma Research, 23. Januar 2012, doi:10.1111/j.1755-148X.2012.00966.x
- ↑ C. Garbe u. a.: Deutsche Leitlinie: Malignes Melanom. Version 15, 2/2005.
- ↑ R. Hein: Das akrolentiginöse Melanom. (PDF; 312 kB) In: Deutsches Ärzteblatt 98, 2001, A-111–A-115.
- ↑ C. Garbe: Management des Melanoms. Verlag Springer, 2006, ISBN 3-540-28987-9 eingeschränkte Vorschau in der Google-Buchsuche
- ↑ C. Kisselbach u. a.: Frauen und kardiale neoplastische Manifestationen an Herz und Perikard. In: Herz 30/2005, S. 409–415.
- ↑ H. Roskamm: Herzkrankheiten: Pathophysiologie, Diagnostik, Therapie. Springer, 2004, ISBN 3-540-40149-0, S. 1339.
- ↑ Donald L. Morton u. a.: Sentinel-Node Biopsy or Nodal Observation in Melanoma. In: The New England Journal of Medicine Bd. 355, 28. September 2006, S. 1307–1317.
- ↑ J Meirion Thomas: Prognostic false-positivity of the sentinel node in melanoma. In: Nature Clinical Practice Oncology Bd. 5, 13. September 2007, S. 18–23.
- ↑ Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano, Lorenza Pastorino, Virginia Picasso, Elena Tornari, Vincenzo Ottaviano, Paola Queirolo: BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. In: OncoTargets and Therapy. S. 157–168, doi:10.2147/OTT.S39096.
- ↑ Gerald Falchook, Radhika Kainthla, Kevin Kim: Dabrafenib for treatment of BRAF-mutant melanoma. In: Pharmacogenomics and Personalized Medicine. S. 21, doi:10.2147/PGPM.S37220.
- ↑ Benjamin Scheier, Rodabe Amaria, Karl Lewis, Rene Gonzalez: Novel therapies in melanoma. In: Immunotherapy. Band 3, Nr. 12, Dezember 2011, S. 1461–1469, doi:10.2217/imt.11.136, PMID 22091682 (Review).
- ↑ Christoph Baumgärtel: Melanom – Neue Therapieoptionen. (PDF; 20,5 MB) 27. Februar 2012, S. 42, abgerufen am 27. Februar 2012.
- ↑ S. L. Topalian, M. Sznol u. a.: Survival, Durable Tumor Remission, and Long-Term Safety in Patients With Advanced Melanoma Receiving Nivolumab. In: Journal of Clinical Oncology. 32, 2014, S. 1020, doi:10.1200/JCO.2013.53.0105.

