„Canines Cushing-Syndrom“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Klinisches Bild: erg. |
→Behandlung: Chirurgie |
||
| Zeile 51: | Zeile 51: | ||
== Behandlung == |
== Behandlung == |
||
=== Medikamentelle Behandlung === |
|||
[[Datei:Trilostane Structural Formula V1.svg|mini|Strukturformel von Trilostan]] |
[[Datei:Trilostane Structural Formula V1.svg|mini|Strukturformel von Trilostan]] |
||
Der einzige zur Behandlung des Caninen Cushing-Syndrom zugelassene Wirkstoff ist [[Trilostan]]. Trilostan bewirkt über eine reversible [[Enzymhemmung|Hemmung]] der [[3β-Hydroxysteroid-Dehydrogenase]] die Bildung des Cortisols.<ref>{{Vetpharm |13647-35-3 |Name=Trilostan}}</ref> Vor der Einführung von Trilostan im Jahre 2001 durch [[Dechra Pharmaceuticals]] wurde auch [[Mitotan]] verwendet, welches selektiv ein [[Nekrose|Absterben]] der glucocorticoidproduzierenden Zellen auslöst.<ref>{{Vetpharm |53-19-0 |Name=Mitotan}}</ref> Die Behandlung muss auf jeden Fall überwacht werden, weil bei zu hoher Dosis eine [[Nebennierenrindeninsuffizienz|Nebennierenunterfunktion]] (Morbus Addison) ausgelöst werden kann. Diese zeigt sich vor allem in Abgeschlagenheit, Appetitlosigkeit, Schwäche, verminderter Leistungsfähigkeit, Gewichtsverlust und Erbrechen. Mit Absetzen des Trilostans oder Verringerung der Dosis verschwinden die Symptome aber wieder schnell.<ref>{{Literatur |Autor=Claudia E. Reusch |Titel=Primärer Hypoadrenokortizismus beim Hund (Morbus Addison) |Sammelwerk=Kleintierpraxis |Band=60 |Nummer=9 |Datum=2015 |Seiten=480–502 |DOI=10.2377/0023-2076-60-480}}</ref> |
Der einzige zur Behandlung des Caninen Cushing-Syndrom zugelassene Wirkstoff ist [[Trilostan]]. Trilostan bewirkt über eine reversible [[Enzymhemmung|Hemmung]] der [[3β-Hydroxysteroid-Dehydrogenase]] die Bildung des Cortisols.<ref>{{Vetpharm |13647-35-3 |Name=Trilostan}}</ref> Vor der Einführung von Trilostan im Jahre 2001 durch [[Dechra Pharmaceuticals]] wurde auch [[Mitotan]] verwendet, welches selektiv ein [[Nekrose|Absterben]] der glucocorticoidproduzierenden Zellen auslöst.<ref>{{Vetpharm |53-19-0 |Name=Mitotan}}</ref> Die Behandlung muss auf jeden Fall überwacht werden, weil bei zu hoher Dosis eine [[Nebennierenrindeninsuffizienz|Nebennierenunterfunktion]] (Morbus Addison) ausgelöst werden kann. Diese zeigt sich vor allem in Abgeschlagenheit, Appetitlosigkeit, Schwäche, verminderter Leistungsfähigkeit, Gewichtsverlust und Erbrechen. Mit Absetzen des Trilostans oder Verringerung der Dosis verschwinden die Symptome aber wieder schnell.<ref>{{Literatur |Autor=Claudia E. Reusch |Titel=Primärer Hypoadrenokortizismus beim Hund (Morbus Addison) |Sammelwerk=Kleintierpraxis |Band=60 |Nummer=9 |Datum=2015 |Seiten=480–502 |DOI=10.2377/0023-2076-60-480}}</ref> |
||
| Zeile 57: | Zeile 58: | ||
Neben der blutchemischen Kontrolle ist die Überwachung des Befindens durch den Hundehalter wichtig. Der Hersteller von Trilostan hat dafür mit dem Royal Veterinary College London zwei Fragebogen entwickelt. Mit einem werden Trinkverhalten und Harnabsatz, Appetit, Verhalten und Aktivität erfasst, der zweite dient der Beurteilung der Lebensqualität.<ref>[https://www.mein-hund-mit-cushing.de/therapiekontrolle ''Therapiekontrolle''], mein-hund-mit-cushing.de</ref> |
Neben der blutchemischen Kontrolle ist die Überwachung des Befindens durch den Hundehalter wichtig. Der Hersteller von Trilostan hat dafür mit dem Royal Veterinary College London zwei Fragebogen entwickelt. Mit einem werden Trinkverhalten und Harnabsatz, Appetit, Verhalten und Aktivität erfasst, der zweite dient der Beurteilung der Lebensqualität.<ref>[https://www.mein-hund-mit-cushing.de/therapiekontrolle ''Therapiekontrolle''], mein-hund-mit-cushing.de</ref> |
||
== Chirurgische Behandlung == |
|||
Da in der Mehrzahl der Fälle ein spontaner Hyperadrenokortizismus durch Tumoren verursacht wird, erscheint die chirugische Entfernung des auslösenden Tumors zunächst als naheliegendste Therapieoption. Für einseitige Nebennierentumoren liegen dazu mehrere Studien vor. Diese zeigen, dass einige Tumoren inoperabel waren, es zahlreiche Komplikationen geben kann, die zu einer Einschläferung führen und in einigen Fällen die gesteigerte Cortisolsekretion bestehen blieb oder nach einiger Zeit wieder auftrat.<ref>F. J. van Sluijs et al.: ''Results of adrenalectomy in 36 dogs with hyperadrenocorticism caused by adreno-cortical tumour''. In: '''Veterinay Quarterly''' Band 27, Nummer 3, 1995, S. 113–116. {{DOI|10.1080/01652176.1995.9694547}}, PMID 8525598.</ref> Die Entfernung eines Tumors der Hirnanhangsdrüse ist eine sehr schwierige Operation mit zahlreichen Risken. Die Sterblichkeitsrate liegt zwischen 8 und 19 %.<ref>Leticia Escauriaza et al.: ''A 3-Dimensional Printed Patient-Specific Surgical Guide to Facilitate Transsphenoidal Hypophysectomy in Dogs''. In: ''Frontiers in Veterinary Science'' Band 20, Juni 2022, {{DOI|10.3389/fvets.2022.930856}}, PMID 35795781, {{PMC|9251581}}.</ref> |
|||
== Weblinks == |
== Weblinks == |
||
Version vom 24. September 2022, 15:45 Uhr
Das Canine Cushing-Syndrom – nach Harvey Cushing, der die Erkrankung beim Menschen erstmals beschrieb – oder der Canine Hyperadrenokortizismus ist eine häufige hormonelle Erkrankung des Hundes, bei der hohe Blutspiegel an Glucocorticoiden auftreten, insbesondere des in der Nebenniere produzierten Cortisols (Hypercortisolismus). Ursache sind zumeist Tumoren der Hirnanhangsdrüse, die das die Nebenniere steuernde Hormon ACTH im Übermaß abgeben und somit eine Überproduktion von Cortisol auslösen. Noch häufiger tritt ein Cushing-Syndrom bei Hunden durch die übermäßige Gabe von synthetischen Glucocorticoiden wie Prednisolon oder Dexamethason auf. Diese werden zur Behandlung von Allergien, Autoimmunkrankheiten oder Entzündungen eingesetzt und können bei Langzeitanwendung das gleiche Krankheitsbild auslösen (iatrogenes Cushing-Syndrom). Typische Symptome der Erkrankung sind vermehrtes Trinken, vermehrter Urinabsatz, gesteigerter Appetit, Fettansatz im Bauchraum, dünne Haut und Muskelschwund. Zur Sicherung der Diagnose können verschiedene Labortests herangezogen werden. Zur Behandlung werden Arzneistoffe wie Trilostan eingesetzt, die über eine Enzymhemmung die Bildung des Cortisols unterdrücken.
Grundlagen

Die Nebenniere ist ein kleines, paariges Organ des Hormonsystems. Sie liegt vor der jeweiligen Niere und ist beim Hund etwa 2 × 1 cm groß. In der äußeren Schicht, der Nebennierenrinde, werden von strangartig angeordneten Zellen der Zona faciolata Glucocorticoide wie Cortisol und Corticosteron gebildet.[1] Die Steuerung der Cortisolproduktion erfolgt über die Hypothalamus-Hypophysen-Nebennierenrinden-Achse. Dabei wird bei Bedarf im Hypothalamus Corticotropin-releasing Hormone (CRH) gebildet, welches in der Hypophyse die Bildung von Adrenocorticotropin (ACTH) stimuliert. Hohe Spiegel von Cortisol hemmen dabei die Bildung und Ausschüttung der übergeordneten Steuerhormone CRH und ACTH (Feedback-Hemmung). Cortisol kann nach erfolgter Wirkung durch Oxidation reversibel (umkehrbar) in die inaktive Form Cortison umgewandelt werden oder durch Leberenzyme an der Doppelbindung zwischen vierten und fünften Kohlenstoffatom hydriert und damit irreversibel inaktiviert werden.[2]
Cotisol hat im Körper zahlreiche Wirkungen. Es bindet sich an spezifische Rezeptoren im Zellkern und stimuliert die Traubenzuckerneubildung (Gluconeogenese) in der Leber, hemmt die Proteinbiosynthese in Muskulatur und Bindegewebe, steigert den Eiweißabbau (Proteolyse), steigert den Fettabbau (Lipolyse), unterdrückt die Immunantwort und hemmt die Wundheilung.[3]
Krankheitsentstehung und Vorkommen
Prinzipiell können fünf Ursachen unterschieden werden[4]:
- Behandlung mit synthetischen Glucocorticoiden (iatrogenes Cushing-Syndrom)
- Spontanes Cushing-Syndrom
Die häufigste Ursache des Cushing-Syndroms ist die Behandlung mit synthetischen Glucocorticoiden (iatrogen, also durch den Tierärzt verursacht). Prednisolon oder Dexamethason werden häufig zur Behandlung von Allergien, Autoimmunerkrankungen oder Entzündungen eingesetzt. Je länger Glucocorticoide eingesetzt werden um so häufiger treten Krankheitsbilder wie ein Cushing-Syndrom oder eine Zuckerkrankheit als unerwünschte Arzneimittelwirkung auf, da diese Wirkstoffe zu einer Hemmung der Hypothalamus-Hypophysen-Nebennieren-Achse führen.[5]
Das spontane Cushing-Syndrom wird in 80 bis 85 % der Fälle durch Hyperplasie der kortikotropen Zellen des Hypophysenvorderlappens oder einen Tumor der Hirnanhangsdrüse verursacht. Die Zellen bilden dann vermehrt ACTH, welches die Zellen der Nebennierenrinde zur übermäßigen Bildung von Cortisol anregt.[6] In etwa 15 bis 20 % der Fälle sind Tumoren (Adenome und Karzinome) der Nebennierenrinde selbst für die vermehrte Cortisolproktion verantwortlich.[7] Die übrigen beiden Formen sind sehr selten. Beim ektopen ACTH-Syndrom sind es Tumoren außerhalb der Hirnanhangsdrüse, meist bösartige Tumoren des Diffusen neuroendokrinen Systems, die vermehrt ACTH bilden.[6] Das fütterungsabhängige Cushing-Syndrom tritt bei Tieren auf, die in der Nebennierenrinde fehlerhafte Rezeptoren, vor allem für das Glukoseabhängige insulinotrope Peptid, ausbilden. Bei diesen Tieren kommt es nach der Nahrungsaufnahme zu einer krankhaft gesteigerten Cortisolbildung.[7]
Für das spontane Cushing-Syndrom ermittelte eine britische Studie eine Inzidenz von 0,06 %. Die Erkrankung tritt vor allem bei älteren Tieren (> 7 Jahre) auf. Am häufigsten sind Bichon Frisé Border Terrier und Zwergschnauzer betroffen. Auch für Yorkshire Terrier, Jack Russell Terrier und Dackel sind häufiger betroffen. Für andere Hunderassen wie Foxterrier, Cavalier King Charles Spaniel, Boxer, Shih Tzu, Pudel, Irish Setter und Basset Hound ist eine rassebedingte Häufung beschrieben, allerdings basieren diese Angaben auf relativ kleinen Stichproben. Hundrassen wie Golden Retriever, Labrador Retriever, Border Collie und Cocker Spaniel scheinen dagegen deutlich seltener an einem Cushing-Syndrom zu erkranken.[8] Das in der Literatur beschriebene vermehrte Auftreten bei kastrierten Hündinnen[9] konnte diese Studie dagegen nicht bestätigen.
Klinisches Bild
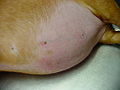
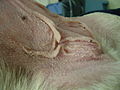
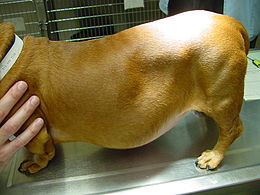
Die häufigsten Symptome eines Cushing-Syndroms sind vermehrtes Trinken (Polydipsie), vermehrter Urinabsatz (Polyurie), stark gesteigerter Appetit mit Fresssucht (Polyphagie), Hängebauch, Verdünnung der Haut (Hautatrophie) mit Haarausfall und Hautverkalkungen (Calcinosis cutis) sowie Muskelschwund und erhöhte Infektanfälligkeit. Der vermehrte Urnabsatz wird vermutlich über die cortisolbedingte Hemmung der Adiuretinsekretion und die Steigerung der glomerulären Filtrationsrate vermittelt und der dadurch bedingte Flüssigkeitsverlust wird durch vermehren Durst und Trinken ausgeglichen. Die Fresssucht resultiert aus der direkten Stimulation des Hungerzentrums im Hypothalamus, eventuell wird auch die Leptinfreisetzung gehemmt. Der Hängebauch entsteht durch Schwund (Atrophie) der Bauchmuskulatur, Zunahme des Fetts im Bauchraum, die Vergrößerung der Leber (Hepatomegalie) und die häufig stark gefüllte Harnblase. Milde Formen des Cushing-Syndroms zeigen sich häufig nur in Hautveränderungen mit Infektanfälligkeit in Form von Hautpilzerkrankung, eitriger Hautentzündung oder generalisierter Haarbalgmilbenerkrankung (Demodikose).[10]
-
Hängebauch und Haarausfall
-
Hautatrophie
-
Hautverkalkung (Calcinosis cutis)
-
generalisierte Demodikose
Weitere Krankheiitsanzeichen sind Abgeschlagenheit, Hecheln und Bluthochdruck. Da Cortisol mit zahlreichen anderen Komponenten des Hormonsystems Wechselwirkungen zeigt, können als Begleiterkrankungen eine Zuckerkrankheit, eine Wasserharnruhr, eine sekundäre Schilddrüsenunterfunktion, eine sekundäre Nebenschilddrüsenüberfunktion und Fortpflanzungestörungen auftreten.[11]
Diagnostik
Das klinische Bild ist bei voller Ausprägung bereits stark hinweisend auf die Erkrankung. Die Diagnose muss jedoch durch Laboruntersuchungen gesichert werden. Es gibt jedoch keinen Test, der sicher ein Cushing-Syndrom beweisen oder ausschließen kann, es gibt also immer falsch positive oder falsch negative Laborbefunde. Die Laboruntersuchungen müssen daher immer im Zusammenhang mit dem klinischen Bild betrachtet werden und gegebenenfalls müssen mehrere Tests kombiniert werden.
Laborbefunde
Spezifische Diagnostik

Als Goldstandard für ein spontanes Cushing-Syndrom gilt der Low-Dose-Dexamethason-Suppressionstest (LDDS), für das Erkennen eines iatrogenen ist er jedoch nicht geeignet. Für den Test wird eine Blutprobe am Morgen genommen und dem Hund danach eine geringe Dosis Dexamethason gespritzt. Vier und acht Stunden später wird erneut Blut abgenommen und in allen drei Proben das Cortisol bestimmt. Bei gesunden Hunden würde das Dexamethason über die Feedback-Hemmung (s. o.) die ACTH- und damit die Cortisolsekretion hemmen. Liegt der Cortisolspiegel nach 8 Stunden über 39 nmol/l (1,4 µg/dl) ist das stark hinweisend auf ein Cushing-Syndrom, liegt er unter 28 nmol/l (1 µg/dl) ist es unwahrscheinlich. Der 4-Stunden-Wert dient zu Unterscheidung eines primären von einem sekundären Hyperadrenokortizismus. Beim sekundären Hyperadrenokortizismus, also Tumoren der Hirnanhangsdrüse, kommt es bei etwa 60 % der Tiere in den ersten Stunden zu einer Senkung der ACTH-Sekretion und damit zu einem Abfall der Cortisolsekretion, bei Tieren mit einem Nebennierentumor unterbleibt diese Suppression.[12] Die Sensitivität des LDDS liegt bei 97 %, die Spezifität bei 70 %. Zur Unterscheidung zwischen primären und sekundären Hyperadrenokortizismus kann auch der High-Dose-Dexamethason-Suppressionstest (HDDS) eingesetzt werden. Hierfür wird im Vergleich zum LDDS die fünfache Menge an Dexamethason verabreicht und bei einem primären Hyperadrenokortizismus wird auch damit kaum die Cotisolbildung unterdrückt.[13]
Beim ACTH-Stimulationstest wird der Blutspiegel des Cortisols bestimmt, ACTH injiziert und nach einer Stunde erneut der Cortisolspiegel im Blut gemessen. Dieser Test ist für die Diagnostik des spontanen Cushing-Syndroms bedingt geeignet, aber er ist der einzige Test mit dem ein iatrogenes Cushing-Syndrom nachgewiesen werden kann. Stimulierte Cortisolwerte unter 138 nmol/l sprechen für eine Nebennierenrindeninsuffizienz oder ein iatrogenes Cushing-Syndrom, Werte zwischen 138 und 497 nmol/l sind physiologisch, Werte zwischen 497 und 662 nmol/l sind verdächtig und Werte darüber stark verdächtig für ein spontanes Cushing-Syndrom.[14]
Die Cortisolbestimmung im Blut erlaubt keine Aussage über die Krankheit. Hunde mit einem Cushing-Syndrom haben zwar statistisch höhere Cortisolwerte im Blut als gesunde, aber da Cortisol unregelmäßig (pulsatil) ausgeschüttet wird, Stresssituationen zu erhöhten Cortisolpegeln führen und erhebliche individuelle Unterschiede bestehen, sind solche Bestimmungen für die Diagnostik nicht geeignet. Etwas aussagekräftiger ist die Bestimmung in einer 24-Stunden-Urinprobe, da dadurch tageszeitliche Schwankungen ausgeglichen werden. Idealerweise wird Urin von zwei oder drei aufeinanderfolgenden Tagen eingesammelt und Cortisol im Verhältnis zum Kreatinin betrachtet (Cortisol-Kreatinin-Quotient). Die Sensitivität beträgt fast 100 %, es werden also alle Hunde mit einem Cushing-Syndrom erkannt, die Spezifität allerdings ist allerdings gering, es gibt also auch viele andere Ursachen für eine einen erhöhten Cortisol-Kreatinin-Quotienten. Bereits die Größe des Hundes hat einen Einfluss, da die Kreatininausscheidung abhängig von der Muskelmasse ist.[15]
Bildgebende Diagnostik
Zur Unterscheidung zwischen primären und sekundären Hyperadrenokortizismus wird mittlerweile häufig auf die Ultraschalluntersuchung der Nebenniere zurückgegriffen. Diese Untersuchungstechnik ist in der Tiermedizin mittlerweile breit verfügbar und kann Nebennierentumoren sicher nachweisen. Wenn die Laborbefunde für einen primären Hyperadrenokortizismus sprechen, ist eine Ultraschalluntersuchung zur Absicherung der Diagnose vor einer geplanten Operation zur Entfernung des Nebennierentumors unbedingt anzuraten. Die als Krankheitsursache viel häufigeren Hypophysentumoren ließen sich mit einer Magnetresonanzuntersuchung erkennen, allerdings ist diese nur in wenigen tiermedizinischen Einrichtungen verfügbar und nur in Narkose durchführbar.
Behandlung
Medikamentelle Behandlung

Der einzige zur Behandlung des Caninen Cushing-Syndrom zugelassene Wirkstoff ist Trilostan. Trilostan bewirkt über eine reversible Hemmung der 3β-Hydroxysteroid-Dehydrogenase die Bildung des Cortisols.[16] Vor der Einführung von Trilostan im Jahre 2001 durch Dechra Pharmaceuticals wurde auch Mitotan verwendet, welches selektiv ein Absterben der glucocorticoidproduzierenden Zellen auslöst.[17] Die Behandlung muss auf jeden Fall überwacht werden, weil bei zu hoher Dosis eine Nebennierenunterfunktion (Morbus Addison) ausgelöst werden kann. Diese zeigt sich vor allem in Abgeschlagenheit, Appetitlosigkeit, Schwäche, verminderter Leistungsfähigkeit, Gewichtsverlust und Erbrechen. Mit Absetzen des Trilostans oder Verringerung der Dosis verschwinden die Symptome aber wieder schnell.[18]
Zur Überwachung und Dosisanpassung der Behandlung mit Trilostan galt lange der ACTH-Stimulationstest als Goldstandard. Der Stimulationswert sollte bei guter Einstellung des Medikaments zwischen 6 und 18 µg/dl liegen.[14] Da ACTH einige Jahre nicht mehr hergestellt wurde, war dieser Test lange nicht möglich und es wurden Alternativen zum Trilostan-Monitoring gesucht. Dabei wurden der Serumcortisolspiegel vor der Trilostan-Gabe (prepill), ACTH-Plasmakonzentrations, die Serum-Haptoglobin-Konzentration, die Alanin-Aminotransferase (ALT), die Γ-Glutamyltransferase (γGT) und die Alkalische Phosphatase, die spezifische Dichte des Urins und der Cortisol-Kreatinin-Quotient im Urin als mögliche Marker getestet. Am besten eignet sich Haptoglobin zur Therapiekontrolle, hiermit konnten in einer aktuellen Studie 90 % der gut eingestellten und zwei Drittel der untertherapierten Hunde erkannt werden.[19]
Neben der blutchemischen Kontrolle ist die Überwachung des Befindens durch den Hundehalter wichtig. Der Hersteller von Trilostan hat dafür mit dem Royal Veterinary College London zwei Fragebogen entwickelt. Mit einem werden Trinkverhalten und Harnabsatz, Appetit, Verhalten und Aktivität erfasst, der zweite dient der Beurteilung der Lebensqualität.[20]
Chirurgische Behandlung
Da in der Mehrzahl der Fälle ein spontaner Hyperadrenokortizismus durch Tumoren verursacht wird, erscheint die chirugische Entfernung des auslösenden Tumors zunächst als naheliegendste Therapieoption. Für einseitige Nebennierentumoren liegen dazu mehrere Studien vor. Diese zeigen, dass einige Tumoren inoperabel waren, es zahlreiche Komplikationen geben kann, die zu einer Einschläferung führen und in einigen Fällen die gesteigerte Cortisolsekretion bestehen blieb oder nach einiger Zeit wieder auftrat.[21] Die Entfernung eines Tumors der Hirnanhangsdrüse ist eine sehr schwierige Operation mit zahlreichen Risken. Die Sterblichkeitsrate liegt zwischen 8 und 19 %.[22]
Weblinks
- Besitzerinformation der LMU München
- Überfunktion der Nebenniere – das Cushing-Syndrom, Informationen für Tierhalter von Dechra
- Cushing-Syndrom beim Hund, Laboklin Aktuell 2008
Literatur
- Renate Hämmerling: Caniner Hyperadrenokortizismus. In: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 60–89.
Einzelnachweise
- ↑ Franz-Viktor Salomon et al. (Hrsg.): Anatomie für die Tiermedizin. Enke Stuttgart. 4. Auflage 2020, ISBN 978-3-13-242675-7, S. 645.
- ↑ Ulrich Schweizer et al.: Steroidhormone – Produkte von Nebennierenrinde und Keimdrüsen. In: Peter C. Heinrich et al. (Hrsg.): Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 9. Auflage 2014, ISBN 978-3-642-17972-3, S. 497–498.
- ↑ Ulrich Schweizer et al.: Steroidhormone – Produkte von Nebennierenrinde und Keimdrüsen. In: Peter C. Heinrich et al. (Hrsg.): Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 9. Auflage 2014, ISBN 978-3-642-17972-3, S. 502.
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 60.
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 63.
- ↑ a b Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 62.
- ↑ a b Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 61.
- ↑ I. Schofield et al.: Frequency and risk factors for naturally occurring Cushing's syndrome in dogs attending UK primary-care practices. In: The Journal of small animal practice. Band 63, Nummer 4, April 2022, S. 265–274, doi:10.1111/jsap.13450, PMID 34881823, PMC 9299886 (freier Volltext).
- ↑ Gaia Carotenuto et al.: Cushing's syndrome-an epidemiological study based on a canine population of 21,281 dogs. In: Open Vet J Band 9, Nummer 1, April 2019, S. 27–32. doi:10.4314/ovj.v9i1.5, PMID 31086762, PMC 6500859 (freier Volltext).
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 66.
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 71.
- ↑ Michael D. Willard und Harold Tvedten (Hrsg.): Labordiagnostik in der Kleintierpraxis. Elsevier, Urban & Fischer, München 2011, ISBN 978-3-437-31387-5, S. 247–248.
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 76.
- ↑ a b Michael D. Willard und Harold Tvedten (Hrsg.): Labordiagnostik in der Kleintierpraxis. Elsevier, Urban & Fischer, München 2011, ISBN 978-3-437-31387-5, S. 247.
- ↑ Renate Hämmerling: Praxis der endokrinologischen Krankheitsbilder bei Hund und Katze: Von der Pathophysiologie zur Therapie. Georg Thieme Verlag, 2009, ISBN 978-3-8304-4208-0, S. 74.
- ↑ Eintrag zu Trilostan bei Vetpharm
- ↑ Eintrag zu Mitotan bei Vetpharm
- ↑ Claudia E. Reusch: Primärer Hypoadrenokortizismus beim Hund (Morbus Addison). In: Kleintierpraxis. Band 60, Nr. 9, 2015, S. 480–502, doi:10.2377/0023-2076-60-480.
- ↑ Stefania Golinelli et al.: Comparison of methods to monitor dogs with hypercortisolism treated with trilostane. In: J. Vet. Intern. Med., Band 35, Nummer 6, November 2021, S. 2616–2627. doi:10.1111/jvim.16269, PMID 34672018, PMC 8692213 (freier Volltext).
- ↑ Therapiekontrolle, mein-hund-mit-cushing.de
- ↑ F. J. van Sluijs et al.: Results of adrenalectomy in 36 dogs with hyperadrenocorticism caused by adreno-cortical tumour. In: Veterinay Quarterly Band 27, Nummer 3, 1995, S. 113–116. doi:10.1080/01652176.1995.9694547, PMID 8525598.
- ↑ Leticia Escauriaza et al.: A 3-Dimensional Printed Patient-Specific Surgical Guide to Facilitate Transsphenoidal Hypophysectomy in Dogs. In: Frontiers in Veterinary Science Band 20, Juni 2022, doi:10.3389/fvets.2022.930856, PMID 35795781, PMC 9251581 (freier Volltext).