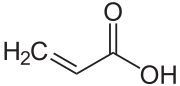
Acrylsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acrylsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H4O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit penetrantem, ekelerregendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 72,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,05 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
141 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
4,26[4] | ||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser, Ethanol und Diethylether[5] | ||||||||||||||||||
| Brechungsindex |
1,4224 (20 °C)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−383,8 kJ·mol−1 (Flüssigkeit)[9] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Acrylsäure oder Propensäure gehört zu den ungesättigten Carbonsäuren. Sie ist eine farblose, mit Wasser mischbare bei Raumtemperatur flüssige chemische Verbindung mit stechendem, essigähnlichem Geruch. Acrylsäure wirkt stark korrodierend und ist entzündlich. Ihre Salze und Ester (Acrylsäureester) werden Acrylate genannt.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Propiolacton-Verfahren[Bearbeiten | Quelltext bearbeiten]
Eines der ersten großtechnischen Verfahren zur Herstellung von Acrylsäure basiert auf der Thermolyse von Propiolacton, welches man bei Temperaturen von 140–180 °C und Drücken von 25–250 bar in Gegenwart von Phosphorsäure und Kupferpulver als Katalysator quantitativ zu Acrylsäure umsetzt.[10]
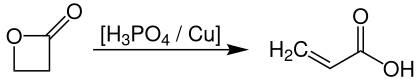
Dieses Verfahren wurde bereits vor langer Zeit durch wirtschaftlichere Prozesse, wie der Zweistufen-Oxidation von Propen, abgelöst, die vor allem durch die preisgünstigen Einsatzstoffe auf Basis petrochemischer Erzeugung bevorzugt wird. In neuerer Zeit wurden jedoch wieder Entwicklungen hinsichtlich der Thermolyse von Propiolaction vorangetrieben, das nun durch ein neuartiges Verfahren im Rahmen einer Carbonylierung von Ethylenoxid preiswert herstellbar ist.[11]
Propen-Oxidation[Bearbeiten | Quelltext bearbeiten]
Die großindustrielle Herstellung erfolgt durch eine zweistufige Oxidation von Propen mit Hilfe von Katalysatoren. In der ersten Stufe wird Propen mit Luft an Bismut-Molybdänoxid-Katalysatoren bei Temperaturen um 300 °C zu Propenal (Acrolein) umgesetzt. In der zweiten Stufe erfolgt die Oxidation von Propenal an Molybdän-Vanadium-Oxid-Katalysatoren bei Temperaturen von 250 bis 300 °C zu Acrylsäure.
Reppe-Verfahren[Bearbeiten | Quelltext bearbeiten]
Die Herstellung kann auch über Carbonylierung nach Walter Reppe aus Acetylen, Kohlenmonoxid und Wasser erfolgen, die Methode hat aber in der heutigen Zeit keine großtechnische Anwendung:[12]

Im Jahr 2010 betrug die weltweite Produktionskapazität von Acrylsäure etwa 5,3 Millionen Tonnen.[13]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Acrylsäure ist eine farblose Flüssigkeit, die unter Normaldruck bei 141 °C siedet. Die Verdampfungsenthalpie beträgt 53,1 kJ·mol−1.[14] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(p) = A−B/(T+C) (p in bar, T in K) mit A = 2,69607, B = 621,275 und C = −121,929 im Temperaturbereich von 293 K bis 343 K.[15] Die Substanz schmilzt bei 13,6 °C mit einer Schmelzenthalpie von 9,5 kJ·mol−1.[16] Die kritische Temperatur liegt bei 343 °C, der kritische Druck bei 52,43 bar.[17]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Acrylsäure neigt stark zur Polymerisation und wird mit kleinen Mengen Hydrochinonmonomethylether stabilisiert. Die Polymerisationswärme beträgt −67 kJ·mol−1 bzw. −930 kJ·kg−1.[18]
Acrylsäure erfordert weiters besondere Sorgfalt beim Transport im flüssigen Aggregatzustand mittels Pumpen, um eine Zerstörung von Anlagenteilen aufgrund spontaner Polymerisation zu verhindern.
Die Lagerung sollte unterhalb von 25 °C erfolgen. Dabei ist darauf zu achten, dass der Festpunkt nicht unterschritten wird. Bei der Kristallisation würde sich stabilisatorfreie Reinst-Acrylsäure als Feststoff abscheiden, die beim Auftauen, da unstabilisiert, explosionsartig polymerisieren kann. Die Polymerisationsenthalpie beträgt 75 kJ·mol−1.
Die Additionsreaktion mit Bromwasserstoff an Acrylsäure liefert 3-Brompropansäure.[19]

Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
Acrylsäure bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 48–55 °C.[2] Der Explosionsbereich liegt zwischen 3,9 Vol.‑% als untere Explosionsgrenze (UEG) und 19,8 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Grenzspaltweite wurde mit 0,86 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[2] Die Zündtemperatur beträgt 395 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ihre Hauptverwendung ist die Polymerisation zu Superabsorbern (Anwendung z. B. in Windeln), Acrylsäureester (die wiederum zur Herstellung von Polyacrylaten verwendet werden) und als anionisches Comonomer bei der Herstellung von Polymerdispersionen.
Verfahrenstechnik[Bearbeiten | Quelltext bearbeiten]
Da Acrylsäure in der chemischen Industrie in großen Mengen verarbeitet wird, zugleich jedoch gesundheitsschädlich und umweltgefährdend ist, und zudem zur Bildung von Polymeren neigt, sind besondere anlagentechnische Maßnahmen erforderlich:
- Wellendichtungslose Pumpen (Magnetkupplungspumpen oder Spaltrohrpumpen) sind zum Schutz des Betriebspersonals erforderlich.
- Die Betriebsparameter müssen laufend überwacht werden, da Acrylsäure bei Überschreitung der Druck- oder Temperaturgrenzen spontan polymerisiert, sich also von einem flüssigen Medium in den plastischen Stoff Polyacrylsäure verwandelt.
Letzterer Vorgang zerstört nicht nur die Pumpe, sondern potentiell die gesamte Anlage.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu ACRYLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Acrylsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-8.
- ↑ Fieser und Fieser: Organische Chemie. 2. Auflage, Verlag Chemie, Weinheim 1982, ISBN 978-3-527-25075-2.
- ↑ a b Eintrag zu Acrylsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-8.
- ↑ Eintrag zu Acrylic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 79-10-7 bzw. Acrylsäure), abgerufen am 2. November 2015.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 322.
- ↑ Patent EP2872475B1: Verfahren zur Herstellung von Acrylsäure aus Ethylenoxid und Kohlenmonoxid. Veröffentlicht am 8. Juni 2016, Anmelder: BASF SE, Erfinder: Marek Pazicky, Christian Raith, Rocco Paciello, Raphael Heinrich Brand, Marco Hartmann, Klaus Joachim Müller-Engel, Peter Zurowski, Wolfgang Fischer.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 99.
- ↑ Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 602.
- ↑ Yu. Ya. Van-chin-syan, V. V. Kochubei, V. V. Sergeev u. a.: Thermodynamic properties of some acids and aldehydes of the acrylic series. In: Sov. J. Chem. Phys. (Engl. Transl.) 70, (1996), 1789–1794.
- ↑ A. N.Gubkov, N. A. Fermor, N. I. Smirnov: Vapor Pressure of Mono-Poly Systems. In: Zh. Prikl. Khim. (Leningrad) 37, (1964), S. 2204–2210.
- ↑ M. K. Karabaev, T. P. Abduzhaminov, M. M. Kenisarin, A. A.Saidov: Thermodynamics of the crystal-liquid phase transition in acrylates and methacrylates. In: Izv. Akad. Nauk Uzb. SSR, Ser. Fiz.-Mat. Nauk, 1985, (5), 74–77.
- ↑ R. D’Souza, A. S. Teja: The prediction of the vapor pressures of carboxylic acids In: Chem. Eng. Commun. 61 (1987) 13–22, doi:10.1080/00986448708912028.
- ↑ Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme. Ausgabe 05/2015, ISBN 978-3-86825-069-5.
- ↑ E. Kowski: Ueber gebromte Propionsäuren. In: Justus Liebigs Annalen der Chemie. 342(1), 1905, S. 124–138, doi:10.1002/jlac.19053420109.



