Ethylenoxid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
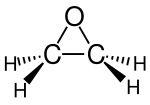
| ||||||||||
| Allgemeines | ||||||||||
| Name | Ethylenoxid | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C2H4O | |||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlich-etherischem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 44,05 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Dichte |
1,965 kg·m−3 (0 °C, 1013 hPa)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
10,5 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
leicht löslich in Wasser[1] | |||||||||
| Brechungsindex |
1,3597 (7 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
| |||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−78,0 kJ/mol (l) | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Ethylenoxid (kurz EO) ist ein farbloses, hochentzündliches Gas mit süßlichem Geruch und das einfachste Epoxid. Es ist ein wichtiges Zwischenprodukt bei der Herstellung von Ethylenglycol und anderen Chemikalien. Ethylenoxid wird als Desinfektionsmittel für Nahrungsmittel, organische Dämmstoffe (Wolle, Pflanzenfasern), Textilfasern und medizinische Geräte verwendet.
Als mutagenes Klastogen ist Ethylenoxid ein Gift, welches Chromosomenaberrationen hervorrufen kann. Ihm ist die UN-Nummer 1040 zugewiesen.
Nach IUPAC wird Ethylenoxid 1,2-Epoxyethan, nach dem Hantzsch-Widman-System Oxiran genannt.
Geschichte
Ethylenoxid wurde erstmals 1859 durch Charles Adolphe Wurtz hergestellt, er behandelte dazu 2-Chlorethanol mit einer Base.
Im Ersten Weltkrieg erlangte Ethylenoxid industrielle Bedeutung als Ausgangsprodukt für das Kühlmittel Ethylenglycol. Da mit Ethylenoxid die chemische Waffe Senfgas (Lost) hergestellt werden kann, fällt es unter das Außenwirtschaftsgesetz.[6]
1931 entdeckte der französische Chemiker Theodore Lefort die Herstellung von Ethylenoxid direkt aus Ethen und Sauerstoff mit Silber als Katalysator.
Herstellung
Ethylenoxid wurde erstmals 1925 von der Firma Union Carbide Chemicals nach dem Chlorhydrinverfahren hergestellt. Hierzu wurde Ethylen zunächst mit Chlor in alkalischer wäßriger Lösung zu Ethylenchlorhydrin umgesetzt, das anschließend mit Calciumhydroxid zu Ethylenoxid reagierte. Nachteile des Verfahrens waren eine beträchtliche Abwasserbelastung mit Chloriden und die Bildung von Halogenkohlenwasserstoffen (z. B. 1,2-Dichlorethan) als Nebenprodukte. Die erste katalytische Direktoxidation von Ethylen zu Ethylenoxid wurde in den 1930er Jahren ebenfalls von der Union Carbide technisch eingeführt.
Industriell wird Ethylenoxid heute ausschließlich durch die Umsetzung von Ethen und Sauerstoff bei 200 bis 300 °C und einem Druck von 10 Bar an einem Silberkatalysator in Rohrbündelreaktoren hergestellt.
Die übliche Ausbeute bei diesem Verfahren ist vom verwendeten Katalysatortyp abhängig und liegt auch in der großindustriellen Herstellung zwischen 80 und 90 %. Die parallel ablaufenden Nebenreaktionen sind die Totaloxidationen von Ethylen als auch von schon gebildetem Ethylenoxid zu CO2 und Wasser.
Auf die Herstellung von Ethylenoxid entfielen 2010 ca. 11 % der weltweiten Ethylenproduktion.[7] Dow Chemical nimmt 2016 in Jubail eine weitere Großanlage in Betrieb.
Eigenschaften
Ethylenoxid ist ein hochentzündliches Gas. Der Flammpunkt beträgt −57 °C[1] und die Zündtemperatur liegt bei 435 °C.[1] Es bildet mit Luft explosionsfähige Gemische, die untere Explosionsgrenze (UEG) liegt bei 2,6 %, die obere (OEG) bei 100 %.[1]
Verwendung
Ethylenoxidgas tötet Bakterien, Viren und Pilze ab, daher kann es zur Begasung von hitzeempfindlichen Substanzen verwendet werden. Die Sterilisation von Gewürzen mit EO wurde 1938 durch den amerikanischen Chemiker Lloyd Hall patentiert und wird auch heute noch in einigen Ländern praktiziert. In Deutschland ist der Einsatz von Ethylenoxid im Lebensmittelbereich seit 1981 verboten,[8] da hierbei giftiges 2-Chlorethanol entstehen kann. Die Sterilisation mit Ethylenoxid ist heute ein weit verbreitetes Verfahren in der industriellen Herstellung von Medizinprodukten, insbesondere von Einmalprodukten wie Verbandstoffen, Nahtmaterial oder Spritzen und Kathetern, aber auch von chirurgischen Instrumenten und empfindlichen Medizinprodukten (z. B. Cochleaimplantaten). Das Verfahren ist hochgradig standardisiert (u. a. ISO 11135, ISO 10993-7, EN 1422). Behandlung von Wattestäbchen mit Ethylenoxidgas kann DNS-Spuren so zersetzen, dass sie mit forensischen Methoden nicht mehr nachweisbar sind.[9]
Das meiste Ethylenoxid dient als Zwischenprodukt bei der Herstellung anderer Chemikalien. Ein Großteil des Ethylenoxids wurde für die Produktion von Ethylenglycol eingesetzt, heute ersetzt durch den OMEGA-Prozess. Weiter wird es für die Herstellung von Polyestern (beispielsweise PET) oder Hydroxyethylcellulose (HEC) benötigt. Lediglich etwa 2 % der Weltproduktion wird für die Sterilisation mit gasförmigem EO verwendet.
Ethylenoxid kann zu Polyethylenglycol (auch Polyethylenoxid) polymerisieren, welches ein ungiftiges und gut wasserlösliches Polykondensat darstellt. Es ist ebenfalls wichtig für die Herstellung von Tensiden (siehe Nichtionische Tenside), z. B. Polyalkylenglycolether.
Eine Kategorie von Ethylenoxidderivaten, die große wissenschaftliche Aufmerksamkeit erregt hat, sind die Kronenether, welche zyklische Oligomere des Ethylenoxids sind. Diese Verbindungen haben die Fähigkeit, ionische Substanzen in unpolaren Lösungsmitteln löslich zu machen, in welchen sie sonst unlöslich sind. Aufgrund hoher Kosten bleibt die Verwendung dieser Substanzen auf Laboranwendungen begrenzt.
Im militärischen Bereich wird Ethylenoxid als Brennstoff in Aerosol-Kleinbomben, die z. B. in Streubomben des Typs CBU-55 enthalten sind, verwendet.[10]
Verwendung im Vorratsschutz
Ethylenoxid wurde – um die Brennbarkeit herabzusetzen – zusammen mit einem höheren Anteil Kohlendioxid unter den Handelsnamen Cartox und T-Gas als Begasungsmittel von z. B. Silos, Lagerräumen und Containern verwendet.
Sicherheitshinweise
Ethylenoxid ist giftig und krebserregend beim Einatmen. Symptome einer Vergiftung sind Kopfschmerzen, Schwindel und Übelkeit/Erbrechen. Mit zunehmender Dosis kommt es zu Zuckungen, Krämpfen und schlussendlich zum Koma. Es ist für die Haut und die Atemwege reizend. Die Lunge kann sich Stunden nach dem Einatmen mit Flüssigkeit füllen (Lungenödem).
Ethylenoxid wird normalerweise druckverflüssigt in Kombination mit 10 % Kohlenstoffdioxid gelagert. Bei Normaldruck und Zimmertemperatur verdunstet es sehr schnell und verursacht Frostverbrennungen auf der Haut.
Bei Tieren hat es zahlreiche Fortpflanzungsdefekte wie Mutationen oder Fehlgeburten ausgelöst. Der Einfluss auf die menschliche Fortpflanzung ist noch nicht genau untersucht, es ist aber wahrscheinlich, dass die gleichen Effekte wie im Tierversuch auftreten. Die Auswirkungen von Ethylenoxid auf die menschliche Gesundheit und die Umwelt wurden unter REACH im Jahr 2012 im Rahmen der Stoffbewertung von Österreich geprüft.[11] Nach Abschluss der Stoffbewertung wurde gefordert, in einer harmonisierten Klassifizierung zusätzlich die Kennzeichnung zu allergischen Hautreaktionen (H-317) aufzunehmen.[12]
Siehe auch
- Ethylenimin (Aziridin), das stickstoffhaltige Analogon
- Thiiran (Ethylensulfid), das schwefelhaltige Analogon
Literatur
- Wolfgang Swodenk, Helmut Waldmann: Moderne Verfahren der Großchemie: Ethylenoxid und Propylenoxid. In: Chemie in unserer Zeit. 12. Jg., Nr. 3, 1978, ISSN 0009-2851, S. 65–70
Einzelnachweise
- ↑ a b c d e f g h i j k l Eintrag zu Ethylenoxid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-408.
- ↑ Eintrag zu Ethylene oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ CRC-Handbook 90. Aufl. (2009–2010), S. 5–22 ( vom 26. April 2015 im Internet Archive). – siehe auch Eintrag zu Ethylenoxid. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD.
- ↑ Außenwirtschaftsgesetz in der Fassung der Bekanntmachung vom 27. Mai 2009 (BGBl. I S. 1150), das durch Artikel 1 der Verordnung vom 12. Dezember 2012 (BAnz. 2012) geändert worden ist. (PDF; 1,3 MB) S. 200.
- ↑ Marktstudie Ethylen, Ceresana, Dezember 2010.
- ↑ Max Daunderer: Handbuch der Umweltgifte. Verlagsgruppe Hüthig Jehle Rehm, Ausgabe 6/2006.
- ↑ Jens Lubbadeh: Forensische DNA-Analyse – Schwachstelle Wattestäbchen, Meldung vom 26. März 2009 in Spiegel Online Wissenschaft.
- ↑ BAK to BSU/BSG – Equipment Listing Designation-Systems.net, Zugriff 30. Mai 2013
- ↑ Vorlage:CoRAP-Liste
- ↑ Substance evaluation – CoRAP – ECHA. In: echa.europa.eu. Abgerufen am 21. Oktober 2015 (englisch).






