1,2,3-Trihydroxybenzol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,2,3-Trihydroxybenzol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, glänzende Blättchen oder Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 126,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,45 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
309 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
9,01[3] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,561 (134 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1,2,3-Trihydroxybenzol (Trivialname Pyrogallol) ist ein Derivat des Benzols, ein dreiwertiges Phenol mit drei vicinalen Hydroxygruppen. Die beiden anderen Isomere sind 1,3,5-Trihydroxybenzol (Phloroglucin) und 1,2,4-Trihydroxybenzol (Hydroxyhydrochinon).
Geschichte
[Bearbeiten | Quelltext bearbeiten]1,2,3-Trihydroxybenzol wurde 1746 von Johann Heinrich Pott durch Sublimation von Galläpfeln hergestellt[7] und im Jahre 1786 zuerst von Carl Wilhelm Scheele durch Erhitzen von Gallussäure hergestellt, charakterisiert und benannt.[1] Der Trivialname Pyrogallol leitet sich von griechisch pyr = Feuer und Gallol von Gallussäure her; -ol bezieht sich dabei auf die Hydroxy-(OH)-Gruppen und deutet auf die Herstellungsweise hin.
Gewinnung/Darstellung
[Bearbeiten | Quelltext bearbeiten]1,2,3-Trihydroxybenzol kann am einfachsten durch Pyrolyse von Gallussäure unter Decarboxylierung hergestellt werden.[8]

Ebenfalls möglich ist die Darstellung durch Hydrolyse von 2,2,6,6-Tetrachlorcyclohexanon und die Oxidation von Resorcin mit Wasserstoffperoxid.[1] Es entsteht auch bei der Zersetzung von Tanninen.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,2,3-Trihydroxybenzol besteht im Reinzustand aus weißen Kristallnadeln, die sich aber an der Luft schnell grau-bräunlich färben.[1] Es ist ein starkes Reduktionsmittel und absorbiert begierig in alkalischer Lösung Sauerstoff aus der Luft; es komplexiert Metallionen (z. B. Fe3+ unter Blaufärbung). Bei längerem Stehen an der Luft (besonders in alkalischer Lösung) geht 1,2,3-Trihydroxybenzol durch Oxidation in Kohlenstoffdioxid, Essigsäure, Purpurogallin (Trihydroxybenztropolon) und weitere Zersetzungsprodukte über; die Lösung färbt sich dann dunkelbraun. Die wässrigen Lösungen reagieren aufgrund dieser Zersetzung allmählich saurer, daher stammt auch die Bezeichnung Pyrogallussäure, was jedoch für die Reinsubstanz kein zutreffender Name ist.
Verwendung
[Bearbeiten | Quelltext bearbeiten]1,2,3-Trihydroxybenzol wurde früher äußerlich bei Psoriasis und Lupus erythematodes[9] angewendet. In der analytischen Chemie dient 1,2,3-Trihydroxybenzol zur Absorption von Sauerstoff in der Gasanalyse, als Reagenz auf Antimon, Bismut, Niob, Osmium und Tantal, zur Reduktion von Silber-, Gold- und Quecksilbersalzen sowie zur Aktivitätsbestimmung von Peroxidasen.
In der Mikrobiologie findet 1,2,3-Trihydroxybenzol als Bestandteil des Pyrogallolverschlusses („Verschluss nach Wright-Burri“) Anwendung bei der Kultivierung von anaeroben Bakterien. Dabei wird die Absorption von Sauerstoff einer alkalischen 1,2,3-Trihydroxybenzollösung in einem luftdicht verschlossenen Gefäß ausgenutzt (meist mit Hilfe einer gesättigten Calciumcarbonatlösung). Hierzu wird das, auf ein geeignetes Trägermaterial (z. B. Watte) pipettierte 1,2,3-Trihydroxybenzol-Calciumcarbonat-Gemisch über dem Nährmedium angebracht.[10]
Es wird auch in Haarfärbemitteln eingesetzt und ist einer der ältesten photographischen Entwickler[1] und findet in der Holographie heute noch Verwendung[11]. 1,2,3-Trihydroxybenzol wird auch in der Lithographie, in Photoresists, in Beschichtungsmaterialien und in Klebstoffen genutzt. Es dient auch als Vernetzer und Härter für Epoxidharze, besonders zur Herstellung elektronischer Bauelemente. Die Verbindung wird auch als Zwischenprodukt zur Herstellung von verschiedenen organischen Verbindungen wie Pharmaka.[1] Teilweise wird 1,2,3-Trihydroxybenzol neben BHT auch als Stabilisator für Substanzen wie Diethylether[12] oder Carotinoiden[13] eingesetzt, die der Autoxidation durch Luftsauerstoff unter Bildung von Hydroperoxiden unterliegen.
Nachweis
[Bearbeiten | Quelltext bearbeiten]Zum qualitativ-analytischen Nachweis entsteht bei der Bromierung mit Kaliumbromid und Brom[14] das Dibromderivat, das einen Schmelzpunkt von 158 °C hat.[15]

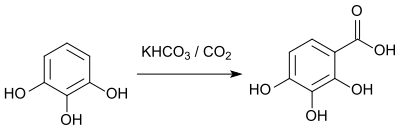
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die Carboxylierung von 1,2,3-Trihydroxybenzol durch eine Kolbe-Schmitt-Reaktion führt zur 2,3,4-Trihydroxybenzoesäure.[16]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]1,2,3-Trihydroxybenzol ist gesundheitsschädlich. Es wird auch allmählich durch die Haut aufgenommen. Im Tierversuch wie auch beim Versuch an menschlichen Zellen konnten Veränderungen der DNA festgestellt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m Eintrag zu Pyrogallol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. August 2018.
- ↑ a b c d e f Eintrag zu 1,2,3-Trihydroxybenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Januar 2020. (JavaScript erforderlich)
- ↑ CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. 1984, ISBN 0-8493-0303-6.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-36.
- ↑ Eintrag zu Pyrogallol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt 1,2,3-Trihydroxybenzol bei Merck, abgerufen am 18. Januar 2011.
- ↑ Pötsch u. a.: Lexikon bedeutender Chemiker. 1989, S. 349, Artikel Pott.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. 1. Auflage. Wiley, 2003, ISBN 978-3-527-30385-4, doi:10.1002/14356007.a19_313.
- ↑ Pamphlets on Biology: Kofoid collection. 1862, S. 61 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicole Borth, Brigitte Gasser, Regina Grillari, Renate Kunert, Ksenija Lopandic, Brigitte Lang, Diethard Mattanovich, Jutta Mattanovich, Christine Prenner, Beatrix Mayer-Reinprecht, Michael Sauer, Karola Vorauer-Uhl: Arbeitsprotokolle 2018/19, 791.128 Allgemeine Mikrobiologie Übungen. Hrsg.: Universität für Bodenkultur Wien. Wien 2018, S. 36 f.
- ↑ Graham Saxby: Practical Holography, Third Edition. CRC Press, 2010, ISBN 1-4200-3366-2, S. 63 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Joint FAO/WHO Expert Committee on Food Additives. Meeting: Compendium of Food Additive Specifications: Addendum 8. Food & Agriculture Org., 2000, ISBN 92-5104508-9, S. 53 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mark S. Meskin, Wayne R. Bidlack, R. Keith Randolph: Phytochemicals: Aging and Health. CRC Press, 2008, ISBN 978-1-4200-6138-3, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 331.
- ↑ Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8, S. 653.
- ↑ V. K. Ahluwalia: Intermediates For Organic Synthesis. I. K. International Pvt Ltd, 2005, ISBN 81-88237-33-7, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).

