Ranitidin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| (E,Z)-Isomerengemisch: (E)-Form (oben) und (Z)-Form (unten) | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Ranitidin | ||||||||||||
| Summenformel |
| ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Wirkstoffklasse |
Ulkustherapeutika | ||||||||||||
| Wirkmechanismus | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Essigsäure und Wasser, löslich in Methanol (Ranitidin·Hydrochlorid)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Ranitidin ist ein Arzneistoff aus der Gruppe der H2-Antihistaminika, der zur Kontrolle der Magensäureproduktion bei Sodbrennen, zur Behandlung der Refluxkrankheiten und zur Magengeschwür-Prophylaxe sowohl in der Humanmedizin als auch in der Veterinärmedizin angewendet wird. Neben den verschreibungspflichtigen Medikamenten gibt es Ranitidin mittlerweile gering dosiert auch freiverkäuflich in der Apotheke. Die Anwendung sollte jedoch nicht länger als sieben Tage ohne ärztliche Betreuung erfolgen.
Gewinnung und Darstellung
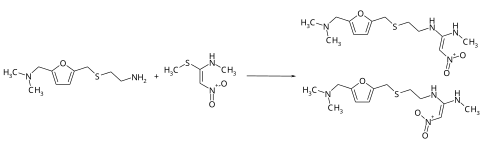
Die Synthese von Ranitidin erfolgt über die Herstellung von zwei Hauptvorprodukten, deren Umsetzung dann zum Zielmolekül führt. Die Synthese des einen Vorprodukts beginnt mit der parallelen Alkylierung und Aminierung von Furfurylalkohol zum 5-Dimethylaminomethylfurfurylalkohol,[6] der dann mit Cysteaminhydrochlorid zum Dimethylaminomethylfurfurylthioether umgesetzt wird.
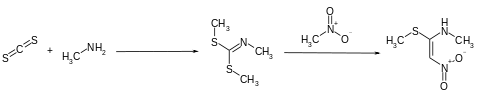
Die Synthese des zweiten Vorprodukts beginnt mit der Umsetzung von Schwefelkohlenstoff und Methylamin in Benzol mittels Natronlauge in Gegenwart von Tetrabutylammoniumbromid zum Dimethyl-N-methylcarboimidodithionat. Die Reaktion mit Nitromethan führt dann zum N-Methyl-1-methylthio-2-nitroethenamin.[7][8]
Das Zielmolekül erhält man durch die Umsetzung der Thioetherverbindung mit dem Nitroethenamin.[9]
Isomerie

Auf Grund der Wechselwirkung zwischen den Aminfunktionen und der Nitrogruppe über einen Sechsring ist die Rotationsbarriere der Kohlenstoff-Kohlenstoff-Doppelbindung nur sehr niedrig. Im NMR-Spektrum werden nur gemittelte Signale aus (E)- und (Z)-Isomer gefunden. Das System lässt sich bei 271 K einfrieren, wo dann separate Signale für (E)- und (Z)-Isomer gefunden werden. Bei Raumtemperatur liegen also beide Isomere das Ranitidins gleichzeitig vor.[2]
Wirkung
Ranitidin ist ein reversibler, kompetitiver Antagonist des Histamin-H2-Rezeptors (H2-Antihistaminikum). Durch diese Rezeptorblockade wird die histaminabhängige Produktion der Salzsäure und Freisetzung des Verdauungsenzyms Pepsin im Magen vermindert. Ranitidin ist etwa zehnmal stärker in dieser Wirkung als Cimetidin, hat aber dennoch deutlich weniger Nebenwirkungen.
Ranitidin wird nach oraler Aufnahme schnell im Darm resorbiert. Es verteilt sich im Körper, passiert auch die Plazenta und wird auch über die Milch ausgeschieden. Ranitidin wird in der Leber abgebaut und über die Nieren ausgeschieden. Die Wirkungsdauer beträgt etwa 8 bis 12 Stunden.
Anwendung
Ranitidin wird bei Geschwüren und Entzündungen des Magens, Labmagens, des Zwölffingerdarms (Duodenum), bei Gastritis, Ösophagitis und Refluxerkrankungen eingesetzt. Neuere Leitlinien ziehen allerdings Protonenpumpenhemmer den H2-Blockern in der Therapie der Gastritis, Ösophagitis und der Refluxerkrankungen vor. Ranitidin wird zum Beispiel auch zum Magenschutz während einer Cortison-Therapie verwendet sowie auch gelegentlich als Magenschutzmittel bei der Schmerztherapie mit nichtsteroidalen Antirheumatika, da diese häufig – insbesondere bei hohen Dosierungen und/oder bei der Langzeitanwendung – zu Magenschmerzen, Magenblutungen und Sodbrennen (saurem Aufstoßen) führen.
Beim Haushund kann Ranitidin auch zur Behandlung des Gastrinoms (canines Zollinger-Ellison-Syndrom), der Mastozytose und von Mastzell-Tumoren verwendet werden. Bei Katzen hat Ranitidin keinen signifikanten Effekt auf den pH-Wert des Magens.[11]
Kontraindikationen und Nebenwirkungen
Das Mittel darf nicht bei bekannter Unverträglichkeit eingesetzt werden. Bei Funktionsstörungen der Nieren sollte Ranitidin mit Vorsicht angewendet werden.
Obwohl nahezu alle Organe H2-Rezeptoren besitzen, sind die Wirkungen auf andere Organe kaum nachweisbar. Seltene Nebenwirkungen sind beim Menschen psychische Verwirrung und Kopfschmerzen, Agranulozytose, vorübergehende Herzrhythmusstörungen (Bradykardie), Hautausschlag, Übelkeit mit Erbrechen, Durchfall, Stuhlverstopfung und Libidoverlust.
Ranitidin sollte nicht mit Alkohol eingenommen werden, da Ranitidin die Bioverfügbarkeit von Ethanol signifikant erhöht und somit zu einer erheblich höheren Ethanolkonzentration führt. Dies ist auf die Verminderung seiner First-pass Extraktion zurückzuführen.
Handelsnamen
Junizac (D), Pylorisin (A), Ranic (A), Ranicux (D), Ranimed (CH), Raniprotect (D), Ranitic (D), Sostril (D), Ulcidin (CH), Ulsal (A), Zantac (A), Zantic (D, CH), zahlreiche Generika (D, A, CH)
Weblinks
- Eintrag zu Ranitidin bei Vetpharm
Einzelnachweise
- ↑ a b H.N. de Armas, Os.M. Peeters, N. Blaton, E. Van Gyseghem, J. Martens, G. Van Haele, G. Van Den Mooter: Solid state characterization and crystal structure from X-ray powder diffraction of two polymorphic forms of ranitidine base In: J Pharm Sci. (2009) 98: 146–158, doi:10.1002/jps.21395.
- ↑ a b c d T.J. Cholerton, J.H. Hunt, G. Klinkert, M. Martin-Smith: Spectroscopic studies on ranitidine – its structure and the influence of temperature and pH. In: J. Chem. Soc. Perkin Trans. 1984; 2: S. 1761–1766, doi:10.1039/P29840001761.
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 1396–1397, ISBN 0-911910-00-X.
- ↑ a b Datenblatt Ranitidine hydrochloride bei Sigma-Aldrich (PDF).
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ E.W. Gill, H.R. Ing: 953. Furan and tetrahydrofuran compounds analogous to ganglion-blocking agents of the 3-oxapentane-1 : 5-bistrialkylammonium series. In: J. Chem. Soc. 1958, S. 4728–4731, doi:10.1039/JR9580004728.
- ↑ Deshmukh, A.R.A.S.; Reddy, T.I.; Bhawal, B.M.; Shiralkar, V.P.; Rajappa, S.: Zeolites in organic syntheses: a novel route to functionalised ketene S,N-acetals in J. Chem. Soc. Perkin Trans. 1, 1990, 1217–1218, doi:10.1039/P19900001217.
- ↑ Mohanalingam, K.; Nethaji, M.; Das, P.K.: Second harmonic generation in push-pull ethylenes: Influence of chirality and hydrogen bonding in J. Mol. Struct. 378 (1996) S. 177–188, doi:10.1016/0022-2860(95)09180-7.
- ↑ Patent US5696275: Process for the manufacture of pharmaceutical grade ranitidine base. Veröffentlicht am 9. Dezember 1997, Erfinder: JAG MOHAN KHANNA, NARESH KUMAR, BRIJ KHERA, PURNA CHANDRA RAY.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 516, ISBN 3-342-00280-8.
- ↑ S. Šutalo, M. Ruetten, S. Hartnack, C. E. Reusch, P. H. Kook: The effect of orally administered ranitidine and once-daily or twice-daily orally administered omeprazole on intragastric pH in cats. In: Journal of veterinary internal medicine / American College of Veterinary Internal Medicine. Band 29, Nummer 3, 2015 May-Jun, S. 840–846, doi:10.1111/jvim.12580, PMID 25966746.